仿刺参(Apostichopus japonicus)摄食和运动器官的结构与功能
2013-03-20赵鹏杨红生孙丽娜
赵鹏,杨红生,孙丽娜
(1.中国科学院海洋研究所,山东 青岛 266071;2.国家海洋信息中心 天津 300171)
仿刺参(Apostichopus japonicus) 属棘皮动物门(Echinodermata),海参纲(Holothuroidea),楯手目(Aspidochirotida),刺参科(Stichopodidae)。主要分布于北太平洋沿岸浅海,是经济价值很高的海水养殖对象(廖玉麟,1997)。楯手目海参依靠触手黏附、扫取沉积物;摄食时充分伸展触手,分泌粘液、黏附沉积物碎屑,并将碎屑送入口咽部。海参纲部分生物对食物的粒度和有机物含量具有选择性,触手作为海参主要的摄食器官对食物的选择具有重要作用。研究仿刺参触手形态结构及粘液细胞的类型和功能对研究仿刺参的摄食有重要意义。
棘皮动物作为底栖生物,其行为和适应性与底质条件密切相关。附着、运动、取食、挖洞等行为有赖于管足对底质的黏附和抓取。管足是仿刺参主要的运动器官,研究仿刺参管足的形态结构及其肌肉组织、神经组织、粘液细胞的类型、分布对研究仿刺参的运动和分布具有重要意义。
对海参触手结构和功能的研究主要集中于枝手目海参成体。国外学者对楯手目部分种类海参触手和管足结构、功能进行了报道(Cameron et al,1984);国内学者对仿刺参水管系统的组织学结构也进行了研究(朱峰,2009),但从摄食、运动角度对仿刺参触手、管足的结构、功能的研究报道较少。此外,在人工条件下对摄食行为和摄食偏好进行研究,获取生物摄食、运动等基础知识对研究生物摄食生态学至关重要(Hudson,2005)。本研究旨在利用光镜、组织学、组织化学、电镜技术等方法对仿刺参触手、管足的结构及粘液细胞等的类型进行研究,为仿刺参摄食生态学的研究提供理论基础。
1 材料和方法
1.1 实验材料
仿刺参(体重50 g 左右) 取自山东青岛胶南市围堰养殖场,实验前,置于实验室循环水水槽内暂养7 d,水温15 ℃~18 ℃。每日投喂海泥、益参宝混合饵料(比例2 ∶1)。
1.2 实验方法
1.2.1 麻醉
将仿刺参放入盛有1L 新鲜海水的玻璃容器内。待海参触手、管足伸出后,向海水中逐滴滴加10%MgCl2,至仿刺参运动减弱,触手、管足伸展、不再收缩时为止。2 h 后,取出仿刺参个体,进行固定。
1.2.2 组织学和组织化学观察
仿刺参整体用Bouin 氏固定液固定24 h 后(仿刺参触手、管足较薄,固定液容易穿透,故无需向仿刺参体内注射固定液),保存于70%酒精中。取触手和管足,常规石蜡切片,切片厚度4 μm,Nikon 80i 型显微镜下观察和拍照。
H.E.染色用于显示组织细胞的基本结构;Milligan 三色染色用于观察肌肉、胶原的分布。
按爱茜蓝-过碘酸雪夫氏法(AB-PAS) 对触手、管足的粘液细胞、粘多糖进行染色定位。其中中性粘多糖呈红色、酸性粘多糖呈蓝色、混合性粘多糖呈紫红色。
1.2.3 扫描电镜观察
仿刺参整体用5%戊二醛固定液固定2 h 后,取管足、触手、口咽部组织块,经0.1 mol/L 磷酸缓冲液(pH=7.4) 冲洗后,放入0.1 mol/L 磷酸缓冲液保存。临界点干燥仪干燥,IB-3 型离子溅射仪喷金,KYKY2800B 型扫描电镜下观察、拍照。
1.2.4 透射电镜观察
将待取组织浸入3.5%戊二醛中15 min 左右后,取1×1×1 mm3仿刺参触手、管足组织块放入3.5%戊二醛固定液固定24 h。1%锇酸后固定,乙醇梯度脱水,Epon812 环氧树脂包埋,LKB 超薄切片机切片。醋酸铀和柠檬酸铅双重染色,日立H-7000 型透射电镜下观察、拍照。
1.2.5 行为学观察
在120×40×40 cm,水深20 cm 的玻璃水槽中,从水槽底部和侧面观察刺参摄食和运动行为。
2 结果
2.1 触手
2.1.1 扫描电镜观察
仿刺参口咽周围有20 个触手。触手由柄部、楯状触手组成。楯状触手由掌心中央向外形成大致对称的8 个主要分支,一些主要分支又形成次级、三级或更细的分支,在分支的腹面分布有许多1-3个一簇的乳突(图1.A)。楯状触手的乳突上密布大量的微绒毛和小孔(图1.B,1.C)。而位于楯状触手掌心的细胞则没有微绒毛(图1.D)。乳突和掌心上都分布有大量的粘液,黏附着颗粒物质(图1.C,1.D)。
2.1.2 组织学和组织化学观察
仿刺参的触手柄部自外向内依次为角质层、上皮、疏松结缔组织、致密结缔组织、神经层、纵肌层、间皮(图2.A,2.C)。致密结缔组织靠近神经层一侧分布有1-2 层细胞呈AB 阳性,含有酸性粘多糖(图2.F)。在结缔组织、触手分支基部,分布有眼点(图2.D)。

图1 触手的扫描电镜观察
仿刺参触手末端与柄部结构组成大部分相同(图2.E),仅在触手末端腹面上皮加厚,且分布有大量神经感觉细胞;触手末端结缔组织较薄(图2.B)。结缔组织、触手末端和眼点中含有大量酸性粘多糖(图2.C,2.D,2.E)。
2.1.3 透射电镜观察
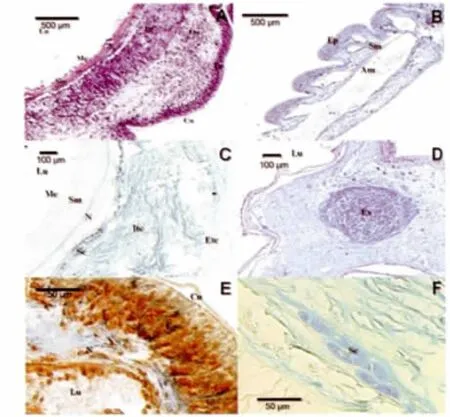
图2 触手的组织学结构和组织化学观察
透射电镜照片显示仿刺参触手乳突上皮主要由柱状细胞组成,柱状细胞中包含有电子密度高的颗粒囊泡,细胞核位于近基底面,而颗粒囊泡集中在上皮细胞的近游离面。上皮表层有大量微绒毛,一些微绒毛中含有颗粒囊泡。乳突上皮层中还分布有带微绒毛环的无纤毛分泌细胞(non-ciliated secretory cells,NCS) (图3.A)。
仿刺参水管系统内侧间皮主要由变形细胞组成,变形细胞内侧为纵肌纤维,肌纤维附近有大量线粒体。肌纤维内侧为致密的胶原纤维组成的基膜,这在水管系统和触手乳突上皮较为常见。基膜内侧为一层神经细胞,神经层内侧为致密结缔组织(图3.B)。

图3 触手超微结构观察
2.2 口咽
口咽的扫描电镜照片显示,口咽表皮环向内折,形成许多褶皱(图4.A)。表皮上分泌有大量粘液,黏附大量颗粒状物质,但表皮没有微绒毛分布(图4.B)。
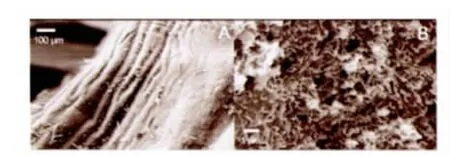
图4 口咽的扫描电镜照片
2.3 管足
2.3.1 扫描电镜观察
仿刺参的管足由柄部和吸盘组成(图5.A),吸盘分为外缘的外周区和中央凹陷。吸盘表面密布着大量微绒毛和小孔(图5.B)。吸盘上分布着粘液,黏附有颗粒物质。

图5 管足的扫描电镜照片
2.3.2 组织学和组织化学观察
仿刺参管足壁自内向外依次为间皮、纵肌层、神经层、致密结缔组织、疏松结缔组织、上皮、角质层(图6.A,6.D)。在神经层与结缔组织之间有一层呈AB 阳性的细胞,含有酸性粘多糖(图6.B)。
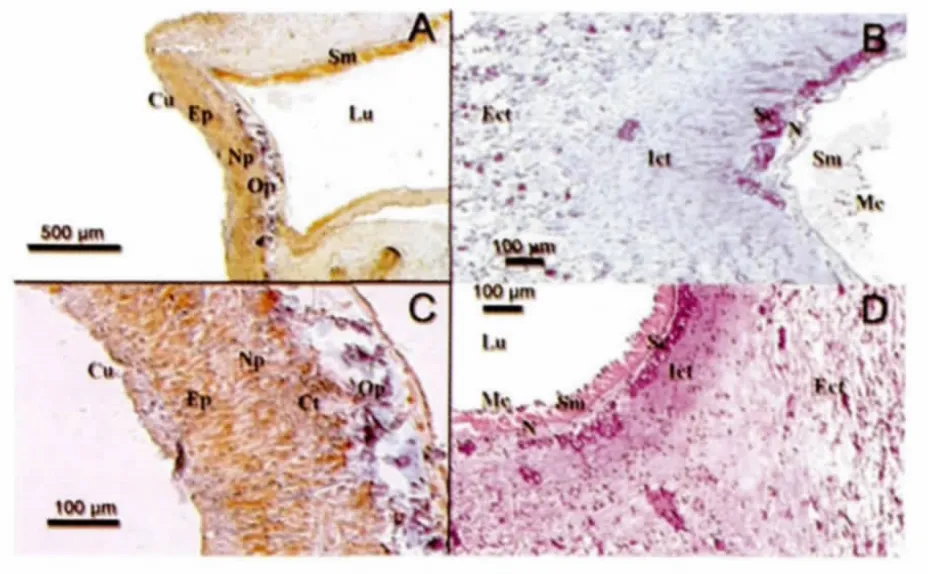
图6 管足的组织学和组织化学观察
仿刺参管足盘状端自外向内依次为角质层、上皮、神经板、结缔组织、端板、间皮(图6.C)。管足壁的纵肌层连接端板两端(图6.A)。管足顶端上皮加厚,酸性粘多糖含量丰富。
2.3.3 透射电镜观察
仿刺参管足纵切的透射电镜照片显示,仿刺参管足吸盘上皮有许多微绒毛和纤毛。着生纤毛的细胞是有纤毛的非分泌细胞(ciliated non-secretory cells,CNS),纤毛伸出表皮,有规则的“9+2”结构(图7.A)。无纤毛分泌细胞(non-ciliated secretory cells,NCS) 的细胞核位于细胞远离表皮一端(图7.B),细胞向表皮一侧伸出长的凸起到达管足吸盘末端(图7.B)。NCS 含有电子密度高的粘液颗粒,细胞顶端有充有该种粘液颗粒的微绒毛状细胞凸起,细胞顶端有环有微绒毛的开口,这种孔在扫描电镜照片中也能看到。一些NCS 绒毛状凸起中的粘液颗粒在管足吸盘附着后被排出(图7.A)。支持细胞(support cell,SC) 填充与以上细胞之间(图7.A)。
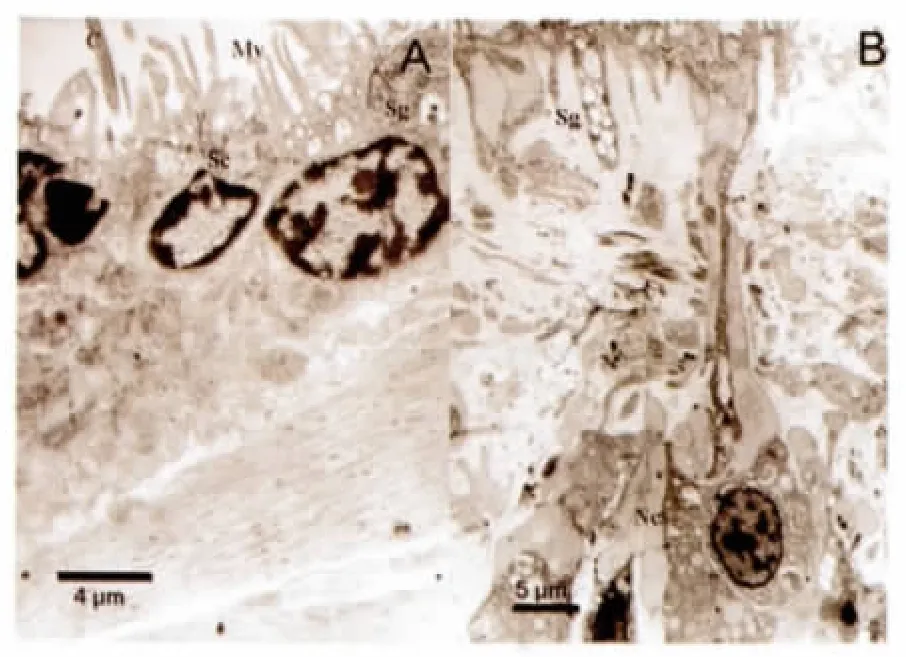
图7 管足吸盘表皮的超微结构观察
2.4 摄食和运动行为观察
2.4.1 摄食行为观察
刺参依靠触手摄食沉积物。摄食时,触手末端分支接触沉积物,并充分伸展呈“树枝”状,停留2-5 秒后,触手分支在触手柄部的带动下脱离沉积物表面,并插入口咽。在这一过程中,触手分支收缩,附着在触手上的沉积物颗粒部分脱落。同一时间段内,若干触手同时接触沉积物或插入口咽。
2.4.2 运动行为观察
刺参运动时,身体前端管足吸附在附着基上,中部体壁收缩并隆起呈倒U 型,后部向前移动;后部吸附附着基,中部伸展,前端向前移动。在光滑的附着基上,管足吸盘牢固地吸附在附着基上,在细沙或淤泥表面,管足不能牢固地附着,但管足深长插入沉积物,并留下“足印”。
3 讨论
3.1 摄食器官
仿刺参通过在沉积物上伸展、收缩触手,并将触手插入口咽摄取食物。伸展触手时,与水管系统末端分支相连的纵向分布的肌纤维舒张,包围坛囊(ampullae) 的肌纤维收缩,将水压入水管腔中,导致触手伸长;而触手壁的结缔组织则防止水管横向膨胀。水管腔延伸到仿刺参触手乳突的末端,使触手更容易伸长,纵肌纤维收缩引发触手收缩。仿刺参触手的8 个主要分支轴对称排列,在触手舒张时,能够向前向两侧伸展,使触手腹面表面积最大化。与触手柄部的上皮相比,仿刺参触手乳突上皮分布有大量柱状粘液细胞,分泌的粘液可以在微绒毛缝隙间形成粘液层,起到黏附食物的作用。结合仿刺参触手在沉积物表面舒展、接触,而非抓取食物的特点看,仿刺参主要通过粘液黏附食物并送入口咽中。仿刺参触手乳突腹面有大量微绒毛,而“掌心”则没有微绒毛,因此,仿刺参触手黏附食物颗粒的主要部位是触手的乳突。刺参神经层向触手柄部外侧和乳突发出树突,并延伸至乳突末端,这意味着触手乳突不仅仅分泌粘液还能接受并传递外界信号。此外,触手上分布的眼点也能感觉外界信号。
在对海参(Cucumaria pseudocurata) 的触手乳突由许多顶端着生微绒毛的分泌细胞组成,细胞中含有膜包被的粘液颗粒(粘液囊泡),这些颗粒无疑可以将乳突和食物粘合起来(Hermans et al,1983)。与其他海参相似,仿刺参触手乳突上皮微绒毛以及着生有环状微绒毛的无纤毛细胞也有电子密度高的粘液囊泡,这些粘液囊泡在形态学和组织化学上与其他无脊椎动物粘液腺体分泌的粘液囊泡相似(Hermans et al,1983),可从微绒毛中释放出来。触手乳突是与海胆球形叉棘上感觉小丘同源的感觉部位(Bouland et al,1982),其上皮的无纤毛粘液细胞能感受到机械和化学刺激(Fankboner et al,1978),而管足上相似的细胞则专司化学感觉(Burke,1980)。本研究中,仿刺参触手乳突存在无纤毛粘液细胞可能意味着触手能够感觉沉积物的成分和形态。不过也有学者认为,棘皮动物表皮细胞缺乏感觉特异性。Hermans 等(1983) 认为海参触手表面只有一种分泌粘液的细胞存在,海参无法主动脱去食物颗粒,即海参触手表面存在着一种仅能粘附捕获食物、而不能丢弃食物的单腺(single gland) 粘附机制。在本研究中,观察到一种含有电子密度高的颗粒囊泡的分泌细胞(图3A),虽然尚不清楚触手表面其他细胞的功能,不能断定仿刺参触手粘液细胞是单腺机制,但进一步研究仿刺参触手粘液细胞的类型和功能无疑是研究其摄食机制的重要方向。
仿刺参从沉积物表面撤回触手后,在口咽部环状分布的褶皱处刮掉食物。口咽处的粘液粘附食物,口咽收缩,食物进入消化道。观察中发现,一些颗粒从口咽中被排出,但尚不清楚这种现象是对食物的主动选择还是食物从口咽部脱落。与本研究的结果相类似,海参(C.pseudocurata) 触手表面只有一种分泌粘液的细胞存在,触手不能主动释放食物,而需借助口咽分泌的大量粘液完成(Hermans et al,1983)。仿刺参在口咽部刮掉食物这一现象可能预示着仿刺参触手不能主动脱去食物颗粒,缺乏挑拣、辨识沉积物颗粒的能力。
3.2 运动器官
仿刺参管足由柄部和吸盘组成,柄部通过与触手类似的机制延长、收缩。管足柄部肌纤维末端连接吸盘的筛板,肌纤维收缩导致吸盘与附着基之间形成低压空腔,使仿刺参附着在附着基上。虽然管足吸盘能强有力的吸附表面光滑的物体,但仿刺参在粒径小于管足直径的沉积物上仍能运动,管足像“锚”一样伸入沉积物内部固定住身体,再通过伸展和收缩体壁向前运动。这种现象意味着除管足吸盘“抽真空”式地吸附附着基以外,管足上还有其他参与附着的机制。Paine(1926) 首次通过实验证明了棘皮动物管足化学(粘液) 粘附的重要性,她发现海星(Asterias vulgaris) 带有粘液吸盘的粘附能力比吸盘单独的粘附能力高一倍。Smith(1937) 在对海星纲、海胆纲、海参纲代表性物种进行研究后,认为它们吸盘发达的吸附能力是由机械吸附和粘液黏附共同参与的。海参(Holothuria forskali) 管足没有吸盘,完全靠分泌粘液在附着基上移动(Flammang et al,1992)。Binyon(1972)对海星(A.vulgaris) 的研究中发现其吸盘44%的粘附能力来自于管足吸盘分泌的粘液。综上所述,仿刺参管足粘液粘附和吸盘吸附对其运动能力均有贡献。
与触手乳突一样,管足吸盘表面也有大量微绒毛,并有带微绒毛环的纤毛。管足柄部的组织学结构与触手柄部类似。管足吸盘的钙质筛板与柄部的纵肌纤维相连,吸盘下方有一层神经组织,神经细胞的末端到达吸盘上皮。Hermans 等(1983) 提出棘皮动物管足上存在着一种双腺(duo-gland) 粘附-脱粘附机制来控制管足粘附和脱离附着基。Flammang 等(1998) 发现海参H.forskali 吸盘表面有5 种细胞:无纤毛细胞(NCS,I 型、II 型)、支持细胞(SC)、有纤毛的非分泌细胞(CNS)、有纤毛的分泌细胞(CS)。他认为NCS 释放粘性分泌物,而CS 释放去粘性分泌物或抑制NCS 释放粘性分泌物。粘附时,管足表皮和附着基之间形成薄的粘液层;脱粘附时,CS 释放酶等终止粘性物质与粘液层分离,并使管足与基质脱离。本研究中(图7A、B),发现了细胞细长,细胞核位于神经板上方的NCS、细胞的细胞核位于上皮表层的SC 和CNS,CNS 细胞有伸出表皮的纤毛,与SC 细胞一起被认为是与感觉有关的细胞,未发现鞭毛向下着生的CS,但这并不意味着仿刺参没有该种细胞。双腺粘附-脱粘附机制仍可能作为解释仿刺参运动器官与附着基相互作用的一种学说。
4 小结
(1) 仿刺参触手和管足的组织结构相似,纵肌纤维和水管系统配合完成触手和管足的伸展、收缩和弯曲;触手和管足均含酸性粘多糖。
(2) 仿刺参触手乳突顶端分布有一种含有颗粒囊泡的粘液细胞,粘液细胞通过细胞表面的微绒毛分泌粘液粘附食物颗粒。仿刺参触手不能主动脱掉食物颗粒,而需在口咽部刮掉食物颗粒。
(3) 仿刺参管足吸盘表层有CNS、SC、NCS 细胞,它们在管足与附着基结合过程中起到重要作用。
Binyon J,1972. Effects of Diluted Sea-Water Upon Podial Tissues of Starfish Asterias Rubens L..Comparative Biochemistry and Physiology,41:1-8.
Bouland C,Massin C,Jangoux M,1982.The Fine-Structure of the Buccal Tentacles of Holothuria Forskali(Echinodermata,Holothuroidea).Zoomorphology,101:133-149.
Burke R D,1980. Podial Sensory Receptors and the Induction of Metamorphosis in Echinoids.Journal of Experimental Marine Biology and Ecology,47:223-234.
Cameron J L,Fankboner P V,1984. Tentacle structure and feeding processes in life stages of the commercial sea cucumber Parastichopus californicus (Stimpson). Journal of Experimental Marine Biology and Ecology,81:193-209.
Fankboner P V,1978.Suspension-Feeding Mechanisms of Armored Sea-Cucumber Psolus chitinoides Clark. Journal of Experimental Marine Biology and Ecology,31:11-25.
Flammang P,Michel A,Van Cauwenberge,et al,1998. A study of the temporary adhesion of the podia in the sea star Asterias rubens(Echinodermata,Asteroidea) through their footprints. Journal of Experimental Biology,201,2383-2395.
Flammang P,Jangoux M,1992.Functional-Morphology of the Locomotory Podia of Holothuria forskali (Echinodermata,Holothuroida).Zoomorphology,111:167-178.
Hermans C O,1983. The duo-gland adhesive system. Oceanography and Marine Biology,21:283-339.
Hudson I R,Wigham B D,Solan M,er al,2005. Feeding behaviour of deep-sea dwelling holothurians:Inferences from a laboratory investigation of shallow fjordic species. Journal of Marine Systems,57:201-218.
Paine V L,1926. Adhesion of the tube feet in starfishes. Journal of Experimental Zoology,45:361-366.
Smith N A,1937. The structure and function of thte tube feet in certain echinoderms.Journal of Marine Ecoloy Progress Series,2:257-264.
廖玉麟,1997.中国动物志棘皮动物门海参纲.北京:科学出版社.
朱峰,2009.仿刺参Apostichopus japonicus 胚胎发育和主要系统的组织学研究.硕士学位论文,青岛:中国海洋大学.
