青蒿素紫外光谱行为及测定方法研究
2013-03-20韩志慧
韩志慧
(天津市林业果树研究所,天津 300192)
青蒿(Artemisia annua L.)又称黄花蒿,为常用的中草药之一。青蒿素(artemisinin,QHS)是中国科学工作者从青蒿中提取、分离、鉴定的一种新型抗疟药,因其结构特殊,疗效高而毒性很低,引起国内外的重视[1,2]。尤其是近年来,青蒿素的国际市场行情很好,中国国内已有多家企业从事青蒿素的生产。青蒿广泛分布于中国南北各地,资源十分丰富。由于青蒿品种、种植条件、种植技术等的差异,从而导致青蒿中青蒿含量的不同[3]。
目前已有报道青蒿素的测定方法主要有反相高效液相色 谱法(RP-HPLC 法[4-6]、薄 层 色 谱 法[7]、红 外 光 谱 法[8]等。由于青蒿素仅在紫外区203nm 处有较弱的末端吸收,但与碱(0.2% NaOH)反应后,产生一化合物(α,β-不饱和酮酸盐,Q292),该物质在292nm 处有最大吸收,可用于紫外分光光度法测定。化合物(Q292)在pH 5.58~6.04 条件下,又可定量地转化为化合物Q260,该物质在260nm 处有最大吸收,可用于高效液相法定量测定青蒿素含量。目前研究[9]报道应用较多的是RP-HPLC法。
但对于青蒿素生产企业而言,在青蒿的收购时期,需要对大量的原料样品进行检测。由于液相检测每检测一个样品,包括前期准备时间,通常需要5~10 min,因此需要多台液相色谱同时工作,这务必需要增加检测成本。本试验利用青蒿素与碱反应后产生的化合物(Q292)在292nm 处有最大吸收的特点,建立一个快速、准确的低成本的青蒿素紫外分光光度法。
1 材料与方法
1.1 原料、试剂及仪器
青蒿:天津药材公司;
青蒿浸膏:青蒿素含量9.0%(RP-HPLC 法测定),本实验室自制;
青蒿素对照品:99.9%,美国Sigma公司;
石油醚(30~60℃)、95%乙醇、NaOH 等:均为分析纯,天津科威试剂公司;
紫外可见分光光度计:UV-1750,日本岛津公司;
电子天平:AUW120D,长沙湘仪公司。
1.2 试验方法
1.2.1 提取方法 参考文献[10],略有改动,将经过筛选的青蒿叶置于烘箱中40℃烘烤3h后取出,用瓷乳钵研磨至粉状,过筛60目,制成青蒿叶粉,储于干燥器中备用。准确称取青蒿样品1g置纸筒中,置于索氏提取器中,加入石油醚浸泡,提取温度50 ℃,提取至溶剂无色,提取时间2h。浓缩去石油醚,得青蒿浸膏。
1.2.2 浸膏的处理 取青蒿浸膏58 mg,加入50 mL 石油醚溶解后,置分液漏斗中,再加入50 mL 2% NaOH 溶液振荡静置分层,弃去下层碱液后,加入50 mL 蒸馏水洗去碱溶性部分至中性。经水洗后的提取液置于圆底烧瓶中55 ℃减压浓缩,得到含青蒿素的浸膏,再以95%乙醇溶解浸膏,并定容于50mL容量瓶,得样品原液(A)。
另取青蒿浸膏58mg,加入95%乙醇溶解浸膏,并定容于50mL容量瓶,得样品原液(B)。
1.2.3 青蒿素紫外光谱行为测定与标准曲线的制定 精确称取80 ℃干燥至恒重的青蒿素标准品5.0 mg置50 mL 容量瓶中,用95%乙醇溶解稀释至刻度,得标准溶液C。
(1)青蒿素紫外光谱行为的考察:吸取标准溶液C 8mL于50mL容量瓶中,以95%乙醇补充至10 mL,补加0.2%NaOH 溶液至刻度,置(50±1)℃水浴中反应30 min,流水冷却至室温,得标准溶液C1。
另吸标准溶液C 8mL于50mL容量瓶中,以95%乙醇补充至10mL,补加蒸馏水至刻度,置(50±1)℃水浴中反应30min,流水冷却至室温,得标准溶液C2。分别考察标准溶液C1和C2的紫外光谱行为。
(2)青蒿素标准曲线的制定:分别吸取标准溶液C 0,2,4,6,8,10 mL 于50 mL 容 量 瓶 中,以95%乙 醇 补 充 至10mL,补加0.2% NaOH 溶液至刻度,置(50±1)℃水浴中反应30 min,流水冷却至室温。以空白为对照,并测定292nm 处的吸光值,制定标准曲线。
1.2.4 待测溶液的制备与测定
(1)样品溶液A1:吸取样品原液A 5mL于50mL容量瓶中,补充95%乙醇至10mL后,加入0.2% NaOH 溶液至刻度。50 ℃水浴中反应30 min后取出,流水冷却至室温。以空白为对照,考察溶液的紫外光谱行为,记录292nm 处的吸光值。
(2)样品溶液A2:吸取样品原液A 5mL于50mL容量瓶中,补充95%乙醇至10mL后,加入水至刻度。50℃水浴中反应30min后取出,流水冷却至室温。以空白为对照,考察溶液的紫外光谱行为,记录292nm 处的吸光值。
(3)样品溶液B1:吸取样品原液B 5mL 于50mL 容量瓶中,补充95%乙醇至10mL后,加入0.2% NaOH 溶液至刻度。50 ℃水浴中反应30 min后取出,流水冷却至室温。以空白为对照,考察溶液的紫外光谱行为。
(4)样品溶液B2:吸取样品原液B 5mL 于50mL 容量瓶中,补充95%乙醇至10mL后,加入水至刻度。50℃水浴中反应30min后取出,流水冷却至室温。以空白为对照,考察溶液的紫外光谱行为。
浸膏中青蒿素含量按式(1)计算:

2 结果与分析
2.1 青蒿素对照品的紫外光谱行为
标准溶液C1和C2紫外光谱行为见图1和图2。由图1和图2可知,青蒿素经0.2% NaOH 溶液处理前后标准溶液C1和C2的紫外光谱行为不同。图2 的最大吸收波长为292nm,图1为212nm。这是由于50 ℃时青蒿素在0.2%NaOH 溶液中,定量生成α,β-不饱和酮酸盐,得到一吸收峰在292nm 处的化合物。青蒿素对照品不经0.2% NaOH 溶液于50 ℃处理,溶液在292nm 处吸收很小。
2.2 青蒿样品液A 的紫外光谱行为
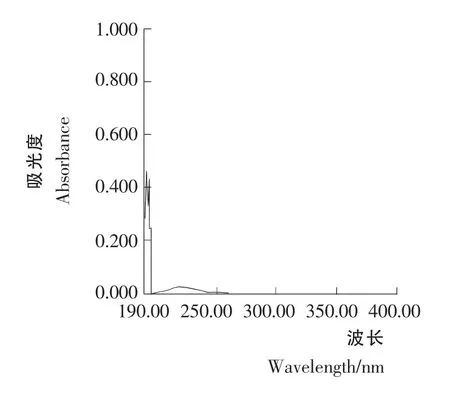
图1 青蒿素标准溶液C1 的紫外光谱Figure 1 Artemisinin standard solution C1 UV spectral behavior
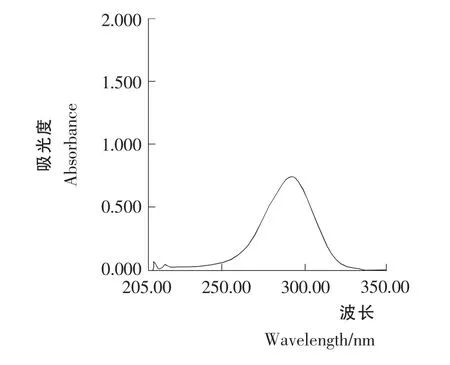
图2 青蒿素标准溶液C2 的紫外光谱Figure 2 Artemisinin standard solution C2 UV spectral behavior

图3 青蒿素样品溶液A1 的紫外光谱Figure 3 Artemisinin sample solution A1 UV spectral behavior

图4 青蒿素样品溶液A2 的紫外光谱Figure 4 Artemisinin sample solution A2 UV spectral behavior
图3青蒿素样品溶液A1和A2紫外光谱扫描结果见图3和图4。由图3和图4可知,样品溶液A1在292nm 处有较强的吸收,其吸收光谱同青蒿素对照品在260~290nm 处基本相似,在292nm 处的吸光值为0.766;样品溶液A2在292nm 处的吸收较弱,吸光值为0.122。这一结果表明样品溶液A1有α,β-不饱和酮酸盐存在;而样品溶液A2由于没有添加0.2% NaOH,没有α,β-不饱和酮酸盐生成,因此其在292nm 处的吸收不是来源于青蒿素,而是来源于样品原液中的其它非青蒿素类物质的吸收,属于背景吸收,在进行样品的定量测定时应将此部分吸光值减去。
2.3 青蒿样品原液B的脱蜡处理对紫外光谱影响
青蒿素样品溶液B1和B2紫外光谱扫描结果见图5和图6。由图5和图6可知,样品溶液B1和B2在292nm 的吸光值要大于相应的溶液A1和A2的吸光值。这一结果表明,青蒿浸膏中蜡质物质对青蒿素的吸收有影响。如果青蒿浸膏不经2% NaOH 溶液的脱蜡处理,青蒿浸膏在292nm下吸光值将升高,从而造成青蒿素含量测定结果偏高。
2.4 标准曲线的考察
青蒿素的标准曲线见图7。对图7标准曲线进行线性回归,回归方程:

式中:
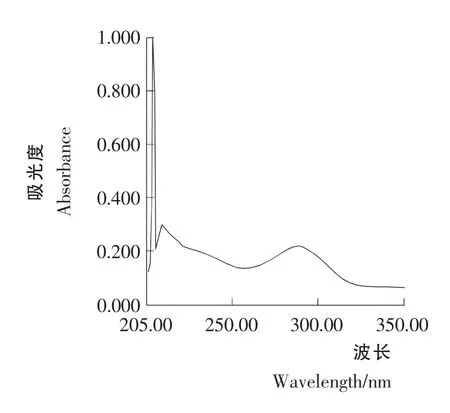
图5 青蒿素样品溶液B1 的紫外光谱Figure 5 Artemisinin sample solution B1 UV spectral behavior

图6 青蒿素样品溶液B2 的紫外光谱Figure 6 Artemisinin sample solution B2 UV spectral behavior

图7 青蒿素的标准曲线Figure 7 The standard curve of Artemisinin
x—— 青蒿素含量,mg;
y——292nm 处的吸光值(OD)。
回归结果表明青蒿素在292nm 的吸光值与青蒿素含量0.2~1.0mg/mL范围下呈线性相关。
2.5 自制青蒿浸膏中青蒿素含量的测定
经吸光度测定样品A1中ODA1=0.766,样 品A2中ODA2=0.122,ΔOD =ODA1-ODA2=0.644。将ΔOD 代入标准曲线回归方程,可推得样品溶液A1中青蒿素含量为0.539 mg。进一步可推得自制浸膏中青蒿素含量为9.29%。该测定结果同RP-HPLC 测定数据9.0%基本一致。如果直接将样品A1的ODA1=0.766代入回归方程,计算得出浸膏中青蒿素含量为11.2%,这一数值将比实值高出24.4%,使测定结果偏高。
3 结论
青蒿浸膏经2% NaOH 溶液脱蜡处理后,可有效消除青蒿原料中蜡质对青蒿素在292nm 下吸光值的影响。针对青蒿素α,β-不饱和酮酸盐在292nm 下具有特征吸收,建立了青蒿素含量测定的紫外分光光度法。HPLC 法和紫外分光光度法检测技术广泛应用食品和药品的检测工作[11,12]。HPLC法每检测一个样品需要5~10 min;而紫外分光光度法上机测定一个试样只需30s~1 min。另外,购置一台液相色谱仪需要数十万元的资金,而购置一台紫外分光光度计只需一万元左右的资金。因此,应用紫外分光光度法可太大缩短了检测时间,提高了检测效率,降低检测费用。因此,紫外分光光度法相对于RP-HPLC法而言,具有投资少,检测量大,检测速度快的特点,该技术可广泛应用于青蒿素加工生产企业的原料收购中。
1 Tu Youyou.The discovery of artemisinin(qinghaosu)and gifts from Chinese medicine [J].Nature Medicine,2011,10(17):1 217~1 220.
2 国家药典委员会.中华人民共和国药典(二部)[S].北京:中国医药科技出版社,2010:420,1 156.
3 向文,李琳,刘吉华,等.UPLC-UV 法测定不同产地青蒿中青蒿素的含量[J].中国野生植物资源,2012,31(4):28~31.
4 张东,杨岚,屠呦呦,等.HPLC-UV-ELSD 法同时测定青蒿中青蒿素、青蒿乙素和青蒿酸的含量[J].药学学报,2007,42(9):978~981.
5 陈靖,赵瑞,陈俊,等.HPLC-UV-ELSD 联用测定黄花蒿叶片中青蒿素及相关倍半萜的含量[J].沈阳药科大学学报,2008,25(11):897~901.
6 杨兆丽,张美义,詹利之,等.高效液相色谱法测定复方伯氨喹片中青蒿素与磷酸伯氨喹的含量[J].广州中医药大学学报,2011,28(5):522~525.
7 胡淼,钱国平,苏宝根,等.硅胶柱层析纯化青蒿素[J].华西药学杂志,2005,20(4):283~285.
8 刘炳玉,田惠君,崔进,等.青蒿素的红外光谱定量测定[J].药物分析杂志,1994,14(4):47~48.
9 张犇,邹婷,王剑文.青篙素检测方法的研究近况[J].抗感染药学,2008,5(4):201~204
10 赵兵,王玉春,吴江,等.青蒿素提取条件研究[J].中草药,2000,31(6):421~423.
11 张志国,王硕,生庆海.HPLC-ELSD法检测液态奶中的低聚半乳糖[J].食品与机械,2011,27(3):68~70.
12 陈意光,阮文红,罗东辉,等.紫外分光光度法测定食品模拟物中六价铬和铝[J].食品与机械,2012,28(5):65~67.
