知母中活性成分对α-萄糖苷酶的抑制研究
2013-03-20陈丽华潘自红曹云丽马庆一
陈丽华 潘自红 曹云丽 马庆一
(平顶山学院化学化工学院,河南 平顶山 467000)
餐后高血糖是糖尿病病情加重并导致严重并发症的主要因素[1,2],因此,合理控制餐后血糖异常升高,在防治糖尿病尤其是Ⅱ型糖尿病的防治上起到至关重要的作用。食物中碳水化合物等在唾液和胰α-淀粉酶作用下先水解为寡糖,后经小肠上皮绒毛膜刷状缘上α-葡萄糖苷酶的作用生成单糖再进入血液是餐后血糖升高的主要原因,若能控制血糖生成的关键酶α-葡萄糖苷酶的活性就可以减缓寡糖水解,阻碍糖的吸收,降低餐后血糖的峰值,使其平稳于一定水平上[3]。
知母为百合科植物知母的干燥根茎,是中国传统常用中药材。知母的根茎中除了含有芒果苷、胆碱、尼克酰胺、鞣酸、烟酸以及4种知母多糖外,还含铁、锌、锰、铜、铬、镍等多种金属元素以及黏液质、还原糖等[4],具有清热泻火、生津润燥之功效[5],早在《神农本草经》中已有知母可用于消渴症治疗的记载,且为“玉液汤”主药。卢盛华[6]发现知母聚糖能降低正常小鼠和由四氧嘧啶诱发的高血糖大鼠的血糖;研究人员[7]还发现用知母水性提取物0.15g/kg注射糖尿病小鼠,5h后血糖下降80%且尿中酮体减少。但从目前所报道的知母降血糖的研究情况来看大多都还十分粗浅[8],仅仅停留在初级水平上,本课题旨在系统研究知母中潜在的活性物质对α-葡萄糖苷酶抑制活性的贡献,从而为进一步研究构效关系和研发降糖新药提供理论依据。
1 材料与方法
1.1 试剂与仪器
知母:郑州药材批发市场;
4-硝基苯-α-D-吡喃葡萄糖苷(PNPG):德国E.Merck公司;
α-葡萄糖苷酶:美国Sigma公司;
对硝基苯酚(PNP):仪征市鼎信化工有限公司;
大孔树脂:APD-600型,西安树脂厂;
其它所用试剂:均为国产分析纯;
微量移液器:QYQ 型,北京表云航空仪表有限公司;
三用紫外灯:ZF-C型,上海康禾光电器有限公司;
紫外可见分光光度计:756型,上海分析仪器厂;
转蒸发器:ZFQ85A 型,上海医专械机厂;
磁力搅拌器:85-2型,江苏中大仪器厂;
高速台式离心机:TGL-18C型,上海安亭科学仪器厂;
离心沉淀器:80-1型,上海手术器械厂。
1.2 试验方法
1.2.1 知母各成分的提取
(1)原料的处理:知母,37 ℃烘干,粉碎,取过40目筛的知母粉于冰箱4 ℃冷藏,备用。
(2)知母水溶性总物质的提取:称取上述冷藏备用的知母粉20g置于磨口圆底烧瓶中(500mL),加蒸馏水(初次提取固液比设为1∶8(m∶V)),烧瓶置于恒温水浴中60 ℃搅拌2h后,立即抽滤,滤渣再用蒸馏水重提2h(再次提取固液比设为1∶5(m∶V)),抽滤,合并两次滤液,真空浓缩至40mL。加聚酰胺15% (m/V)静置过夜,抽滤去掉聚酰胺;滤液再加少量大孔树脂(APD-600)放置24h,抽滤;加硅藻土和活性炭各5% (m/V)于55 ℃脱色0.5h,抽滤,滤液定容到50mL,即为知母水粗提液[9]。
(3)知母中皂苷与知母黄酮的提取与纯化:取知母粉20g,置于500 mL 圆 底 烧 瓶 中,加 入95%乙 醇[10,11]提 取 两次,提取方法同1.2.1(2)中,两次抽滤后滤液合并,并于低温(35 ℃)真空浓缩至膏状,溶于20mL 蒸馏水,石油醚萃取3次(15mL×3);下层水相再用正丁醇萃取4次(10mL×4);随后合并丁醇相并减压蒸干,移样枪转移溶于16 mL 甲醇中,加5倍体积的乙醚于冰箱中静置,24h后,过滤,留沉淀,上清液再加乙醚约50mL 同样操作至不再产生沉淀。最后收集合并所得沉淀物溶于10mL 蒸馏水,溶液为粗皂苷液,取少量备用,其余样液过大孔树脂柱,依次用蒸馏水和不同质量分数的乙醇洗脱[12],跟踪检测洗脱液,直至将粗皂苷中的皂苷和黄酮分离,合并相同组分并减压浓缩至浸膏状,各用40mL和15mL水溶解,即得知母皂苷和黄酮样液[9]。
(4)知母中多糖的提取:将醇提知母皂苷和黄酮过程中所剩的滤渣置于500mL圆底烧瓶中,按1.2.1(2)提取。合并两次滤液,真空浓缩至少量时加入95%乙醇沉淀,收集沉淀,再用蒸馏水定容至50mL,即为多糖样液[9,13]。
(5)各提取物得率的测定:取干燥洁净称量瓶,用分析天平准确称量,记录其重量,编号备用,移入所得不同的提取物的样液各0.5mL后,自然干燥至恒重,再称量,记录数据,此试验各成分各作2组平行试验取其平均值,由该数据、所得样液体积和提取时所取原料的重量来计算提取率。
1.2.2 知母中活性成分的定性检测 知母中各活性成分的定性检测方法见参考文献[14]和[15]。
1.2.3 知母中各抑制剂活性测定方法
(1)知母中各抑制剂的活性测定:反应体系如表1所示,底物、缓冲液和知母提取得到的各抑制剂都按下表比例先于室温下加入比色皿中稳定5min后,再加入酶液,在400nm下测定吸光度,酶液加入后,瞬间开始计时,每1min读取1次吸光值。为扣除抑制剂本身的影响,每种抑制剂测定时都作相应不加抑制剂的空白对照试验,另为扣除底物PNPG 的影响,再做一组不加酶的空白对照试验。定义抑制剂一个活力单位为吸光度每分钟减少0.001[16]。抑制率按式(1)计算。

式中:
C—— 抑制率,%;
AX1—— 加抑制剂但不加酶的吸光值;
AX0—— 加入抑制剂也加入酶后的吸光值;
AY1—— 不加抑制剂也不加酶的吸光值;
AY0—— 不加抑制剂但加入酶的吸光值。

表1 各提取液抑制活性的反应体系Table1 Reactant system for evaluate the effects of extracts on the activity ofα-glucosidase
知母水提液、多糖、皂苷和拜堂平浓度均为5.60mg/mL。黄酮浓度为5.60mg/mL 时颜色深,超出测定范围,选浓度为0.88mg/mL。
(2)不同浓度皂苷和黄酮抑制活性的测定:试验设计见表2和表3,每个浓度下都以不加酶的相同混合液作为对照,然后作抑制率- 抑制剂浓度图确定最大半抑制浓度IC50[17]。
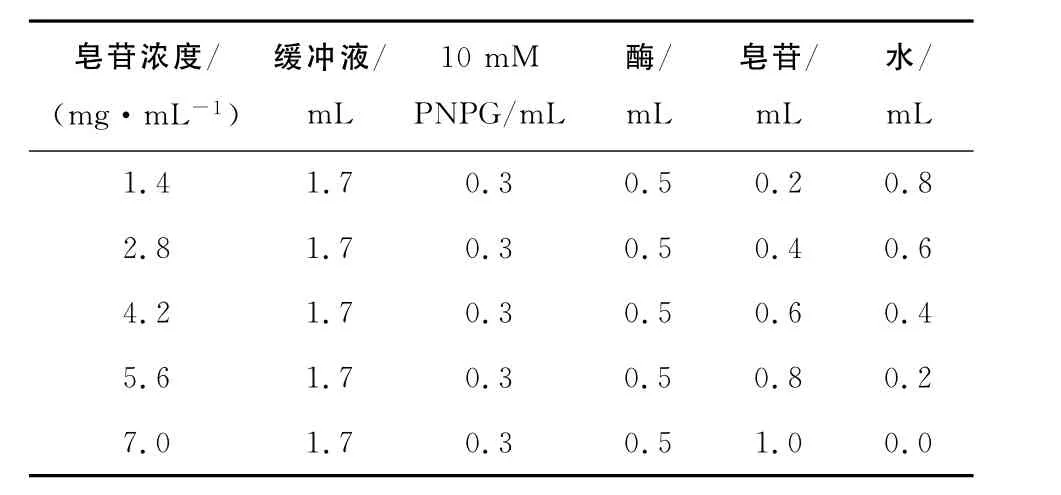
表2 不同浓度皂苷的抑制活性测定反应体系Table2 Reactant system for evaluate the effects of Saponins on the activity ofα-glucosidase
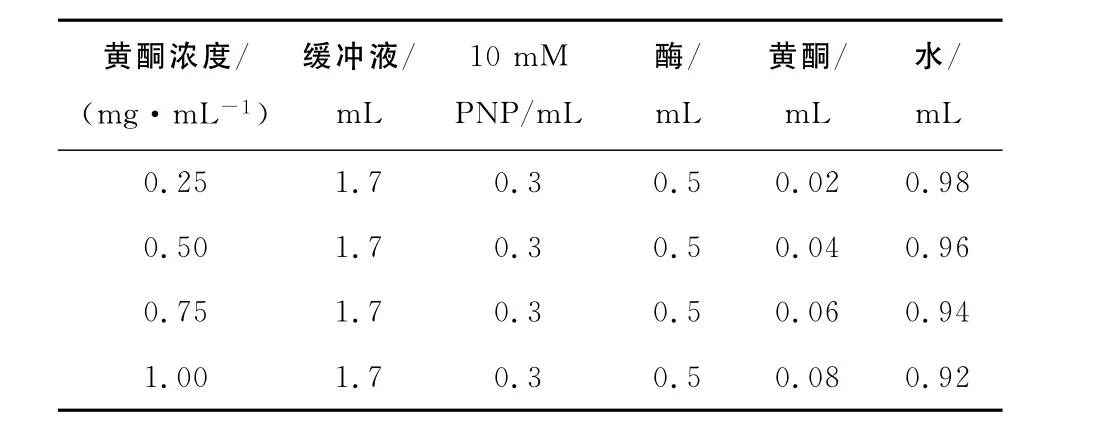
表3 不同浓度黄酮的抑制活性测定反应体系Table3 Reactant system for evaluate the effects of flavone on the activity ofα-glucosidase
2 结果与讨论
2.1 知母中活性成分的分离与定性检测
将知母水提液、粗皂苷、多糖提取液经三氯化铁试验、盐酸-镁粉试验、α-萘酚试验、明胶试验、氯仿-浓硫酸试验、醋酐浓硫酸试验等的定性测定,结果见表4。
由表4可知,知母粗皂苷中含有黄酮组分。上大孔树脂柱分离纯化黄酮和皂苷,跟踪检测洗脱液,结果见表5。
试验结果显示20%~40%乙醇洗脱液主要含知母黄酮,而80%和95%乙醇洗脱液只含知母皂苷,说明知母皂苷和黄酮已得到分离。综合表4、5得知,知母中所得的各抑制剂成分已基本得到分离。
2.2 知母中活性成分得率的测定
从知母中提取、分离并部分纯化得到水粗提物、皂苷、黄酮以及多糖等组分。它们的得率分别为19.75%,5.00%,1.05%,13.20%。

表4 各提取液的定性检验结果总表Table4 The results of qualitative test for inhibitors extracted fromRhizoma Anemarrhenaes
2.3 知母中活性成分的酶抑制活性测定
底物浓度为2mmol/L,抑制剂浓度5.6mg/mL 时测得各组分对酶的抑制效果,与拜堂平的比较见图1。
由图1可知,知母皂苷、黄酮、水提液、多糖均有不同程度的抑制作用,其中知母皂苷和黄酮明显优于拜堂平。取第15分钟的值计算抑制率,作抑制率图见图2,皂苷和黄酮浓度分别为5.60,0.88mg/mL 时其抑制率分别为72.94%和37.91%,均高于拜堂平(5.6mg/mL)的抑制率33.52%,而水提液、多糖的浓度为5.6 mg/mL 时的抑制率分别是6.04%和11.8%,低于拜堂平。因为皂苷和黄酮的抑制效果好,故对它们作进一步研究。
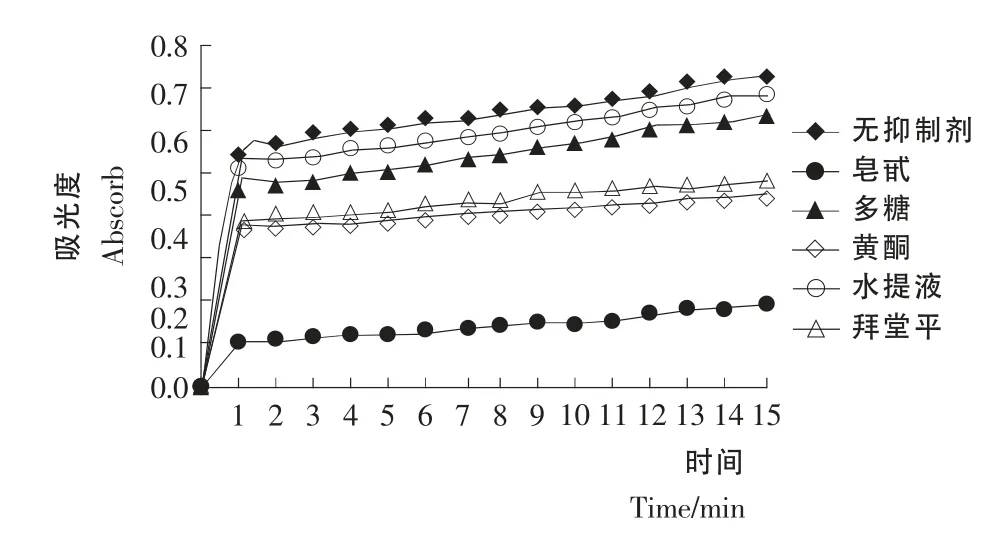
图1 各提取组分对酶作用的时间与吸光度曲线图Figure1 The absorb value curves depending on time of all inhibitors extracted fromRhizoma Anemarrhenaes
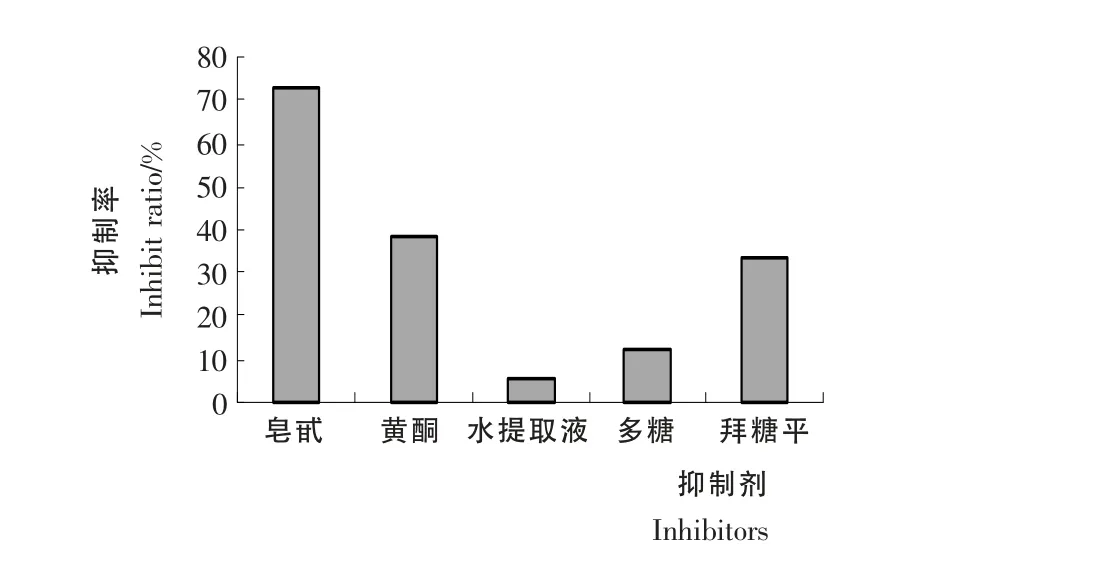
图2 不同抑制剂的抑制率Figure2 The inhibit ratio of all inhibitors extracted from Rhizoma Anemarrhenaes and Acarbose
2.4 皂苷浓度对酶反应速度的影响
不同浓度的皂苷反应体系所测得的吸光度值对时间做图见图3。根据图3中直线部分(0~1min)求斜率,即1min内的平均反应速度,求得相对反应速度,作相对反应速度-皂苷浓度图见图4。
由图4可知,随着皂苷浓度的增大,酶活性不断降低,而抑制活性逐步增加,当达4.2mg/mL 时其抑制活性基本保持不变。说明皂苷的浓度与抑制活性有明显的量效关系。并从图4中求出半抑制浓度[17,18]IC50为1.0mg/mL。
2.5 黄酮浓度对酶反应速度的影响
不同浓度的黄酮反应体系所测得的吸光度值对时间做图见图5。
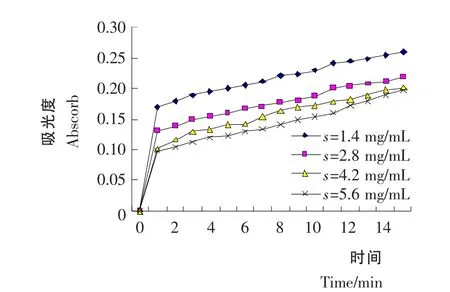
图3 不同浓度皂苷对酶反应速度的影响Figure3 Enzyme reaction speed depending on the concentration of saponins
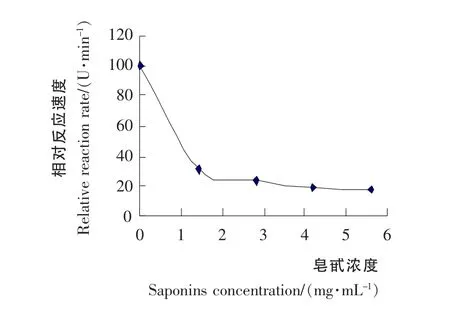
图4 相对反应速度-皂苷浓度曲线Figure4 Saponins concentration-relative reaction rate curve
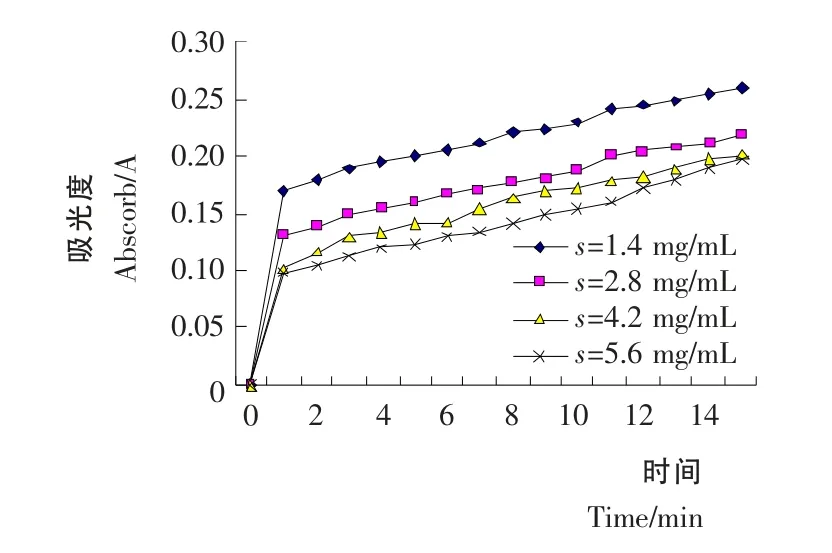
图5 不同浓度黄酮对酶反应速度的影响Figure5 Enzyme reaction speed depending on the concentration of flavone
根据图5中直线部分求斜率(0~1min),即1min内的反应平均速度,求得相对反应速度,并作相对反应速度-抑制剂浓度图见图6。
由图6可知,随着黄酮浓度的增大,酶反应速度不断降低,而抑制活性逐步增加,当黄酮浓度达到0.65 mg/mL 时其抑制活性基本保持不变。并由图6可推测出半抑制浓度IC50>0.75mg/mL。
3 结论
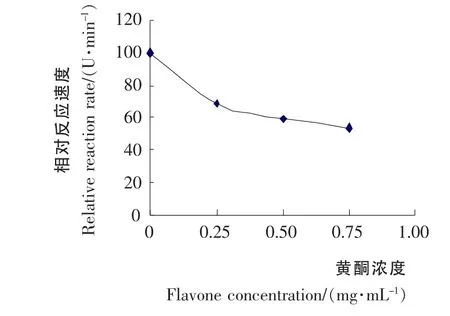
图6 相对反应速度-黄酮浓度曲线Figure6 Flavone concentration-relative reaction rate curve
试验结果表明知母中各抑制剂成分均可不同程度地抑制α-葡萄糖苷酶的活性,其中知母皂苷和黄酮的抑制率分别为72.94%和37.91%,均高于拜堂平,这说明知母各提取物均是α-糖苷酶抑制剂类降糖新药的良好候选物,试验得知母皂苷的半抑制浓度IC50=1.0mg/mL,知母黄酮的半抑制浓度IC50>0.75mg/mL,这些数据为深入研究α-葡萄糖苷酶抑制剂的活性机理及其药理和降糖新药的开发提供了新的理论参考,但这两种抑制剂的抑制类型,最适抑制浓度等都还有待进步深入研究。该研究说明从中药知母中筛选天然α-葡萄糖苷酶抑制剂切实可行,使用安全、来源广泛且相对成本低廉,这对充分开发、利用中国丰富的药用自然资源有深远的意义。
1 李治州,许激扬,陈代杰.氧化葡萄糖酸菌转化制备米格列醇关键中间体[J].工业微生物,2002,32(1):45~48.
2 Gaster B hirschl B.The effects of improved glycemic control on complication in type 2diabetes[J].Arch.Intern.Med.,1998,158:134~141.
3 小野顺子.α-葡萄糖苷酶抑制剂[J].日本医学介绍,1999,20(1):22~24.
4 李文生.知母茎叶总黄酮的提取及含量测定[J].河北联合大学学报,2012,14(6):787~789
5 倪梁红,秦民坚.知母资源化学及药理研究进展[J].中国野生植物资源,2005,24(4):16~20
6 卢盛华,孙漠伟,王菊英,等.知母聚糖降糖作用及其机理研究[J].中国生化药物杂志,2003,24(2):81~83.
7 姚桂香.知母的药理及临床作用[J].中外健康文摘,2011(2):44~48.
8 陈丽华,马庆一,杨冰,等.降糖功能因子天然资源的分布概况[J].现代食品科技,2005,28(3):172~175.
9 马庆一,陈丽华,杨海延,等.山茱萸中α-葡萄糖苷酶抑制活性因子的筛选(I)[J].食品科学,2007(1):169~170.
10 罗培,莫正纪.优化山茱萸中α-葡萄糖苷酶抑制剂的提取工艺[J].华西药学杂志,2004,19(4):273~274.
11 徐婷,吴青,高骏伟.荔枝核提取物及其阳离子树脂分离物体外降血糖作用[J].食品与机械,2012,28(4):113~116.
12 朱英,罗永明,付小梅.大孔树脂分离油茶皂苷和黄酮的研究[J].林产化学与工业,1999(1):40~42.
13 何新益,刘金福,李林昊.苦瓜多糖的分离纯化及其对PPAR 激活作用研究[J].食品与机械,2008,24(6):59~61.
14 北京医学院,北京中医学院.中草药成分化学[M].北京:人民卫生出版社,1980:3~266.
15 裴月湖主编.天然药物化学实验[M].北京:人民卫生出版社,2005:2~66.
16 王镜岩.生物化学[M].北京:高等教育出版社,2002:216~355.
17 戚以政,汪叔平.生化反应动力学与反应器[M].第二版.北京:化学工业出版社,1990:89~120.
18 郭勇,郑穗平.酶学[M].上海:华南理工大学出版社,2000:123~137.
