高铝铁矿石球团在预还原过程中的热力学行为
2013-03-20张作良邹宗树
张作良,李 强,高 攀,张 伟,邹宗树
(东北大学 材料与冶金学院,沈阳 110819)
高铝铁矿石球团在预还原过程中的热力学行为
张作良,李 强,高 攀,张 伟,邹宗树
(东北大学 材料与冶金学院,沈阳 110819)
应用物质吉布斯自由能函数法计算高铝铁矿石球团在预还原过程中所发生反应的ΔG,明确球团中物相在该过程中的热力学行为.热力学计算、分析结果表明:还原阶段产生的FeO最易与Al2O3反应生成FeO·Al2O3,其次与SiO2反应生成2FeO·SiO2,最后与SiO2反应生成FeO·SiO2.Al2O3置换2FeO·SiO2和FeO·SiO2中SiO2生成FeO·Al2O3的反应较之SiO2置换FeO·Al2O3中Al2O3的反应要容易得多.FeO·SiO2的还原反应趋势要强于FeO·Al2O3及2FeO·SiO2.
高铝铁矿石;球团;热力学;预还原过程
全球对铁矿石的需求量急剧增长,特别是中国大规模钢产量的驱使下,这种增长还在持续[1].这直接导致了高品位铁矿石资源的不断消耗.另外,进口铁矿石价格继续攀升.越来越多的人将研究的目光转向高铝铁矿石资源,这类资源在澳大利亚、中国、印度[2~3]等国家有相当丰富的储量.在亚太区的绝大多数国家,烧结矿是高炉炉料的重要组成部分,所以关于烧结矿的性能得到了很充分的研究,尤其在对烧结矿性能起决定作用的化学组成以及矿相结构方面进行了大量的工作[4~7].当烧结料中氧化铝的含量有少量的增加时,就会对烧结矿的强度和还原粉化特征产生显著的负面影响,进而导致高炉上部透气性的恶化[1,8~9].而且,高炉炉渣中所允许的氧化铝含量是有限度的.由此可见,高炉处理高铝铁矿石是很困难的.
笔者采用非高炉工艺[10],即固态预还原-终还原熔分-氧化铝浸出流程处理高铝铁矿石.实验室条件下的固态预还原为,将造好的高铝铁矿石球团放入高温炉中,在通氮气保护的情况下升温,当加热到设定的温度(850~1 050℃)时保温10 min,然后停止通氮气并切换成还原气体(CO、H2).在升温和还原过程中会发生一系列反应,这些反应决定了预还原的效果,因此很有必要了解这些反应的进程.本文从热力学角度对该过程所发生的反应进行较系统的分析.
1 原料及热力学基础
1.1 原 料
所研究原料为广西高铝铁矿,其铁品位较低,仅为30.82%(质量分数,下同),脉石成分主要是Al2O3和SiO2,其含量分别为23.32%和12.27%,其他 MnO 0.21%、MgO 0.25%、K2O 0.325%、CaO 0.05%,烧损较高约为14.61%.该矿中铁矿物以针铁矿和赤铁矿为主,铝矿物主要以三水铝石形式存在,硅矿物以石英形式存在.
1.2 热力学基础
应用物质吉布斯自由能函数法计算高铝铁矿石球团在预还原过程中所发生反应的ΔG,其计算原理和方法及本文所采用热力学数据均取自文献[11].
2 热力学分析结果与讨论
2.1 升温阶段
由于原矿中CaO含量几乎可以忽略,这一阶段主要是结晶水的脱除,之后可以看成是Fe2O3、Al2O3和SiO2等单体氧化物组成的体系,可能发生的反应如下(各反应ΔGT的单位均为J·mol-1):

反应(1)~(5)的吉布斯自由能变化与温度的关系如图1所示.热力学计算结果表明,在所设定的温度条件下,除了Al2O3·2SiO2不可能产生外,蓝晶石在温度为935 K以上时也是不可能产生的,而其他如红柱石、硅线石以及莫来石均可能产生.
2.2 还原阶段
由于还原气体的介入(这里以一氧化碳气体为代表),发生了铁氧化物的还原相变,这时体系内可能发生的反应除上述5个反应外,还有:
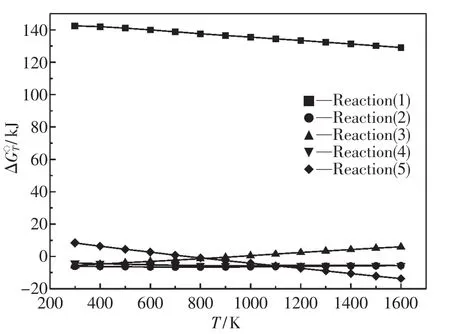
图1 反应(1)~(5)的吉布斯自由能变化与温度的关系Fig.1 Relationship between Gibbs free energy changes of reactions(1)~(5)and temperature
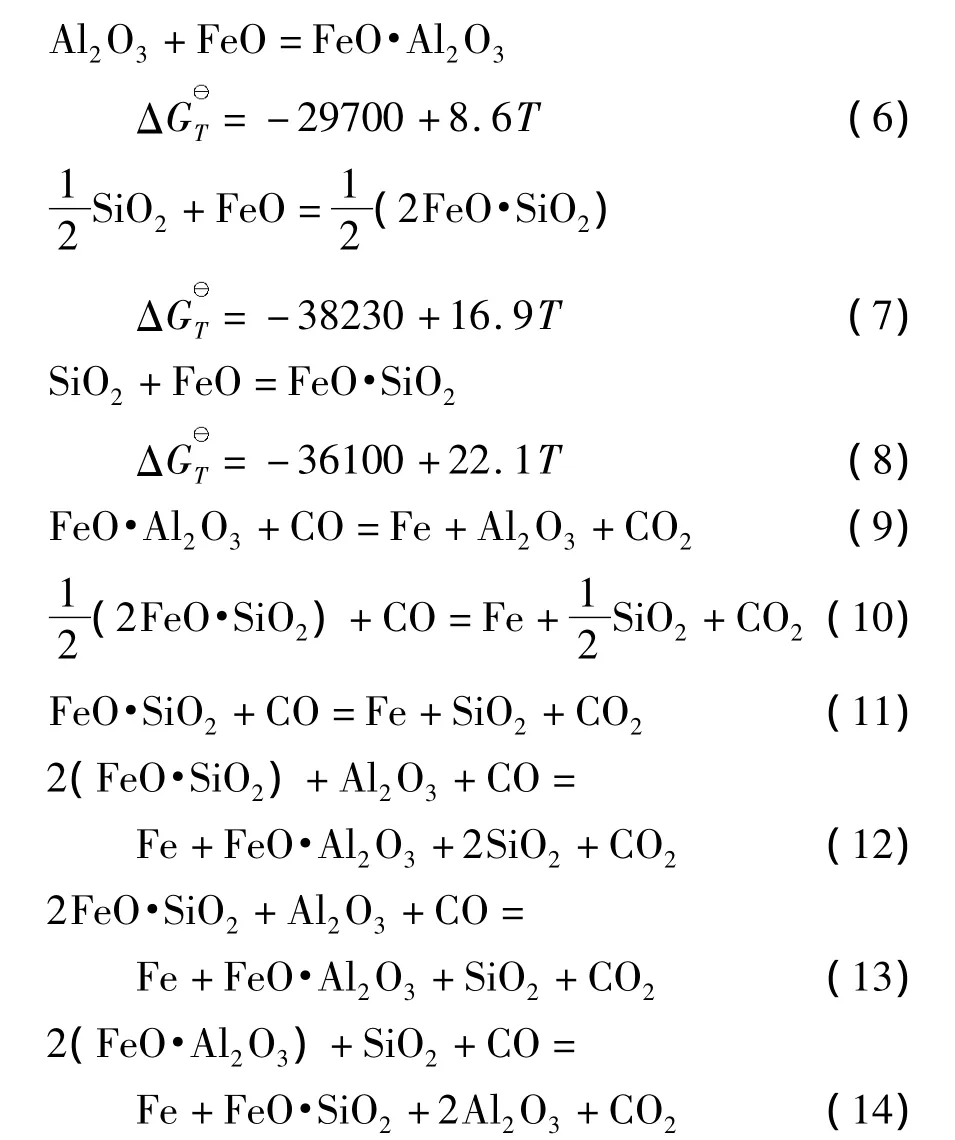
反应(6)~(8)的吉布斯自由能变化与温度的关系如图2所示.热力学计算结果表明,这3个反应均有可能发生,温度在1 028 K(755℃)以上,FeO最易与Al2O3反应生成FeO·Al2O3,其次与SiO2反应生成2FeO·SiO2,最后与SiO2反应生成FeO· SiO2.
反应(9)~(14)的平衡气相组成pCO/(pCO+ pCO2)与温度T的关系如图3所示.由图可知,当T>1 000 K时,各反应进行的完全程度为(12)>(11)>(13)>(10)>(9)>(14).Al2O3置换2FeO·SiO2和FeO·SiO2中SiO2生成FeO·Al2O3的反应较之SiO2置换FeO·Al2O3中Al2O3的反应要容易得多.FeO·SiO2的还原反应趋势要强于FeO·Al2O3及2FeO·SiO2.综上所述,由于高铝铁矿石中Al2O3的广泛存在,致使形成大量难还原的FeO·Al2O3相,加大还原的难度,这也使得与铁结合的氧不可能被还原彻底,即使在实验室条件下.
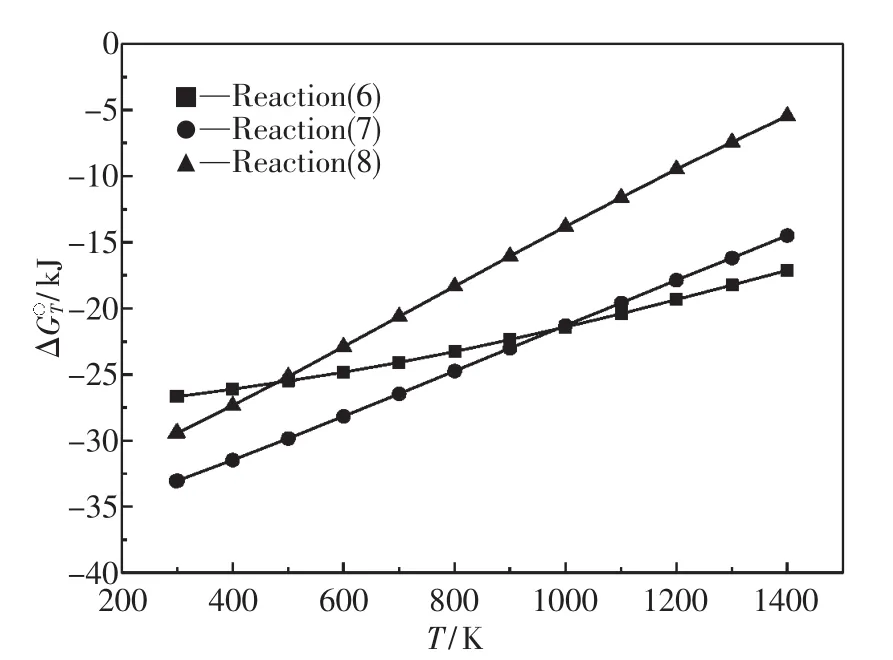
图2 反应(6)~(8)的吉布斯自由能变化与温度的关系ig.2 Relationship between Gibbs free energy changes of reactions(6)~(8)and temperature
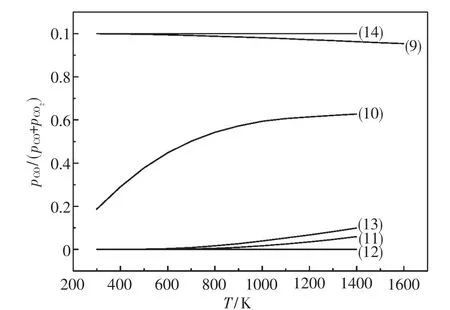
图3 固相反应产物还原反应气相平衡图Fig.3 Gas-phase equilibrium of reduction of the products of solid-phase reactions
3 结论
(1)在升温阶段,除了Al2O3·2SiO2不可能产生外,其他如红柱石、硅线石以及莫来石均可能产生.
(2)还原阶段产生的FeO最易与Al2O3反应生成FeO·Al2O3,其次与SiO2反应生成2FeO· SiO2,最后与SiO2反应生成FeO·SiO2.
(3)Al2O3置换2FeO·SiO2和FeO·SiO2中SiO2生成FeO·Al2O3的反应较之SiO2置换FeO·Al2O3中Al2O3的反应要容易得多.FeO·SiO2的还原反应趋势要强于FeO·Al2O3及2FeO·SiO2.
[1]Lu L,Holmes J,Manuel J R.Effects of alumina on sintering performanceofhematite iron ores[J].ISIJ International,2007,47(3):349-358.
[2]Das B,Prakash S,Das S K,et al.Effective beneficiation of low grade iron ore through jigging operation[J].Journal of Minerals&Materials Characterization&Engineering,2007,7(1):27-37.
[3]Roy S.Recovery improvement of fine iron ore particles by multi gravity separation[J].The Open Mineral Processing Journal,2009,2:17-30.
[4]Pimenta H P,Seshadri V.Characterisation of structure of iron ore sinter and its behaviour dring reduction at low temperatures[J].Ironmaking and Steelmaking,2002,29 (3):169-174.
[5]Kim H S,Park J H,Cho Y C.Crystal structure of calcium and aluminium silicoferrite in iron ore sinter[J].Ironmaking and Steelmaking,2002,29(4):266-270.
[6]Scarlett N V Y,Pownceby M I,Madsen I C,et al.Reaction sequences in the formation of silico-ferrites of calcium and aluminium in iron ore sinter[J].Metallurgical and Materials Transactions B,2004,35B:929-936.
[7]Machida S,Nushiro K,Ichikawa K,et al.Experimental evaluation of chemical composition and viscosity of melts during iron ore sintering[J].ISIJ International,2005,45 (4):513-521.
[8]Choudhary M K,Bhattacharjee D,Bannerjee P S,et al.Effect of variation of alumina on development of phase during iron ore sintering[J].ISIJ International,2005,45 (4):1084-1086.
[9]Oluwadare G O.Roles of alumina and magnesia on the formation of SFCA in iron ore sinters[J].Trends in Applied Sciences Research,2007,2(6):483-491.
[10]郭培民,赵沛,庞建明,等.熔融还原炼铁技术分析[J].钢铁钒钛,2009,30(3):1-9.
(GUO Pei-min,ZHAO Pei,PANG Jian-ming,et al.Technical analysis on smelting reduction ironmaking process[J].Iron Steel Vanadium Titanium,2009,30(3):1-9.)
[11]叶大伦,胡建华.实用无机物热力学数据手册(第2版)[M].北京:冶金工业出版社,2002:6-11,72-73,83-86,194-195,354-355,366,376-377,380,923-926.
(YE Da-lun,HU Jian-hua.Practical inorganic thermodynamic data handbook(the second edition)[M].Beijing:Metallurgical Industry Press,2002:6-11,72-73,83-86,194-195,354-355,366,376-377,380,923-926.)
Thermodynamic behavior of high-aluminium iron ore pellets during pre-reduction process
Zhang Zuoliang,Li Qiang,Gao Pan,Zhang Wei,Zou Zongshu
(School of Materials&Metallurgy,Northeastern University,Shenyang 110819,China)
ΔG of the reactions for the high aluminium iron ore pellets during the pre-reduction was calculated through the material Gibbs free energy function to determine the thermodynamic behavior of the phases in the pellets.The results showed that FeO generated during the reduction stage is most likely to react with Al2O3to generate FeO·Al2O3,then it is likely to react with SiO2to generate 2FeO·SiO2,last it is likely to react with SiO2to generate FeO·SiO2.Moreover,the reaction of Al2O3to replace SiO2in 2FeO·SiO2and FeO·SiO2to generate FeO·Al2O3is much easier than that of SiO2to replace Al2O3in FeO·Al2O3.And the reaction trend of the reduction of FeO·SiO2is stronger than that of FeO·Al2O3and 2FeO·SiO2.
high-aluminium iron ore;pellets;thermodynamics;pre-reduction process
TF 521.6
A
1671-6620(2013)01-0004-03
2012-11-15.
国家自然科学基金资助项目 (51104037).
张作良 (1985—),男,东北大学博士研究生,E-mail:zhang231167@163.com;邹宗树 (1958—),男,东北大学教授,博士生导师.
