白芥叶片总RNA提取方法的比较研究
2013-03-20陈小兵安丽平黄进勇
于 萍, 马 良, 陈小兵, 安丽平, 黄进勇
(郑州大学生物工程系 河南郑州450001)
0 引言
白芥是十字花科白芥属植物,是一种重要的常用中药材.目前,白芥的研究报道集中在白芥子的主要成分及药理学研究[1-3]、外界环境胁迫对其影响的研究[4-6]及白芥与其他油料作物间的体细胞杂交研究[7]等方面,而对白芥基因克隆、基因表达及转录组分析等方面的研究鲜有报道.
纯度高、完整性好的植物RNA是进行实时荧光定量PCR、Northern印迹及杂交分析、构建cDNA文库以及基因克隆等分子生物学研究的必要前提.目前,已经发展了包括Trizol法、改良异硫氢酸胍法[8]、CTABLiCl法、CTAB-异丙醇法在内的多种总RNA提取技术[9-11],以及改良过的适用于油料作物种子的RNA提取方法[12],改良过的CTAB法提取香蕉叶片总 RNA的方法[13],提取棉花不同组织总 RNA的热硼酸改良法[14].但是由于每种RNA提取方法的针对性有所不同,所以用不同的RNA提取方法对同一种植物或动物组织进行提取,得到的结果也不尽相同.白芥中含有大量的油脂、糖类、酚类、蛋白等物质,增加了RNA提取的难度.作者分别采用柱式植物总RNA抽提纯化试剂盒法、RNAiso Plus法、CTAB-异丙醇法对白芥幼嫩叶片总RNA提取进行了比较研究,以期找到一种既快捷又高效的提取白芥叶片总RNA的最优方法,为深入开展白芥抗逆性、基因表达等分子生物学研究奠定基础,使白芥的药用价值得到更广泛的开发和利用.
1 材料与器材
1.1 材料
白芥种子购于中国中草药种子公司;白芥幼苗由郑州大学生物工程系植物生理与生化实验室培养,培养至白芥长出四片真叶时用于实验.
1.2 实验试剂
焦碳酸二乙酯(DEPC)、琼脂糖、1.5mL RNase/DNase离心管、柱式植物总 RNA抽提纯化试剂盒、RevertAid First Strand cDNA Synthesis Kit均购自上海生工生物工程公司;白芥黑芥子酶引物由上海生工生物工程公司合成;RNAiso Plus、DL2000 DNA Marker购自大连宝生物(TAKARA)公司;氯仿、异戊醇、异丙醇、75%乙醇、无水乙醇等均为国产分析纯试剂.
50×TAE缓冲液:Tris 242 g,乙二胺四乙酸二钠(Na2EDTA)37.2 g,醋酸57.1 mL,搅拌混匀,调 pH 至8.3(使用时稀释成1×TAE缓冲液).
CTAB 提取液:0.1 mol/L Tris-HCl(pH 8.0),0.05 mol/L 乙二胺四乙酸(EDTA),2%十六烷基三甲基溴化铵 (CTAB),20 g/L 聚乙烯基吡咯烷酮(PVP),1.5 mol/L NaCl,0.2%β-巯基乙醇.
RNA提取实验所用试剂均用0.1%DEPC处理水(放置过夜,高压灭菌)配制;所用研钵、研棒、药匙均用0.1%的DEPC水浸泡过夜,120℃灭菌,烘干,放入冰箱预冷,备用.
1.3 实验仪器
JW-2017HR高速冷冻离心机(安徽嘉文仪器装备有限公司);JY300C电泳仪(北京君意东方电泳设备有限公司).
2 实验方法
2.1 总RNA提取
分别采用柱式植物总RNA抽提纯化试剂盒法、RNAiso Plus法、CTAB-异丙醇法对白芥幼嫩叶片总RNA进行提取,每种方法重复3次.
2.1.1 试剂盒法 采用上海生工生物工程公司柱式植物总RNA抽提纯化试剂盒,参照试剂盒说明进行如下步骤:取450 μL Buffer Rlysis-PG加入1.5 mL RNase-free的离心管中备用.取25~50 mg新鲜白芥叶片用液氮研磨成粉末,加到上述1.5 mL离心管中,立即震荡混匀,室温放置5 min.12 000 r/min 4℃离心3 min,将上清移至1.5 mL RNase-free的离心管中.加入1/2体积无水乙醇,充分混匀.将吸附柱放入收集管中,用移液器将溶液全部加至吸附柱中,静置1 min,室温12 000 r/min离心1 min,倒掉收集管中废液.将吸附柱放回收集管中,加入500 μL GT溶液,静置1 min,室温10 000 r/min离心1 min,倒掉收集管中废液.将吸附柱放回收集管中,加入500 μL NT溶液,静置1 min,室温10 000 r/min离心1 min,倒掉收集管中废液.将吸附柱放回收集管中,12 000 r/min离心2 min.将吸附柱放入RNase-free的1.5 mL离心管中,在吸附膜中央加入30 μL RNase-free水,静置2 min,12 000 r/min离心2 min,将所得到的RNA溶液置于-70℃保存或用于后续实验.
2.1.2 RNAiso Plus法 实验步骤如下:向1.5mL RNase/DNase的离心管中加入1.0 mL RNAiso Plus.将新鲜的白芥叶片放入预冷的研钵中,加入液氮研磨,其间不断加入液氮,直至研成粉末,迅速转移50~100 mg粉末于已加入有RNAiso Plus裂解液的离心管中,并充分振荡使样品混匀.室温静置5 min(根据所选材料需要改为7 min),12 000 r/min 4℃离心5 min,小心吸取上清液,移入新的离心管中.加入RNAiso Plus的1/5体积量氯仿,盖紧离心管盖,剧烈震荡15 s.待溶液充分乳化后,室温静置5 min,12 000 r/min 4℃离心15 min,此时溶液分为3层.小心吸取上清液,移入新的离心管中,加入等体积的异丙醇,上下颠倒离心管充分混匀后,15~30℃下静置10 min,12 000 r/min 4℃离心10 min,出现沉淀.小心弃去上清,缓慢沿离心管壁加入1 mL 75%乙醇,轻轻上下颠倒洗涤离心管壁,12 000 r/min 4℃离心5 min,小心弃去乙醇(尽量除尽乙醇).室温干燥沉淀2~5 min,加入适量的RNase-free水溶解沉淀,待沉淀完全溶解后用于后续实验,或保存在-80℃冰箱.
2.1.3 CTAB-异丙醇法 实验操作步骤参照宋晖等[15]的方法进行.
2.2 总RNA完整性及纯度检测
2.2.1 琼脂糖凝胶电泳检测 分别取得到的RNA样品6 μL,点样于1.0%非变性琼脂糖凝胶中进行电泳实验,然后用紫外凝胶成像系统观察其完整性.
2.2.2 紫外分光光度计检测 用TE溶液作空白对照,然后将提取到的RNA稀释50倍,分别在260 nm和280 nm测定吸光度,计算A260/A280比值及各RNA的质量浓度.
2.2.3 反转录RT-PCR 采用3种不同方法提取出的RNA作为模板,参照RevertAid First Strand cDNA Synthesis Kit的说明添加反转录反应体系,合成第一条链cDNA.以此cDNA为模板,白芥黑芥子酶上游引物P1(5’-GATTGGACCTGTGATGATAAC-3’)、下游引物 P2(5’-TTGGCTTGGCATACTGAG-3’)进行黑芥子酶基因的 PCR 扩增.PCR 反应体系为:cDNA 2 μL,上游引物 P10.5 μL,下游引物 P20.5 μL,Taq Mix 12.5 μL,加水至25 μL反应体系进行PCR扩增反应.PCR反应程序:首先94℃预变性3 min,然后94℃变性30 s,58℃退火30 s,72℃延伸45 s,这3个过程循环35次,最后再72℃延伸5 min,4℃保温.PCR产物用1.0%琼脂糖凝胶电泳检测,并用紫外凝胶成像系统观察结果,拍照保存.
3 结果与分析
3.1 不同方法对白芥叶片总RNA提取的完整性检测
如图1所示,柱式植物总RNA抽提纯化试剂盒法、RNAiso Plus法和CTAB-异丙醇法都能从白芥叶片中提取得到不同产率、不同纯度的总RNA.柱式植物总RNA抽提纯化试剂盒法提取得到的RNA,28S rRNA和18S rRNA条带不明显,几乎看不到5S rRNA,有可能在使用试剂盒提取过程中,使用吸附柱洗脱杂质时部分RNA随着杂质一起被洗脱,导致总RNA的产率损失很大;CTAB-异丙醇法提取的白芥叶片总RNA中,28S rRNA和18S rRNA条带完整,但有一定程度的弥散,且在点样孔周围及下方有明显的残留,说明该方法提取的RNA有降解且有基因组DNA或蛋白的污染;而用RNAiso Plus法提取的白芥叶片总RNA中,28S rRNA、18S rRNA和5S rRNA带型清晰,且条带无弥散现象,说明该方法提取的白芥叶片总RNA完整性好、无降解.
3.2 紫外分光光度计检测
高纯度的RNA的A260/A280比值应该在1.9~2.1之间.如表1所示,与RNAiso Plus法相比,柱式植物总RNA抽提纯化试剂盒法得到的RNA的A260、A280有极显著的降低,CTAB-异丙醇法得到的RNA的A260、A280有极显著的升高(P<0.01);与RNAiso Plus法相比,柱式植物总RNA抽提纯化试剂盒法得到的RNA的A260/A280比值有极显著的升高(P<0.01),CTAB-异丙醇法得到的RNA的A260/A280比值有极显著的降低(P<0.01);但柱式植物总RNA抽提纯化试剂盒法的产率不高,平均质量浓度为143.3 ng/μL,RNAiso Plus法平均质量浓度为 230.6 ng/μL,CTAB-异丙醇法平均质量浓度为 257.0 ng/μL.
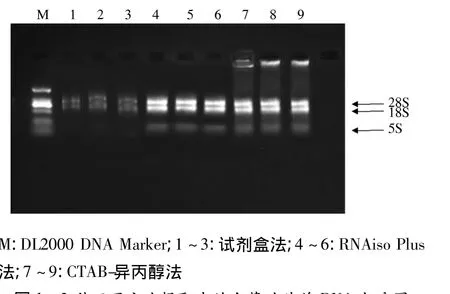
图1 3种不同方法提取出的白芥叶片总RNA电泳图Fig.1 Electrophoresis results for total RNA extraction from Sinapis alba leaves with three different methods
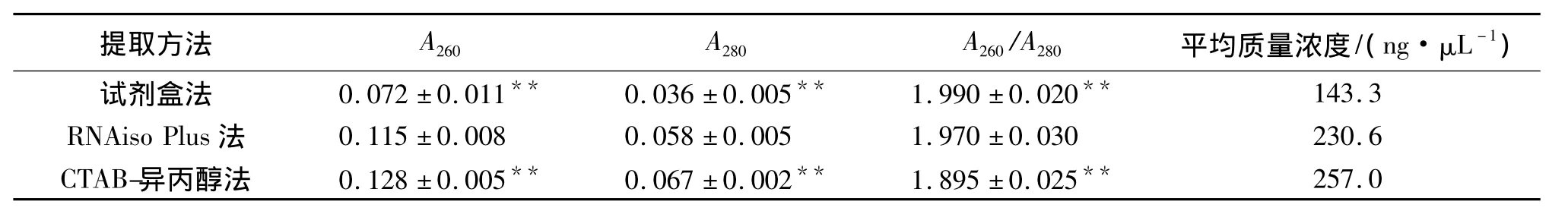
表1 3种不同方法提取出的白芥叶片总RNA纯度及其质量浓度Tab.1 Purity and mass concentration of total RNA extraction from Sinapis alba leaves with three different methods
3.3 RT-PCR扩增检测
分别以各RNA反转录的cDNA为模板,均扩增出了长度为250 bp的目的条带,RT-PCR扩增结果如图2所示.除CTAB-异丙醇法中的7~9条带有轻微的弥散外,其余的条带都清晰明亮,且稳定性好.表明除CTAB-异丙醇法外,另两种方法提取的总RNA反转录后的cDNA样品,可用于基因克隆、基因表达等分子生物学研究[16].
4 讨论
纯度高、完整性好的RNA提取是进行实时荧光定量PCR、Northern印迹及杂交分析及基因克隆等分子生物学研究的必要前提.植物组织总RNA的提取较动物和微生物困难,原因是植物具有坚硬的细胞壁,富含多种次生代谢物.细胞破碎后,这些物质将以不同方式干扰RNA的提取.与其他植物相比,白芥叶片中含有酚类、糖类、蛋白等大分子物质,当研磨使细胞破碎时,这些大分子物质与RNA相互作用,影响RNA的分离纯化.
RNA酶是导致RNA降解的最主要物质,其生物活性非常稳定,并且分布广泛,除细胞内源性的RNA酶外,环境中的灰尘、各种试验器皿和试剂、人体的汗液以及唾液中均存在RNA酶.因此,在提取RNA的过程中最关键的因素是尽量减少RNA酶的污染,控制RNA酶对RNA的降解作用,通过高温烘干、戴口罩和经常更换手套等途径去除外源性RNA酶的污染,用DEPC处理水配制各种溶液及使用变性剂(如β-巯基乙醇)等抑制内源性RNA酶的活力.
在众多提取方法中,针对不同的植物材料,要选择不同的提取方法,才能取得较好的提取效果[17].现在已有许多公司根据科研需要研制出一些总RNA提取试剂及试剂盒,其中部分试剂盒对一些植物进行提取也能得到较好的提取效果[15],但由于大量提取RNA的成本太高,极少被采用.本研究中采用的柱式植物总RNA抽提纯化试剂盒法提取白芥总RNA,充分研磨使细胞破碎后,RNA易与植物组织中的糖类、酚类等黏附在一起,使用吸附柱去除多糖、酚类等杂质时,部分RNA可能被一起去除,导致该方法提取的RNA产率较低,所以不予采用此方法.CTAB抽提法被广泛应用于植物DNA和RNA的提取.CTAB是一种很强的去污剂,有明显的蛋白质变性效果.CTAB法已成功地从枣[18]、香蕉[13]等富含多糖、多酚的植物组织中提取到高质量的RNA,并且CTAB法提取缓冲液中的PVP具有很强的结合多酚化合物的能力.但不同植物物种的理化性质不同,同一方法不一定对所有植物适用.本研究采用CTAB-异丙醇法对白芥叶片进行总RNA提取,由于白芥中蛋白含量较高,如图1(7~9)所示,该方法提取的总RNA纯度不高,且提取时间较长,RNA很容易在提取过程中分解,提取结束后需要进行去除RNA样品中DNA污染的操作.
RNAiso Plus法提取时,当加入有机溶剂氯仿后,使多糖、蛋白形成沉淀,与RNA提取液分离,再通过异丙醇洗涤使RNA沉淀,最后用75%酒精进一步洗净杂质,所以该方法得到的RNA纯度和浓度都较高.本研究使用RNAiso Plus法进一步对白芥根尖组织进行总RNA的提取,因白芥根尖中蛋白、酚类等物质含量较低,结果同图1(4~6)所示,此方法提取出的白芥根尖总RNA条带清晰,因此RNAiso Plus法适合用于白芥组织总RNA的提取.在提取的白芥叶片总RNA中,柱式植物总RNA抽提纯化试剂盒法、RNAiso Plus法和CTAB-异丙醇法这3种方法中,只有RNAiso Plus法提取得到的RNA纯度高、完整性好,适合用于后续研究.因此,RNAiso Plus法适合用于白芥叶片总RNA的提取.

图2 3种不同方法提取出的白芥叶片总RNA的RT-PCR扩增结果Fig.2 RT-PCR results for total RNA extraction from Sinapis alba leaves with three different methods
[1] Ciubota-Rosie C,Macoveanu M,Fernández C M,et al.Sinapis alba seed as a prospective biodiesel source[J].Biomass and Bioenergy,2013,51(2):83 -90.
[2] 刘秦,范惠玲,姚正良.白芥优异性状研究进展[J].现代农业科技,2010,38(19):44-45.
[3] 欧敏锐,吴国欣,林跃鑫.中药白芥子研究概述[J].海峡药学,2001,13(2):8-11.
[4] 唐道城.土壤水分胁迫对白芥根系发育的影响[J].中国油料作物学报,2001,23(2):24-26.
[5] Dong Caihua,Li Chen,Yan Xiaohong,et al.Gene expression profiling of Sinapis alba leaves under drought stress and rewatering growth conditions with illumina deep sequencing[J].Mol Biol Rep,2012,39(5):5851 - 5857.
[6] Plociniczak T,Kukla M,Watroba R,et al.The effect of soil bioaugmentation with strains of pseudomonas on Cd,Zn and Cu uptake by Sinapis alba L[J].Chemosphere,2013,91(9):1332 -1337.
[7] 魏文辉,张苏锋,李均,等.白芥×甘蓝F1代及BC1代单体异附加系的GISH分析[J].科学通报,2006,51(21):2490-2494.
[8] 胡国斌,梅兴国,刘怡.改良异硫氰酸胍一步法提取红豆杉细胞RNA[J].生物技术,2001,11(5):31-33.
[9] 朱昀,王猛,贾志伟,等.一种从富含多糖的玉米幼穗中提取RNA的方法[J].植物学通报,2007,24(5):624-628.
[10]葛晓萍,石琰璟.一种适合富含多糖、多酚植物的RNA提取方法[J].青岛科技大学学报:自然科学版,2007,28(1):6-8.
[11] Mullin A E,Soukatcheva G,Verchere C B,et al.Application of in situ ductal perfusion to facilitate isolation of high-quality RNA from mouse pancreas[J].Biotechniques,2006,40(5):617 -621.
[12]孙海波,王智慧,刘学群,等.一种适用于油菜、大豆、花生、芝麻四种油料作物种子的RNA提取方法[J].中国油料作物学报,2012,34(4):353 -358.
[13]淦国英,漆艳香,蒲金基,等.改良CTAB法提取高质量香蕉叶片总RNA[J].广东农业科学,2009,44(7):192-195.
[14]武耀廷,刘进元.一种高效提取棉花不同组织总RNA的热硼酸改良法[J].棉花学报,2004,16(2):67-71.
[15]宋晖,王友绍.红树植物叶片总RNA提取方法比较与优化[J].生态科学,2011,30(2):201-206.
[16]淳俊,郑彦峰,王胜华,等.一种广泛适用的RNA提取方法[J].生物化学与生物物理进展,2008,16(5):591-597.
[17] Bahloul M,Burkard G.An improved method for the isolation of total RNA from spruce tissues[J].Plant Molecular Biology Reporter,1993,3(11):212 -215.
[18]宋蓓,赵锦,刘孟军.改良CTAB-LiCl法提取枣总RNA体系的建立[J].中国农学通报,2007,23(7):79-83.
