治疗性单克隆抗体类制品质量控制标准的思考
2013-03-17张峰综述孟淑芳审校
张峰 综述 孟淑芳 审校
(中国食品药品检定研究院单克隆抗体产品室,北京100050)
治疗性单克隆抗体类制品质量控制标准的思考
张峰 综述 孟淑芳 审校
(中国食品药品检定研究院单克隆抗体产品室,北京100050)
治疗性单克隆抗体制品在肿瘤、自身免疫、器官移植和感染性疾病的治疗中均取得了显著疗效,其品种和市场份额逐年显著提高。随着新的治疗性单克隆抗体制品的研发和上市,不同产品的质量控制研究,特别是新技术在质量控制中的应用被提到新的高度。由于治疗性单克隆抗体制品结构和生产的复杂性,使得质量控制的复杂程度也相应提高。本文结合治疗性单克隆抗体质量控制的工作经验和国际上的最新进展,对治疗性单克隆抗体质量控制项目设定、标准和方法进展进行论述。
治疗性单克隆抗体;质量控制;方法;标准
1982年,重组人胰岛素作为人类历史上的第一种生物治疗药物被美国食品药品监督管理局(FDA)批准进入市场,从此,重组生物制品开始逐步增多并在生物制品市场中占据越来越大的市场份额,特别是近年来单克隆抗体(以下简称单抗)类药物的发展,更受到业界的关注,越来越多的企业投入到单抗的开发和生产中来。同时,随着一大批疗效明确的单抗药物专利即将到期,如:赫塞汀(曲妥珠单抗)、美罗华(利妥昔单抗)、爱必妥(西妥昔单抗)和类克(英利西单抗)等,许多医药企业通过生物仿制药的方式加入到单抗制品的开发和生产中。随之而来的问题是,由于缺乏对单抗结构与其安全性和有效性间关系的深入了解,新加入企业和生物仿制药企业在单抗制品的质量控制方面往往通过模仿其他单抗质量控制项目和方法的方式解决质量控制问题,这种方式在确保实现质量控制目标方面存在一定的局限性。同时,一大批新技术的出现和应用,极大地促进了单抗质量控制技术项目和方法的发展。现结合工作经验和对单抗质量控制的理解对单抗质量控制项目和方法的研究现状进行讨论。
1 抗体结构简介
抗体为通过链间二硫键连接的2条重链和2条轻链构成的“Y”形结构,重链和轻链通过链内二硫键形成多个结构域,其中重链和轻链N端的第1个结构域氨基酸序列多变,被称为可变区(VH和VL),二者为抗体同抗原结合的结构基础。另外,重链和轻链分别有3个和1个结构域的氨基酸序列相对保守,被称为恒定区(CH和 CL),重链的第2个恒定区(CH2)中存在1个N糖基化位点,该位点的糖基化对其发挥抗体依赖细胞介导的细胞毒效应具有重要作用[1-2],同时该糖基化位点上连接的寡糖链的唾液酸化程度对于抗体稳定性也存在重要影响[3]。重链第3个恒定区(CH3)介导抗体同Fc受体和补体的结合,从而在抗体效应的发挥和清除中发挥重要作用。不同的抗体由于其种类和亚类不同而在重链恒定区数目、附属结构和一些细微结构中存在一定差异。
治疗性单抗一般为人鼠嵌合、人源化或人源单抗,多为IgG1亚类,可根据其治疗目的和作用机制选择其他亚类,如IgG2a,并可在抗体基本结构的基础上对抗体结构进行改造,如:为了消除抗体依赖的细胞介导的细胞毒效应而在大肠杆菌中表达或突变CH2糖基化位点;为了消除补体激活效应而采用单臂结构或F(ab)2结构;为了提高对低抗原表达量细胞的杀伤效应而在单抗上偶联细胞毒性药物等[4]。由于抗体对应不同的抗原特异性、其结构的复杂性、作用机制的多样性以及生产工艺的复杂性都会影响抗体的质量,因此需采用多种质量控制项目和方法对单抗的质量进行评价。单抗的质量控制项目和方法选择是在对抗体结构与其安全性和有效性之间关系不断深入了解的基础上逐步发展的,同时,对方法的运用和对结果的解释也是在对分析方法的不断发展和深入理解的基础上而不断深入和变更的一个动态过程。
2 单抗制品的质量控制项目及要求
单抗制品同其他生物制品的要求一致,质量控制是贯穿终产品生产的全过程控制,从生产用起始材料或原材料的质量控制至终产品的质量控制,根据生产工艺的不同阶段设置不同的质量控制项目要求,本文主要讨论单抗原液至终产品的质量标准及相关要求。
总体上看,单抗的质量控制项目(见表 1)主要包括一般项目、理化检测、含量、鉴别、纯度、活性、安全性等几个方面[5],其中安全性方面检测包括:DNA残留、宿主细胞蛋白残留、生产过程相关外源因子和异常毒性检测。作为对纯化工艺去除外源因子能力的验证,宿主细胞DNA、宿主细胞蛋白残留和生产过程相关外源因子的检测主要在注册阶段的原液样品中进行,考虑到最适样本的问题,这些项目在成品检测中可以不检测。在产品质量标准设定和检测方法选择的过程中,应根据制品的具体情况选择合适的检测方法,并根据工艺的稳定性、产品的安全性和有效性以及方法本身的变异情况设定合适的质量标准。由于对结构与功能间关系认识的不断深入和检测技术的不断发展,产品的检定方法和质量标准是一个不断发展提高的过程,下面就当前单抗制品的检测方法和质量标准进行说明和论述。
3 单抗质量方法研究现状及其标准制定的注意事项
从表1可以看出,对于一个质量控制项目可能会采用不同的方法,从不同的侧面反映单抗的质量,特别是近年来一些新技术应用于单抗的质量控制,对单抗制品的质量控制提供了更高的保障。但同时也需考虑到,对于单抗,表1中所列出的项目只是一个较为普遍的原则,但并不是所有的检测方法都适用于每一种单抗制品,表中所规定的标准也并非适用于所有的制品,针对于某一个特定单抗来说,都会有一些特殊的因素需要考虑,下面就不同检测方法在单抗质量控制中的作用及其标准制定时需要考虑的问题作简单分析。
在一般检测项目中的可见异物检查中,要求应无肉眼可见异物,但在一些特殊单抗制品中,由于其某些特征,如分子表面有大量疏水基团或有游
离的半胱氨酸等,使其可能会形成肉眼可见的蛋白颗粒,这些制品使用时多采用在线滤器过滤的方式除去蛋白颗粒,在充分阐明颗粒性质和有具体临床研究资料的情况下,这类制品的可见异物项目检查中可以容许有肉眼可见的颗粒样物质。
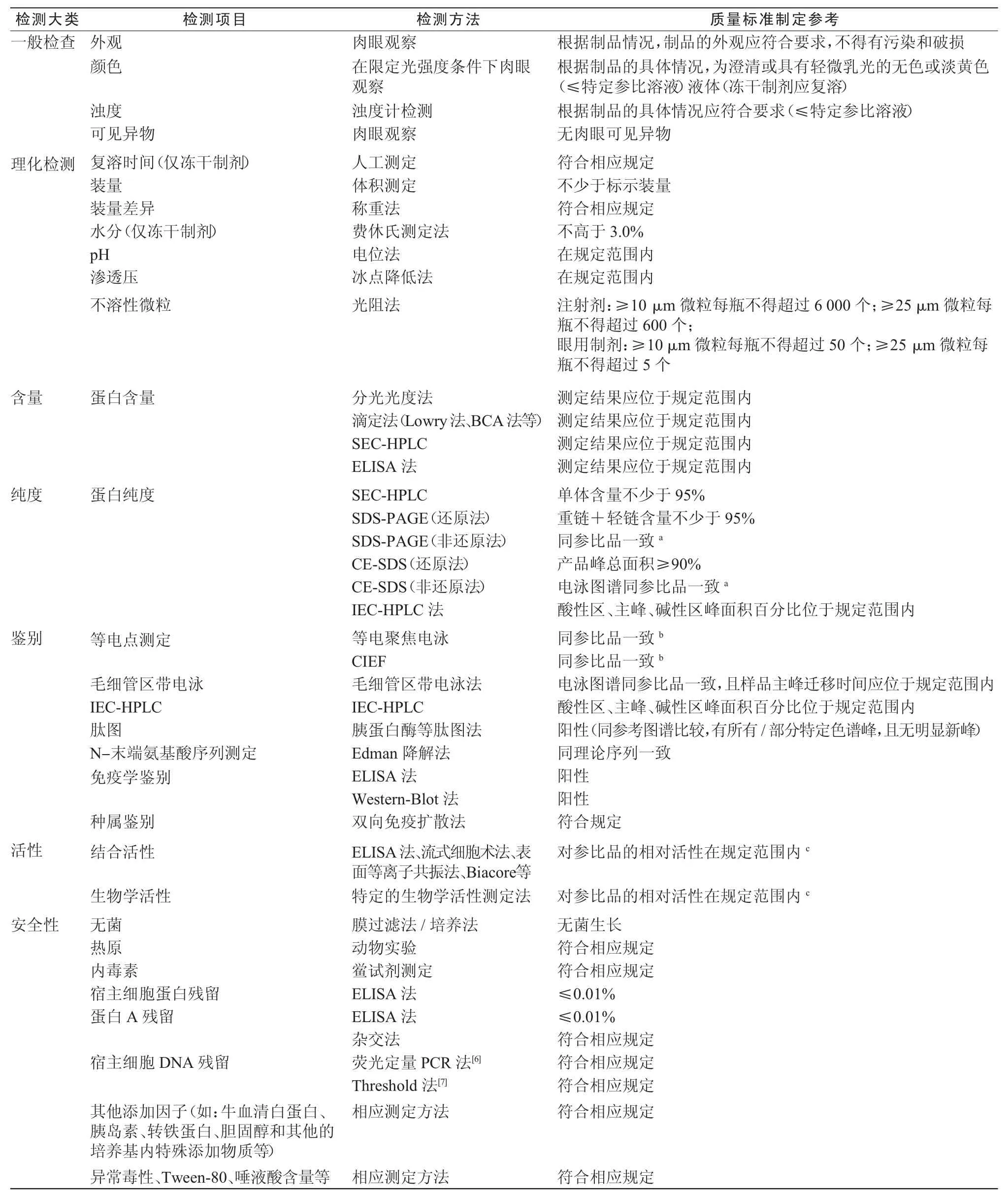
表1 单抗质量控制项目及要求
含量测定中,除使用理化的分光光度法或Lowry法和二辛可酸 (bicinchoninic acid,BCA)法等外,还可使用免疫学的酶联免疫吸附(Enzyme Linked Immunosorbent Assay,ELISA)法检测。ELISA法中如果使用特异性抗原作结合单抗的物质时,也可同时评价单抗的结合活性。同时通过比较免疫学方法和理化方法测定的蛋白含量,还可以获得总蛋白中具有特异性结合活性的蛋白所占比例的相关信息,但是ELISA法测定单抗制品中单抗含量的过程中,需对标准品的含量和活性精确标定,否则将使测定结果产生较大的误差。
纯度检测需结合高效液相色谱(HPLC)法和电泳法。HPLC法中,分子尺寸排阻高效液相色谱法(Size Exclusive Chromatography-HPLC,SECHPLC)侧重于检测单抗的单体、二聚体和多聚体含量百分比[8]。离子交换色谱法(Ion Exchange Chromatography,IEC)虽然主要用于根据电荷异质性对样品进行鉴别检测,但在某些单抗制品中,不同电荷异构体的活性具有一定差异时,需引入离子交换高效液相色谱法(IEC-HPLC)进行纯度检测,并对结果中不同电荷异构体的含量百分比予以限定[9-10],以确保具有特定活性的电荷异构体所占比例达到要求。电泳方法中包括:十二烷基硫酸钠-毛细管电泳(Capillary Electrophoresis-Sodium Dodecyl Sulphate,CE-SDS)和十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(Sodium Dodecyl Sulfate Polyacrylamide Gel Electropheresis,SDS-PAGE),主要用于检测单抗碎片和纯化过程中未去除的杂质蛋白,二者通常选择其中的一种即可。SDS-PAGE方法中,为确保灵敏度,可在使用灵敏度和分辨率更高的梯度胶的同时,在电泳中设置染色对照。由于CE-SDS检测不需要对结果进行二次处理,所以其结果较SDS-PAGE更加精确稳定客观,但受制于上样量的限制,其对杂质蛋白的检测效率不高,在某些对纯度要求较高的单抗制品中(如眼用溶液),可采用APTS(8-Aminopyren-1,3,6-trisulphonic Acid)荧光标记后使用激光诱导荧光检测器的方法提高对杂质蛋白的检出效率[11-12]。
鉴别检测中等电聚焦电泳(Isoelectroric Electrophoresis Focusing,IEF)、IEC-HPLC和肽图方法均为较常用的鉴别方法,其中胰酶肽图主要用于检测产品中发生的脱氨基、甲硫氨酸氧化、C-末端封闭和错误二硫键等结构改变[10,13-14];IECHPLC方法主要用于检测样品中不同电荷异构体的比例。IEF法中,常规的水平等电聚焦电泳方法虽然较为常用,但是其结果受电泳条件和电泳胶的影响较大,虽然使用预制胶可以在一定程度上降低变异性,但其稳定性仍然较毛细管等电聚焦电泳(Capillary Iso-Electric Focusing,CIEF)差,特别是在融合蛋白等高度糖基化的重组制品的检测中表现更为明显[15]。ICEF在可获得较稳定结果的同时,还可对不同电荷异构体的含量进行分析,其方法包括两种,一种是传统的将样品在两性电解质中聚焦后,采用化学或物理学方法,使各聚焦条带顺序通过检测窗口并进行检测的方法;另一种是在聚焦后,使用移动检测器对毛细管聚焦区域进行扫描并检测的方法,后者的结果稳定性明显高于前者[16]。另外,毛细管区带电泳(Capillary Zone Electrophoresis,CZE)近年来也被用于单抗鉴别的方法,该方法通过蛋白分子的电荷异质性进行分离,通过对比样品同参比品迁移时间的差异对样品进行鉴别。标准制定中规定迁移时间差异值应位于一个确定的范围内,该差异范围同使用的电泳方法的变异性相关,一般规定为应小于0.1 min,且样品同标准品混合后的电泳图谱中应只有1个主峰。使用ELISA和蛋白印迹 (Western-Blot)法进行鉴别时,只有使用产品特异性的抗原/抗体时才具有鉴别作用,目前一般使用通用抗体,如:抗Fc抗体和抗IgG轻链抗体对样品进行鉴别,这种鉴别方法的结果更有利于对产品相关杂质进行检测,而在对产品进行特异性鉴别方面的意义并不显著。
单抗制品的活性检测包括结合活性和生物学活性两个方面,目前对于两种活性评价方法的区分在于单抗结合靶抗原后是否引起生物学效应并对该生物学效应检测,质量控制中一般以同时包括两个方面的测定为宜。结合活性的评价方法主要包括:ELISA法、流式细胞术法和表面等离子共振法;生物学活性的评价方法主要为细胞学方法,检测单抗结合靶抗原后在靶细胞中引起的生物效应,如:补体依赖的细胞毒效应、抗体依赖的细胞毒效应、靶细胞的增殖、增殖抑制、细胞裂解以及效应细胞因子的产生等。如果生物学活性方法中设计了同配体竞争结合靶抗原的考察因素或单抗同靶抗原结合并发挥治疗作用的过程中没有或有很小竞争性因素时,则质量控制中可只评价单抗的生物学活性(如利妥昔单抗)。如单抗的治疗机制中包括了同高亲和力或高浓度的配体竞争结合靶抗原,而生物学活性方法中没有设计检测该竞争因素对单抗发挥活性的影响时,必需评价单抗的结合活性,如抗CTLA-4单抗:由于CTLA-4同B7的亲和力很高[17],因此在生物学活性评价方法中没有设定亲和力考察因素的情况下,需使用3种方法评价单抗的结合活性:间接ELISA法比较样品-参比品亲和力、竞争ELISA法评价其阻断CTLA-4结合B7的能力、Biacore法测定亲和系数。
对外源因子的检测中,目前存在较多争议和疑问的方面主要是DNA残留方面。目前有3种用于检测宿主细胞DNA残留量的检测方法:斑点杂交法、实时聚合酶链反应(Realtime-PCR)和阈值(Threshold)法。其中斑点杂交法对仪器和设备的需求最低,但是该方法操作复杂、结果重复性和可比性低且结果的判定存在一定的主观性。目前市场上已经有 Realtime-PCR检测各种宿主细胞DNA残留量的商业化试剂盒,检出限可达fg级水平,其应用逐步广泛,但聚合酶链反应(PCR)法存在易污染的缺点。Threshold法操作简便,可检测到pg级的残留DNA,但其灵敏度较上述两种方法低,且其检测试剂和设备昂贵,使其应用受到限制。目前来说,最常用的方法为斑点杂交方法,但随着Realtime-PCR法的推广和应用,可取代斑点杂交方法。
4 单抗质量控制中的标准品和检验需求
标准品是单抗质量控制中的重要参考依据,尤其在鉴别项目、结构分析和活性项目的检定中是确定样品的结构和活性的参照物,而结构和活性又是确保样品安全性和有效性最重要的2个质量控制参数,也就是说,标准品的结构和活性在很大程度上代表了产品的安全性和有效性。初期的标准品应使用小量试制阶段生产的产品制备,在临床前安全性和有效性研究中对其进行评价,并将其活性参数和结构特征同其安全性和有效性进行初步联系。最终的标准品应采用中间试制阶段生产的临床试验用批次的样品制备,在随后的临床试验中对其安全性和有效性进行评价,同时应用可能的方法尽量阐明其活性参数和结构特征,包括各级结构、电荷异质性、肽图图谱、翻译后修饰等。同时,标准品制备后,应对标准品的稳定性进行评价,并在现有稳定性数据的基础上,对标准品进行定期再标定,如在规定时间间隔内对标准品中的纯度进行评价,包括:二聚体、多聚体和碎裂片段等的形成;对标准品的结构改变进行评价,包括二硫键断裂、氧化和末端赖氨酸环化等;对标准品的活性变化进行评价,对其活性使用规定方法进行再标定。如需制备新批次的标准品,应在之前批次标准品的活性和结构研究结果的基础上,对新批次标准品的活性参数和结构特征进行详细检测,在最大程度上确保新制备批次的标准品同之前批次的标准品具有可比性。
单抗制品的检验需求主要存在于新品种注册和生产工艺的变更可能会使单抗的安全性和有效性产生改变的情况下,即生产工艺的变更可能对产品的序列、结构、内在均一性和各种结构所占的比例等产生影响,最终对产品的治疗效果和安全性产生影响。
5 未来可能引进的单抗质量控制项目和检测方法
随着对单抗结构-功能关系的深入了解和临床经验的积累,一些新的质量控制项目被引入单抗的质量标准中。如前所述,糖基化修饰不仅在单抗发挥功能中起着重要的作用,还对单抗的稳定性和免疫原性产生重要的影响[3,18]。但由于受制于缺乏简便有效的方法和对糖链结构-功能关系的深刻认识,将糖基化项目的检测作为质量控制项目的案例主要局限于部分在研究中明确糖基化对其功能具有明显影响的制品中,检测项目也主要在于唾液酸含量、糖基化程度和糖链构成等方面,相应的标准设定局限于对量的限定上。免疫原性的评价理论上应该也是一个重要的质量控制项目。现在的治疗性单抗虽然进行了人源化改造甚至为完全的人源抗体,但根据网络学说[19],仍具有免疫原性,即仍可在人体内引起相应的抗体产生,这就引起了两个问题,即:诱导产生中和性抗体的速度会不会对单抗的疗效产生明显的影响,诱导产生的抗体会不会同人体组织产生交叉反应并形成病理性自身免疫性损伤?目前该项目的研究较少,而且对单抗免疫原性的评价主要在安全性评价阶段进行,在常规质量控制中不适用。
在新的检验方法中,毛细管电泳方法是近年被引入单抗质量控制中的方法,而质谱[20-21]、核磁共振[22]、分析型超速离心[23-24]和圆二色谱[25]等技术也在单抗质量控制中开始展露头脚。毛细管电泳方法可以替代多种传统方式的电泳方法,如CE-SDS可替代传统的SDS-PAGE;CIEF可替代传统的水平等电聚焦电泳;而CZE可通过检测单抗的电荷异质性对单抗进行精确鉴别,同时毛细管电泳方法还可用于N-连接寡糖和单糖的分析和检测[26],这些检测方法均有商业化的试剂盒和标准操作规程供参考,结果稳定性好且易于验证和标准化;质谱检测对结构的解析具有高度的精确性,可有效地对单抗一级结构和翻译后修饰结构进行解析。特别是在肽图检测中,传统的紫外检测方法无法阐明每个特征峰的特征,对于多个肽段形成的单一峰也无法阐明其中组分,同时也无法对特征峰的变异和新峰的性质及可能的形成原因进行解释,而质谱检测可为上述问题的解释和解决提供重要的参考信息;虽然SEC-HPLC可检测单抗中的二聚体和多聚体,但研究人员使用已经形成大量肉眼可见颗粒的单抗样品进行SEC-HPLC检测的结果中仍为单一峰,说明该方法对超高分子量的巨大多聚体检测能力有限,而分析型超速离心克服了色谱方法的上述缺点,对多聚体的检测效率得到很大程度的提高。核磁共振方法在克服了对大分子样品检测的限制后,可用于确定单抗的三维结构,并对分子结构进行精确比较。圆二色谱方法则可对单抗的二级结构和二硫键等进行有效检测。但是受仪器昂贵、操作复杂、结果分析难度高等因素的限制,质谱、核磁共振和圆二色谱方法目前仅局限于研究阶段,而在常规批次的检定中不适用。
通过上述论述,当前单抗质量控制的重点在于为通过可比性检测,确保单抗制品的安全性和有效性,检测的范围和方法将随着对单抗的结构同功能间关系的不断深入理解而不断加深。同时,新的检测技术在单抗质量控制研究中的应用,也对进一步提高单抗的质量起到了重要作用。
[1] Shields RL,Lai J,Keck R,et al.Lack of fucose on human IgG1 N-Linked oligoscccharide improves bindings to human Fcgamma RIII and antibody dependent cellular toxicity[J].J Biol Chem,2002,277(30):26733-26740.
[2] Shinkawa T,Nakamara K,Yamane N,et al.The absence of fucose but not the presence of galactose or bisecting N-acetylglucosamine of human IgG1 complex-type oligosaccharides shows the critical role of enhancing antibody-dependent cellular cytotoxicity[J].J Biol Chem,2003,278(5):3466-3473.
[3] Junghans RP,Anderson CL.The protection receptor for IgG catabolism is the beta2-microglobulincotaining neonatal intestinal transport receptor[J]. Proc Natl Acad Sci USA,1996,93(11):5512-5516.
[4] Schrama D,Reisfeld RA,Becker JC.Antibody targeted drugs as cancer therapeutics[J].Nat Rev Drug Discov,2006,5(2):147-159.
[5] 国家药典委员会.中华人民共和国药典(2010年版)三部[S].北京:中国医药科技出版社,2010.
[6] Nissom PM.Specific detection of residual CHO host cell DNA by real-time PCR[J].Biologicals,2007,35(3):211-215.
[7] Briggs J,Panfili PR.Quantitation of DNA and protein impurities in biopharmaceuticals[J].Anal.Chem,1991,63(9):850-859.
[8] Luo P,Hayes RJ,Cha I,et al.Development of a cytokine analog with enhanced stability using computational ultrahigh throughput screening[J].Pro Sci,2002,11(5):1218-1226.
[9] Moorhouse KG,Nashabeh W,Deveney J,et al.Validation of an HPLC method for the analysis of the charge heterogeneity of the recombinant monoclonal antibody IDEC-C2B8 after papain digestion[J].J Pharm Biomed Anal,1997,16(4):593-603.
[10] Gitlin G,Tsarbopoulos A,Patel ST,et al.Isolation and characterization of a monomethioninesulfoxide variant of interferon alpha-2b[J].Pharm Res,1996,13(5):762-769.
[11] Lee TT,Yeung ES.High-sensitivity laser-induced fluorescence detection of native proteins in cappillary electrophoresis[J].J Chromatogr,1992,595(1-2):319-325.
[12] Colyer C.Noncovalent labeling of proteins in capillary electrophoresis with laser-induced fluorescence detection[J].Cell Biochem Biophys,2000,33(3):323-337.
[13] Paranandi MV,Guzzetta AW,Hancock WS,et al.Deamidation and isoasparate formation during in vitro aging of recombinant tissue plasminogen activator[J].JBiolChem,1994,269(1):243-253.
[14] Renlund S,Kilintrot IM,Nunn M,et al.Peptide mapping on HIV polypep-tides expressed in Escherichia coli:Quality control of different batches and identification of tryptic fragments containing residues of aromatic amino acids or cysteine[J].JChromatogra,1990,512:325-335.
[15] Jochheim C,Novick S,Balland A,et al.Separation of Enbrel○R(rhuTNFR:Fc)isoforms by capillary isoelectric focusing[J].Chromatographia,2011,53(S):59-65.
[16] Lubiniecki A,Volkin DB,Federici M,et al.Comparability assessments of process and product changes made during development of two different monoclonalantibodies[J].Biologicals,2011,39(1):9-22.
[17] Ellis JH,Burden MN,Vinogradov DV,et al.Interactions of CD80 and CD86 with CD28 and CTLA4[J].J Immunol,1996,156(8):2700-2709.
[18] Raju TS,Briggs JB,Borge SM,et al.Species-specific variation in glycosylation ofIgG: evidence forthe species-specific sialylation and branch-specific galactosylation and importance for engineering recombinant glycoprotein therapeutics[J].Glycobiology,2000,10(5):477-486.
[19] Coutinho A.The Network Theory:21 Years Later[J].Scand J Immunol,1995,42(1):3-8.
[20] Mhatre R,Woodard J,Zeng C.Strategies in a monoclonal antibody via mass spectrometry[J].Rapid Commun Mass Spectrom,1999,13(24):2503-2510.
[21] Shen FW,Kwong MY,Keck RG et al.The application of tert-butylhydroperoxide oxidation to study sites of potential methionine oxidation in a recombinant antibody[M]//Marshak D,ed.Techniques in Protein Chemistry VII.San Diego:Academic Press,1996:275-284.
[22] Clore GM,Gronenborn AM.NMR structure determination of proteins and protein complexes larger than 20 kDa[J].Curr Opin Chem Biol,1998,2(5):564-570.
[23] Laue TM,Stafford WF 3rd.Modern applications of analytical ultracentrifugation[J].Annu Rev Biophys Biomol Structure,1999,28:75-100.
[24] Lebowits J,Lewis MS,Schuck P.Modern analytical ultracentrifugation in protein science:a tutorial review[J].Protein Sci,2002,11(9):2067-2079.
[25] Kelly SM,Price NC.The use of circular dichroism in the investigation of proteinstructureandfunction[J].CurrProteinPeptSci,2000,1(4):349-384.
[26] Ma S,Nashabeh W.Carbohydrate analysis of a chimeric recombinant monoclonal antibody by cappillary electrophoresis with laser-induced fluorescence detection[J].Anal Chem,1999,71(22):5185-5192.
The Quality Control of Therapeutic Monoclonal Antibody Products
Zhang Feng/writing,Meng Shufang/proofreading(Division of Monoclonal Antibody Products of the National Institutes for Food and Drug Control,Beijing 100050,China)
The curative effects of therapeutic monoclonal antibody products have been proved for the treatment of cancer,autoimmune diseases,transplantation and infectious diseases.The varieties and market share of therapeutic monoclonal antibody products have risen considerably year after year.Along with the development and marketing of new therapeutic monoclonal antibodies,more importance has been attached to the quality control of these products so as to ensure their quality.Because of the complexity of therapeutic monoclonal antibody products both in their structure and manufacturing,the quality controls of the products become more difficult.This article briefly reviewed the principle of standard establishment and methods for the quality control of therapeutic monoclonal antibody products based on the latest progress in the world and our working experience in the quality control of the products.
Therapeutic Monoclonal Antibody;Quality Control;Method;Specification
10.3969/j.issn.1672-5433.2013.01.006
2012-09-28)
“重大新药创制”科技重大专项(2009ZX09307-001);国家高技术研究发展计划(863计划)(2007AA021601,2007AA021204)
张峰,男,硕士,副主任技师。研究方向:治疗性单克隆抗体的质量控制。E-mail:zhf5122@sina.com
