HSD1蛋白在精子发生过程中的空间特异性表达
2013-03-15陈迎春缪时英王琳芳
宋 伟,陈迎春,缪时英,王琳芳
(中国医学科学院基础医学研究所北京协和医学院基础学院医学分子生物学国家重点实验室生物化学与分子生物学系,北京100005)
蛋白质在细胞中的定位与其功能之间存在密切关系。越来越多的研究证据显示,很多蛋白质在细胞中的空间分布呈动态变化,如在细胞周期的不同时相或细胞发育的不同阶段等。在这些情况下,蛋白质将根据细胞的生理需要定位于不同的亚细胞结构,从而发挥特定功能。因此,探讨蛋白质在时间和空间上的特异表达变化有助于我们了解其功能。精子发生过程中存在许多空间与时间特异性表达基因,它们在生精细胞分化成熟为精子的过程中发挥着重要作用[1-3]。最近研究发现一些蛋白质在生精细胞分化的不同阶段定位于不同的亚细胞结构,进而发挥不同作用调节精子的分化与成熟[4-6]。因此,研究这些具有空间分布动态变化的蛋白质功能对阐明精子发生的分子机制具有重要意义。
1 材料与方法
1.1 材料
SPF 级雄性ICR 小鼠体质量25 ±5 g中国医学科学院动物研究所(合格证号:0202589)。CHO 细胞系(中国医学科学院基础医学研究所细胞中心提供)。HSD1 兔多克隆抗体(王琳芳教授实验室制备)。免疫荧光检测试剂盒(中杉金桥生物技术有限公司)。pEGFP-C1 真核表达载体(王琳芳教授实验室保存)。
1.2 方法
1.2.1 载体构建:从睾丸cDNA 文库中扩增HSD1全长片段,与pEGFP-N1 载体进行相同双酶切,经琼脂糖凝胶电泳切胶回收后进行连接、转化,最终筛选阳性克隆并送测序。测序正确的克隆用于转染实验。
1.2.1 细胞转染:转染前1 天消化并接种CHO 细胞至12 孔板,使第2 天转染时细胞汇合度为60% ~80%。使用LIPOFECTAMINETM2000 进行转染,具体步骤按说明书操作。
1.2.3 生精细胞的分离:各期生精细胞的分离采用改良重力沉降法。分离ICR 小鼠曲细精管,通过胶原蛋白酶、胰蛋白酶和DNase Ⅰ进行33 ℃温育消化,制成单细胞悬液并进行细胞计数。制备2% ~4%的牛血清白蛋白连续梯度溶液,加入单细胞悬液,4 ℃沉降3 h。分别收集细胞溶液组分,并接种到无菌培养瓶中,37 ℃培养6 ~8 h。轻摇培养瓶使精原细胞悬浮并吸出培养液,光镜下检测细胞纯度和数量,并计算均值。
1.2.4 成熟精子的分离:12 周龄的雄性小鼠断颈处死后取附睾,置于PBS 溶液中。将附睾剪碎,移入离心管中,4 ℃静置2 h。小心吸出上清,光镜下观察到活动精子。3 500 r/min离心15 min,收集成熟精子。
1.2.5 细胞免疫荧光检测:免疫荧光检测试剂盒(英骏公司),具体步骤按说明书操作。
1.2.6 免疫电镜检测:固定液4 ℃固定细胞2 h。冰预冷乙醇进行梯度脱水,K4M 低温包埋剂浸泡去除乙醇。包埋和聚合样品,制备免疫电镜超薄切片。进行电镜金标免疫反应,电镜观察结果。
2 结果
2.1 HSD1 蛋白在小鼠生精细胞中呈空间特异性表达分布
HSD1 蛋白从精母细胞期开始表达,并且主要表达于初级精母细胞和圆形精子细胞的胞质中;而在发育成熟的精子细胞,HSD1 蛋白主要表达于顶体和尾部(图1)。
2.2 HSD1 蛋白在CHO 细胞中呈空间型表达分布
成功构建HSD1 和绿色荧光蛋白融合表达的载体质粒pEGFP-C1-HSD1。将该质粒转染处于生长对数期的CHO 细胞24 h后,HSD1 蛋白在该细胞系中主要有3 种分布形式:1)主要分布在胞核中,在总数为227 个转染细胞中,16%(36 个)细胞中融合蛋白主要分布在胞核中;2)在胞质和胞核中均有分布,54%(124 个)细胞中融合蛋白分布在胞质和核中;3)主要分布在胞质中30%(67 个)细胞中融合蛋白主要定位在胞质中(图2)。
2.3 HSD1 蛋白具有细胞质-细胞核的穿梭特性
2.3.1 出核转运抑制剂细霉素B 抑制HSD1 蛋白在CHO 细胞中的转运出核:出核抑制剂Leptomycin B (LMB)处理CHO 细胞后大部分HSD1-GFP 融合蛋白分布在胞核中(图3A)。在总数为229 个转染细胞中,63%(143 个)细胞中融合蛋白存在于胞核中;29%(67 个)细胞中融合蛋白分布在胞质和核中;8%(19 个)细胞中融合蛋白分布在胞质中(图3B)。由此初步判定HSD1 蛋白在细胞中呈动态分布,存在细胞核-质间的穿梭运动。
2.3.2 HSD1 蛋白通过核孔复合体转运出核:免疫电镜结果显示,HSD1 蛋白在胞质和胞核中均有分布(图3C)。同时在核孔面向胞核一侧发现一串阳性金颗粒,表明HSD1 蛋白正在通过核孔复合体,从而有力的说明该蛋白在细胞中具有细胞核-质穿梭行为(图3C)。


3 讨论
HSD1 基因是王琳芳教授实验室利用不孕妇女患者的血清筛选人睾丸λgt11 cDNA 表达型文库而获得的一个新基因,其GenBank 注册号为U12978。该基因编码一个由523 个氨基酸组成的睾丸高表达蛋白质。该实验室前期研究发现,HSD1 与微管蛋白结合并调节其装配[7];HSD1 蛋白参与调节细胞G2/M 期进程[8];HSD1 蛋白与ACT 结合调节精子发生过程中CREM-ACT 介导的基因转录[9]。由此推测,HSD1 在精子发生过程中是一个多功能蛋白质。蛋白质的亚细胞定位与其功能关系密切[10-11],因此观察HSD1 蛋白在生精细胞中的空间特异性分布情况。免疫荧光实验结果显示,HSD1 蛋白在初级精母细胞和圆形精子细胞的胞质中表达,而在成熟精子细胞中主要表达于顶体和尾部。为进一步研究该蛋白的亚细胞定位,外源表达pEGFP-C1-HSD1融合蛋白观察其在CHO 细胞中的动态分布情况。研究结果表明该蛋白在CHO 细胞中存在3 种分布形式:细胞核型、细胞质型和核质分布型。根据这种分布特点推测,HSD1 蛋白具有核质穿梭能力。使用特异性出核抑制剂LMB 后,HSD1-GFP 融合蛋白大部分滞留于CHO 细胞核中,由此判定该蛋白在细胞中存在细胞核-质间的穿梭运动。这一结论进一步被免疫电镜结果所证实,观察到正在通过核孔复合体的金颗粒标记的HSD1 蛋白,从而更有力的说明该蛋白在细胞中具有细胞核-质穿梭行为。上述研究结果为进一步探索HSD1 蛋白在精子发生过程中的分子机制提供了重要依据。
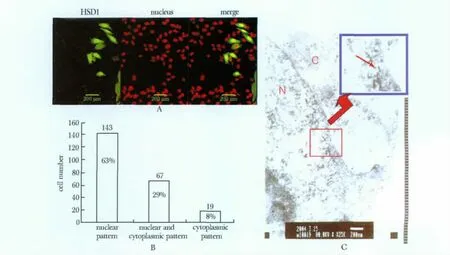
图3 出核转运抑制剂细霉素B 处理CHO 细胞后HSD1 的定位检测Fig 3 The localization of HSD1 in CHO cells after treating with nuclear transport inhibitor LMB by immunofluorescence(×400)and immune electron microscopy (×30 000)
[1]Fu J,Wang Y,Fok KL,et al.Anti-ACTL7a antibodies:a cause of infertility[J].Fertil Steril,2012,97:1226-1233.
[2]Wang Y,Zhang N,Zhang X,et al.Experimental immunological infertility effect of anti-GAPDH-2 antibodies on the fertility of female mice[J].Fertil Steril,2009,92:2020-2027.
[3]Li S,Qiao Y,Di Q,et al.Interaction of SH3P13 and DYDC1 protein:a germ cell component that regulates acrosome biogenesis during spermiogenesis[J].Eur J Cell Biol,2009,88:509-520.
[4]Sasaki K,Suzuki A,Kagatsume S,et al.Acetylation of Prrp K150 regulates the subcellular localization[J].Gene,2012,491:13-19.
[5]Lin YT,Yen PH.A novel nucleocytoplasmic shuttling sequence of DAZAP1,a testis-abundant RNA-binding protein[J].RNA,2006,12:1486-1493.
[6]Cho YS,Chennathukuzhi VM,Handel MA,et al.The relative levels of translin-associated factor X (TRAX)and testis brain RNA-binding protein determine their nucleocytoplasmic distribution in male germ cells[J].J Biol Chem,2004,279:31514-31523.
[7]Tang X,Zhang J,Cai Y,et al.Sperm membrane protein(hSMP-1)and RanBPM complex in the microtubule-organizing centre[J].J Mol Med (Berl),2004,82:383-388.
[8]Li R,Tang XL,Miao SY,et al.Regulation of the G2/M phase of the cell cycle by sperm associated antigen 8(SPAG8)protein[J].Cell Biochem Funct,2009,27:264-268.
[9]Wu H,Chen Y,Miao S,et al.Sperm associated antigen 8(SPAG8),a novel regulator of activator of CREM in testis during spermatogenesis[J].FEBS Lett,2010,584:2807-2815.
[10]Cmielova J,Rezacova M.P21Cip1/Waf1 protein and its function based on a subcellular localization[J].J Cell Biochem,2011,112:3502-3506.
[11]Thomsen C,Udhane S,Runnberg R,et al.Fused in sarcoma (FUS)interacts with the cytolinker protein plectin:implications for FUS subcellular localization and function[J].Exp Cell Res,2012,318:653-661.
