荸荠不同组培快繁方式的对比研究
2013-03-09高美萍,陈丽娟,蔡炳华等
荸荠不同组培快繁方式的对比研究
高美萍,陈丽娟,蔡炳华,江文,郭畅,董伟清,闭志强
(广西农业科学院生物技术研究所,南宁,530007)
以广西农科院生物所选育的荸荠组培苗桂蹄2号为材料,利用间歇浸没式生物反应器(TIBs)与传统固体组培进行快繁培养,对比研究两种技术体系。研究结果表明,TIBs系统可使荸荠组织培养一代增殖40倍以上,远远高于传统方法,且培养出的植株分蘖多,叶状茎粗,生根少,长势好。
荸荠;间歇浸没式生物反应器(TIBs);固体组培;增殖;植株生长势
1 材料与方法
1.1 试验材料
荸荠材料,经过茎尖培养脱毒的桂蹄2号第五代继代苗,由广西农科院生物技术研究所提供。固体培养参照杭玲等[13]和林辉锋等[14]组培快繁技术设计,培养瓶为250 mL翠绿色玻璃瓶,瓶高13 cm,直径7 cm,固体培养基体积30 mL,凝固剂用卡拉胶。TIBs系统根据Lorenzo等[15]的设计思路建立,TIBs系统中培养瓶和储液瓶分别为2.5、3.0 L的广口无色玻璃瓶和三角瓶,瓶高分别为26、30 cm,直径分别14、15 cm。储液瓶中液体培养基体积为1 L。
1.2 试验方法
TIBs系统各参数参照Lorenzo等的设计方案,即间歇频率按浸没1 min间歇3 h、接种密度为10丛/瓶,每15棵芽为一丛。TIBs系统增殖培养阶段为40 d。固体培养试验继代接种密度为5丛/瓶,20 d继代1次。以上各试验均采用相同培养环境和培养基成分,即光强1 500 lx;光周期:16 h光照,8 h黑暗;温度25~28℃的培养环境。培养基继代增殖成分:MS+6-BA 1.5 mg/L+NAA 0.01 mg/L+白糖30 g/L。TIBs系统5套,固体培养10瓶。每隔10 d拍照记录一次,40 d后统计增殖数,计算增殖率,并比较2种方法的增殖率、组培材料的长势等。
2 结果与分析
2.1 TIBs系统与传统固体培养荸荠增殖率的比较
利用间歇浸没式生物反应器(TIBs)与传统固体组培进行快繁培养40 d后,结果如表1所示,利用TIBs系统进行荸荠组织培养,除去1瓶污染,第1代增殖数为389丛、426丛、459丛、406丛,平均增殖数420丛,增殖率为42倍。传统固体组培选择其中长势最好的5瓶,经过第一代、第二代增殖,增殖平均数为41.8丛,增殖率为8.36倍。可见,TIBs系统增殖率远远高于传统固体组培方法。
2.2 TIBs系统与传统固体培养荸荠生长势的比较
利用间歇浸没式生物反应器(TIBs)与传统固体组培养进行快繁培养,各个阶段生长势结果如表2所示,TIBs系统中的组培苗分蘖多,叶状茎粗,生根少,长势好,优于传统的固体培养。
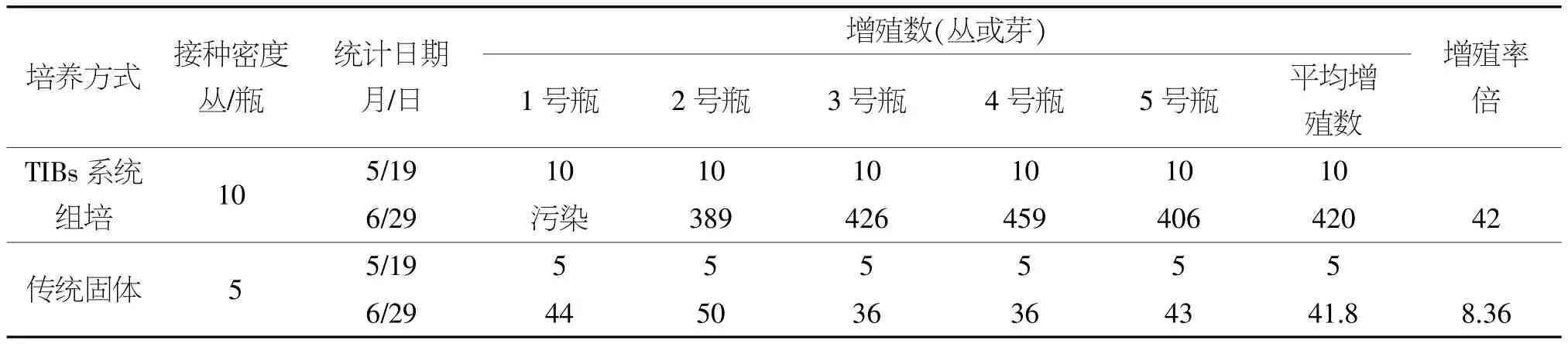
表1 TIBs系统与传统固体组培荸荠增殖率的比较

表2 TIBs系统与传统固体组培植株生长势的比较
3 小结与讨论
间歇浸没式生物反应器是一套集植物组织培养和植物次生代谢物质研究为一体的设备。该培养方式结合了固体培养和液体培养的优点而舍弃其缺点,为植物在液体培养的过程中提供了一个良好的气体交换环境[16],防止营养成分的沉积及有害物质的过度积累[17],保证组培苗充分有效地利用培养基的营养成分。
本试验利用TIBs系统和传统固体法进行荸荠组培快繁,对比研究发现,在相同培养条件下,TIBs系统增殖率达40倍,远远高于传统固体培养方法。其次,TIBs系统中的组培苗分蘖多,叶状茎粗,生根少,长势好,优于传统的固体培养。据Bernale等在2008年报道,甘蔗在一代增殖可达40倍,在田间的生长情况也较传统方法获得的组培苗适应性好。Angela等在2009年报道,澳大利亚的几个不同甘蔗品种在不同生物反应器进行试验比较,其中利用TIBs系统的甘蔗组培苗一代增殖率也均超20倍[12]。同类报道的植物种类还有辰星草、苹果[6]、菠萝[10]、香蕉[7,5]、甘蔗[11]、山药[9]、桉树[8]等。
传统的固体培养由于成本较高,劳动密集等原因,导致荸荠健康种苗生产尚无法满足荸荠种植业的需求。利用TIBs系统开展荸荠健康种苗的快速繁殖和生产,有望成为荸荠产业化的理想选择。目前,该试验尚处于初步阶段,系统和技术有待于进一步研究。同时,该试验为推广TIBs系统在植物组培中的应用提供一定参考。
[1]Etienne H,Berthouly M.Temporary immersion systems in plant micropropagation[J].Plant Cell Tissue Organ Culture, 2002,69:215-231.
[2]Be L V,Debergh P C.Potential low cost micropropagation of pineapple (Ananas comosus)[J].South African J Bot,2006, 72:191-194.
[3]Akita M,Takayama S.Stimulation of potato(L.)tuberization by semicontinuous liquid medium surface level control[J].Plant Cell Rep,1994,13:184-187.
[4]Levin R,Gaba V,Tal B,et al.Automated plant tissue culture for mass propagation [J].Bio Technology,1998,6: 1 035-1 038.
[5]Haq I U,Dahot M U.Effect of permanent and temporary immersion systems on banana micro-propagation[J].Pak J Bot,2007,39(5):1 763-1 772.
[6]Zhu L H,Li X Y,Welander M.Optimisation of growing conditions for the apple rootstock M26 grown in RITA containers using temporary immersion principle[J].Plant Cell Tissue Organ Culture,2005,81:313-318.
[7]Roels S,Escalona M,Cejas I,et al.Optimization of plantain (Musa AAB)micropropagation by temporary immersion sys tem[J].Plant Cell Tissue Organ Culture,2005,82:57-66.
[8]Mc Alister B,Finnie J,Watt M P,et al.Use of the temporary immersion bioreactor system (RITA)for production of commercial Eucalyptus clones in Mondi Forests (SA)[J]. Plant Cell Tissue Organ Culture,2005,81:347-358.
[9]Jova M C,Kosky R G,Pérez M B,et al.Production of yam microtubers using a temporary immersion system[J].Plant Cell Tissue Organ Culture,2005,83:103-107.
[10]Escalona M,Samson G,Borroto C.Physiology of effects of temporary immersion bioreactors on micropropagated pineapple plantlets[J].In Vitro Cell Dev Biol:Plant,2003, 39:651-656.
[11]Lorenzo J C,González B L,Escalona M.Sugarcane shoot formation in an improved temporary immersion system[J]. Plant Cell Tissue Organ Culture,1998,54:197-200.
[12]Mordocco A M,Brumbley J A,Lakshmanan P,et al.Development of a temporary immersion system (RITA)for mass production of sugarcane(Saccharum spp.interspecific hybrids)[J].In Vitro Cell Dev Boil:Plant,2009,45: 450-457.
[13]杭玲,黄卓忠,廖首发,等.荸荠脱毒及组培快繁技术研究与应用[J].江苏农业科学,2007(6):143-144.
[14]林辉锋,周辉明,周建金,等.荸荠的组织培养和快速繁殖探讨[J].浙江农业科学,2011(6):1 241-1 243.
[15]Singh G,Sandhu S K,Meeta M,et al.In vitro induction and characterization of somaclonal variation for red rot and other agronomic traits in sugarcane[J].Euphytica,2008, 160:35-47.
[16]Leathers R R,Smith M A L,Aitken-Christie J.Automation of the bioreactor process for mass propagation and secondary metabolism [M]//Aitken-Christie J,Kozai T, Smith M A L.Automation and environment control in plant tissue culture.Dordrecht:Kluwer Acad Publ,1995: 187-214.
[17]Doran P M.Design of reactors for plant cells and organs[J]. Bioprocess Design Control,1993,48:116-169.
Comparison of Different Rapid Propagation Methods of Water Chestnut
GAO Meiping,CHEN Lijuan,CAI Binghua,JIANG Wen,GUO Chang,DONG Weiqing,BI Zhiqiang
Taking the tissue culture seedlings of Guiti No.2 as materials,we studied and compared two rapid propagation technical systems temporary immersion bioreactors system(TIBs)and traditional solid culture of water chestnut.The results showed that,the multiplication times of TIBs method was more than 40,which was much higher than that of traditional solid culture method,and the plants had more tillers,thicker cladophyll,less roots and grew well,providing a reference for the popularization and application of TIBs system in plant tissue culture.
Water chestnut;Temporary immersion bioreactors system (TIBs);Solid culture;Rapid propagation;Plant growth vigor
S645.3
:A
:1001-3547(2013)18-0133-03
10.3865/j.issn.1001-3547.2013.18.043
国家科技支撑计划项目(2012BAD27B01-6),广西科技成果转化与推广计划(桂科转1346004-28),广西农科院重点项目(桂农科2012JZ04)
高美萍(1985-),女,硕士,实习研究员,从事荸荠组培快繁研究,电话:13677716023,E-mail:gmp2009@163.com
2013-08-29
