紫甘薯汁抗肿瘤活性及诱导人肝癌细胞HepG2凋亡机制研究
2013-03-07陈永强刘金娟曹成亮卞光凯蒋继宏
陈永强,刘金娟,曹成亮,卞光凯,蒋继宏*
(徐州师范大学 江苏省药用植物生物技术重点实验室,江苏 徐州 221116)
紫甘薯汁抗肿瘤活性及诱导人肝癌细胞HepG2凋亡机制研究
陈永强,刘金娟,曹成亮,卞光凯,蒋继宏*
(徐州师范大学 江苏省药用植物生物技术重点实验室,江苏 徐州 221116)
目的:研究紫甘薯汁的抗肿瘤活性及其诱导肝癌细胞HepG2凋亡机制。方法:采用Alamar Blue、倒置显微镜、荧光显微镜、扫描电镜、琼脂糖凝胶电泳、RT-PCR和Western blotting法检测不同体积分数的紫甘薯汁对SGC-7901、HO-8910和HepG2细胞的增殖抑制作用及诱导人肝癌细胞HepG2凋亡机制研究。结果:与对照组相比,体积分数5%和10%的紫甘薯汁对SGC-7901、HO-8910和HepG2细胞具有抑制作用,呈体积分数依赖性;作用HepG2细胞48h后,能观察到细胞皱缩和凋亡小体以及凋亡细胞典型的梯状DNA条带。RT-PCR和Western blotting法检测结果显示,紫甘薯汁可以诱导HepG2细胞中Fas、FADD、Caspase-3、Caspase-8和p53 mRNA表达水平上调和蛋白表达量增加,Caspase-3、Caspase-8、Caspase-9的活性裂解片段明显增高且Caspase-3酶活性显著提高。结论:紫甘薯汁体外对肿瘤细胞的增殖具有一定抑制作用且通过细胞表面死亡受体途径诱导HepG2细胞凋亡,同时p53在此凋亡过程中也起着重要的作用。
紫甘薯;人肝癌细胞HepG2;抗肿瘤活性;细胞凋亡
甘薯是世界十大主要粮食作物之一,中国是最大的薯类生产国,约占世界薯类生产总量的65%[1]。而紫甘薯是甘薯的一个新品种,近年来对紫甘薯的研究主要集中于紫甘薯中的植物化学物质如花色苷类[2]、酚类物质(咖啡酸、绿原酸异构体、咖啡酸甲酯和咖啡酸乙酯)[3-5]及多糖[6]等的研究分离纯化及药理学研究,发现它们具有抗氧化、抗肿瘤、降血脂血糖、保肝的功效[7-10]。但长期以来人们并没有把紫甘薯中这些植物化学物质作为预防肿瘤的物质来应用,如果紫甘薯及其制品中的植物化学物质在肿瘤的预防及抗肿瘤效果上存在一定的交互作用,则可以放弃高成本的提取植物化学物单体,而选择一种加工简单、经济方便、符合人们生活方式及饮食习惯的消费产品,来满足人们通过正确的膳食达到预防及治疗肿瘤的需求。同时肿瘤是一种多基因疾病,与单体化合物治疗效果相比,复合物可以针对多个基因或基因簇来抑制多个基因的表达,从而能更有效地抑制肿瘤生长。本实验选择紫甘薯汁进行抗肿瘤活性及其诱导人肝癌细胞HepG2凋亡机制研究,旨在为合理开发利用紫甘薯在肿瘤的预防及治疗方面的作用提供一定的科学依据。
1 材料与方法
1.1 材料、试剂与仪器
肝癌细胞HepG2、人胃癌细胞SGC-7901和人宫颈癌细胞HO-8910 中国科学院上海生命科学研究院细胞资源中心;紫甘薯购自徐州易初莲花超市,由徐州师范大学江苏省药用植物生物技术重点实验室鉴定。
Alamar Blue 美国Sigma公司;Caspase-9、Caspase-8、Caspase-3、p53、Fas、FADD和GAPDH抗体美国Santa Cruz Biotechnology公司;HRP标记的羊抗兔IgG、BCIP/NBT碱性磷酸酯酶显色试剂盒、Caspase-3活性检测试剂盒、Western及IP细胞裂解液 碧云天生物技术研究所;逆转录试剂盒 日本TaKaRa Shuzo公司;Caspase-9、Caspase-8、Caspase-3、p53、Fas、FADD和GAPDH引物由生工生物工程(上海)股份有限公司合成;其余试剂为国产分析纯。
IBE2000显微镜 韩国COIC公司;CO2细胞培养箱 日本三洋公司;SpectroMax M2荧光检测仪 美国Molecular Devices公司;96孔细胞培养板 美国Gibco公司;扫描电镜 日本日立公司;荧光显微镜 德国莱卡公司;电泳仪及转膜仪 美国伯乐公司。
1.2 紫甘薯汁的制备
紫甘薯汁的制备参照文献[11],将紫甘薯切成约1cmh1cmh1cm块状,然后采用家用榨汁机将其榨成汁液,用低温离心机4℃、5000r/min离心10min,取上清液保藏于—20℃冰箱,备用。
1.3 细胞培养与体外抗肿瘤活性实验
采用Alamar Blue法检测体外抗肿瘤细胞活性,具体实验方法参照文献[12]。
1.4 倒置显微镜观察细胞凋亡形态的变化
取形态均匀状态良好的HepG2细胞,用胰酶消化后以细胞数5h104个/mL 接种于6孔培养板中,24 h细胞贴壁后,加入不同体积分数的紫甘薯汁培养48h后,用倒置相差显微镜观察形态并拍照。
1.5 Hoechst 33258染色法观察细胞凋亡形态变化
HepG2细胞经不同体积分数的紫甘薯汁处理48h后,将配制好的Hoechst 33258染液加入收集好的细胞悬液中,染液终质量浓度为5μg/mL,染色10min,取10μL滴于盖玻片上,荧光显微镜下观察。以上实验重复3次。
1.6 扫描电镜观察细胞凋亡形态的变化
经不同体积分数的紫甘薯汁处理48h后的HepG2细胞,用胰酶液消化并收集细胞,用3%的戊二醛固定液固定过夜,经乙醇梯度脱水后进行扫描电镜观察细胞的形态变化并拍照。
1.7 DNA 琼脂糖凝胶电泳
参照Herrmann等[13]的方法,略有改动。将紫甘薯汁处理组和对照组细胞分别收集于1.5mL离心管中,用PBS清洗2次,5000r/min离心5min;弃上清,向沉淀中加入50μL细胞裂解液28℃裂解30min,重复1次;裂解液每次用2000r/min 离心5min,将获得的裂解上清液中加入RNaseA(0.5mg/mL)和1%的SDS,37℃处理2h;接着加入蛋白酶K(2mg/mL),56℃处理2h;加入0.5倍体积的5mol/L乙酸铵,2.5倍体积的无水乙醇,—20℃过夜沉淀;然后再4℃、13000r/min离心20min弃上清液;最后用无水乙醇清洗1次,干燥,溶于TE缓冲液中,1.8%琼脂糖凝胶电泳,40V、1.5h EB染色,紫外灯下观察拍照。
1.8 RT-PCR检测细胞凋亡相关因子表达量变化
不同体积分数紫甘薯汁处理HepG2细胞24h后,用TRIzol试剂提取总RNA,按TaKaRa RNA PCR试剂盒说明书进行逆转录。Caspase-3上下游引物分别是5’-ATGGAAGCGAATCAATGGAC-3’和5’-ATCACGCATCAATTCCACAA-3’,PCR产物为2 4 2 b p;C a s p a s e-8上下游引物分别是5’-A T G C A G G G G C T T T G A C C A C G A C-3’和5’-TCCCCCTGACAAGCCTGAATAAAA-3’,P C R产物为2 9 2 b p;C a s p a s e-9上下游引物分别是5’-G C G A A C T A A C A G G C A A G C A-3’和5’-CCAAATCCTCCAGAACCAAT-3’,PCR产物为144bp;FADD上下游引物分别是5’-AGATCGACAGCATCGAGGAC-3’和5’-CCACTCCTGTTCTGGAGGTC-3’,PCR产物为199bp;Fas上下游引物分别是5’-CTCCAAGGGATTGGAATTGA-3’和5’-GACAAAGCCACCCCAAGTTA-3’, PCR产物为443bp;p53上下游引物分别是5’-GAGCACTGCCCAACAACAC-3’和5’-ATGGCGGGAGGTAGACTGA-3’,PCR产物为2 5 1 b p;G A P D H上下游引物分别是5’-GAAGGTCGGAGTCAACGGATTT-3’和5’-CTGGAAGATGGTGATGGGATTTC-3’,PCR产物为223bp。PCR反应程序:94℃ 30s,56℃ 30s,72℃ 1min,30个循环,1%琼脂糖凝胶电泳检测,凝胶图像分析系统拍照。
1.9 Western blotting 检测蛋白质表达
不同体积分数的紫甘薯汁处理HepG2细胞48h后,用Western及IP细胞裂解液100μL充分裂解提取蛋白,考马斯亮蓝G250 法测样品蛋白浓度后以12% SDS-PAGE分离,然后将蛋白转移到PVDF膜上,5%的脱脂奶粉封闭2h,一抗(1:500)4℃封闭过夜,二抗(1:2000)37℃孵育2h。然后利用碧云天生物技术研究所生产的BCIP/NBT碱性磷酸酯酶显色试剂盒,按照操作手册进行显色。然后用数码相机进行拍照记录。实验重复3次。
1.10 Caspase-3酶活力的检测
Caspase-3酶活力利用碧云天生物技术研究所生产的酶活性检测试剂盒进行检测。收集经紫甘薯汁处理48h后的HepG2细胞并用细胞裂解液裂解收集总蛋白,总蛋白定量后与Caspase-3底物Ac-DEVD-pNA于37℃反应2h后,用酶标仪在405nm波长处读取吸光度。
2 结果与分析
2.1 紫甘薯汁对人3株肿瘤细胞增殖的抑制作用
HepG2、SGC-7901和HO-8910细胞经不同体积分数(2.5%、5%和10%)的紫甘薯汁处理48h后,经Alamar Blue法检测结果如图1所示,随着紫甘薯汁体积分数的增加,对3株肿瘤细胞的抑制率逐渐增大,具有一定的剂量依赖性。其中人肝癌细胞株HepG2对紫甘薯汁最为敏感,当紫甘薯汁体积分数为5%和10%时抑制率分别为(45.09f1.76)%和(81.58f3.04)%。因此,选择HepG2为后续研究对象,进一步研究紫甘薯汁诱导HepG2细胞凋亡的分子机制。

图 1 紫甘薯汁对HepG2细胞增殖的抑制作用Fig.1 Inhibitory effects of purple sweet potato juice on the proliferation of HepG2 cells
2.2 紫甘薯汁诱导HepG2细胞凋亡的检测
人肝癌细胞株HepG2经5%和10%的紫甘薯汁处理48h后,用倒置显微镜观察细胞生长情况,结果如图2A显示,对照组细胞生长情况较好,贴壁较牢固,细胞间紧密相连;随着紫甘薯汁体积分数增加,细胞逐渐变圆,脱落,悬浮细胞逐渐增多,且悬浮细胞出现皱缩,周围出现凋亡小体状,呈现出明显的凋亡特征。Hoechst 33258荧光染料染色结果如图2B所示,对照组细胞在显微镜下呈均匀较弱荧光,而随着紫甘薯汁体积分数的增加,越来越多的细胞在荧光显微镜下呈现亮蓝色荧光,从而证明越来越多的细胞表现出核质浓缩、核仁破碎等凋亡特征。利用电镜检测细胞形态如图2C所示,对照组细胞表面相对光滑,而经紫甘薯汁处理48h后,细胞固缩,表面呈现出大量的小球结构即凋亡小体。DNA琼脂糖凝胶电泳显示,经5%和10%的紫甘薯汁处理48h后HepG2细胞基因组DNA呈现典型的梯状凋亡细胞条带,而对照组细胞DNA完整(图3)。

图 2 紫甘薯汁诱导HepG2细胞凋亡的形态学观察Fig.2 Cell morphology analysis of HepG2 cells after treatment with different concentrations of purple sweet potato juice
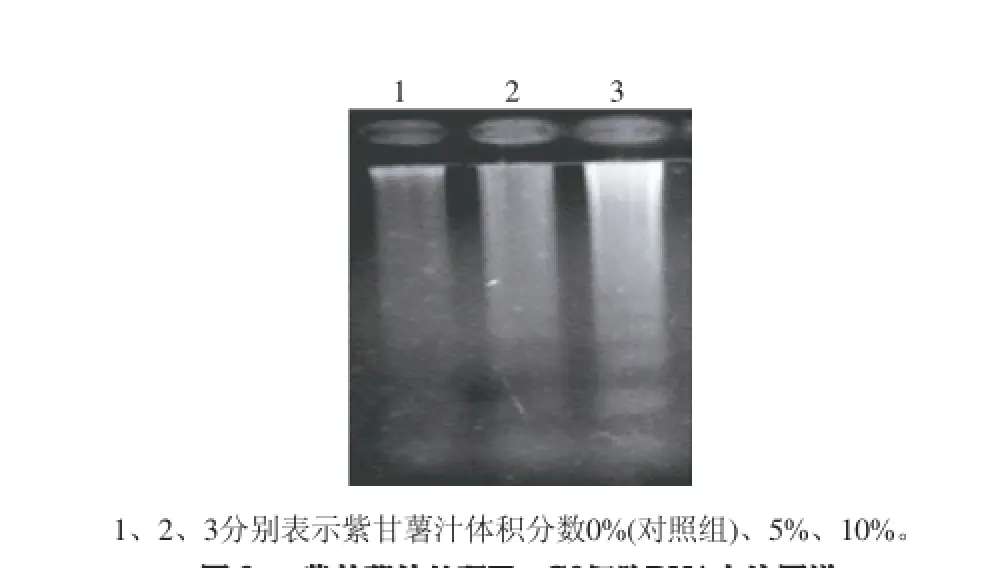
图 3 紫甘薯汁处理HepG2细胞DNA电泳图谱Fig.3 DNA electrophoresis of HepG2 cells after treatment with different concentrations of purple sweet potato juice
2.3 紫甘薯汁对HepG2细胞凋亡相关因子表达的影响
目前药物诱导肿瘤细胞凋亡研究中的最为主要凋亡相关基因有Caspase家族、Bcl-2家族、Fas/FasL、FADD、p53等。本实验以5%和10%的紫甘薯汁分别处理HepG2细胞24h和48h后,采用RT-PCR和Western blotting检测凋亡相关基因的表达情况(图4)。如图4A所示,HepG2细胞经紫甘薯汁处理24h后,Caspase-3、Caspase-8、Fas、FADD和p53的mRNA水平与对照组相比表达量上调,而内参GAPDH表达量不变化。Western blotting检测结果显示,紫甘薯汁处理HepG2细胞48h后Fas、FADD和p53蛋白水平表达上调。另外随着剂量的增加Caspase-3、Caspase-8和Caspase-9酶原降解增多,而活性形式的Caspase-3、Caspase-8和Caspase-9条带逐渐增亮,呈明显的剂量依赖效应(图4B)。
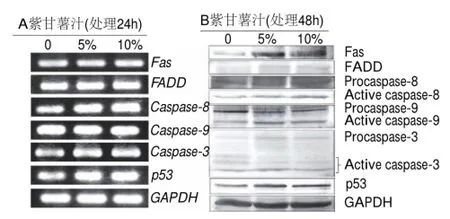
图 4 紫甘薯汁对HepG2细胞中凋亡相关因子基因水平(A)和蛋白水平(B)表达的影响Fig.4 Effect of purple sweet potato juice on the mRNA (A) and protein (B) expression of apoptosis-related factors in HepG2 cells
2.4 紫甘薯汁对HepG2细胞中Caspase-3酶活性的影响诱导细胞凋亡的关键核心步骤是Caspase-3酶原的剪切及酶活力的大小。本实验采用分光光度计法检测紫甘薯汁对Caspase-3酶活力的影响。结果如图5所示,与对照组相比,紫甘薯汁可显著提高Caspase-3酶活力并呈现出剂量依赖性(P<0.05,P<0.01)。

图 5 紫甘薯汁对HepG2细胞中Caspase-3酶活力的影响.Fig.5 Effect of purple sweet potato juice on caspase-3 activity in HepG2 cells
3 讨 论
近年来多种研究表明,花青素是紫甘薯中有效的抗肿瘤成分。一些研究者研究显示,用200μg/mL的花青素处理细胞48h后对肺癌NCI-H460细胞、卵巢癌SKOV3细胞和前列腺癌LNCaP细胞增殖抑制率分别为41.7%、73.78%和72.1%[14-16];曹东旭等[8]研究显示紫甘薯花色苷在低质量浓度时对HepG2细胞的增殖具有一定的促进作用,而在800μg/mL处理48h后抑制率为61%。本实验结果显示紫甘薯汁体积分数为10%(100μL/mL)时对HepG2细胞的抑制率为81.58%远高于以上研究结果,这说明紫甘薯汁中除花色苷外,还存在其他物质在抗肿瘤效果上存在一定的交互作用。
细胞凋亡近年来成为治疗肿瘤研究的热点,而调节细胞凋亡的复杂的信号网络逐渐被人们所了解。在细胞凋亡过程中Caspase家族成员起着核心的作用,而它们的活化受到细胞表面死亡受体途径(胞外途径)和线粒体途径(胞内途径)的调控[17]。池余刚等[15]认为原花青素可能通过降低Survivin的表达, 在体外抑制SKOV3细胞增殖, 并促进其凋亡;鲍永华等[18]研究发现原花青素可以诱导SMMC-7721 细胞发生凋亡,并降低细胞端粒酶活性;秦睿[19]研究发现原花青素可以调节线粒体膜电位及活化Caspase-9、Caspase-3通过线粒体途径诱导HepG2细胞凋亡的。在本研究中倒置显微镜、荧光显微镜、扫描电镜和DNA琼脂糖凝胶电泳结果显示紫甘薯汁能够诱导HepG2细胞凋亡。另外Western blotting结果显示紫甘薯汁能够活化Caspase-3、Caspase-8和Caspase-9并能显著提高Caspase-3酶活性。同时紫甘薯汁能够提高细胞表面死亡受体途径上游因子Fas和FADD的表达。因此推测紫甘薯汁诱导人肝癌细胞HepG2凋亡由细胞表面死亡受体途径所介导。
p53是细胞的gatekeeper[20]。它的重要功能就是应对细胞应急和通过调节线粒体膜通透性和细胞表面受体蛋白的表达诱导细胞凋亡[21]。近年来,许多研究者发现p53可以增强细胞表面死亡受体的表达[22]。活化的p53可以直接或间接的调节Bcl-2家族成员的表达从而调节线粒体膜的通透性[23]。本实验中,RT-PCR和Western blotting检测结果显示紫甘薯汁处理HepG2细胞后能够从mRNA和蛋白水平提高p53的表达。因此推测p53在紫甘薯汁诱导人肝癌细胞HepG2凋亡中可能通过上调Fas起作用。
综上所述,p53、Caspase、Fas和FADD参与了紫甘薯汁诱导的HepG2细胞的凋亡,推测紫甘薯汁是通过细胞表面死亡受体途径诱导HepG2细胞凋亡的,从而提示紫甘薯汁在肝癌的治疗中起着潜在的价值,也为人们通过合理膳食有效地预防肿瘤及粮食的深加工开发和合理应用提供科学依据。
[1] BOVELL-BENJAMIN A C. Sweet potato: a review of its past, present, and future role in human nutrition[J]. Adv Food Nutr Res, 2007, 52: 1-59.
[2] 余燕影, 王杉, 曹树稳, 等. 川山紫薯色素提取分离及主要组成成分分析[J]. 食品科学, 2004, 25(11): 167-170.
[3] PADDA M S, PICHA D H. Effect of low temperature storage on phenolic composition and antioxidant activity of sweetpotatoes[J]. Postharvest Biology and Technology, 2008, 47(2): 176-180.
[4] KONCZAK-ISLAM I, OKUNO S, YOSHIMOTO M, et al. Composition of phenolics and anthocyanins in a sweet potato cell suspension culture[J]. Biochemical Engineering Journal, 2003, 14(3):155-161.
[5] 丁利庆, 杜琪珍. 紫薯中两种功能性成分的分离鉴定[J]. 食品科学, 2011, 32(1): 74-77.
[6] 高秋萍, 阮红. 紫心甘薯多糖提取工艺研究[J]. 食品科学, 2009, 30(20): 113-117.
[7] KANO M, TAKAYANAGI T, HARADA K, et al. Antioxidative activity of anthocyanins from purple sweet potato, Ipomoera batatas cultivar Ayamurasaki[J]. Biosci Biotechnol Biochem, 2005, 69(5): 979-988.
[8] 曹东旭, 董海叶, 李妍, 等. 紫甘薯花色苷对人肝癌细胞HepG2的作用[J]. 天津科技大学学报, 2011, 26(2): 9-12.
[9] 高秋萍, 阮红, 刘森泉, 等. 紫心甘薯多糖对糖尿病大鼠血糖血脂的调节作用[J]. 中草药, 2010, 41(8): 1345-1348.
[10] ZHANG Zifeng, LU Jun, ZHENG Yuanlin, et al. Purple sweet potato color protects mouse liver against d-galactose-induced apoptosis via inhibiting caspase-3 activation and enhancing PI3K/Akt pathway[J]. Food Chem Toxicol, 2010, 48(8/9): 2500-2507.
[11] RAY R B, RAYCHOUDHURI A, STEELE R, et al. Bitter melon (Momordica charantia) extract inhibits breast cancer cell proliferation by modulating cell cycle regulatory genes and promotes apoptosis[J]. Cancer Res, 2010, 70(5): 1925-1931.
[12] 陈永强, 陈先晖, 孙勇, 等. 20 种多孔类真菌乙醇提取物体外抗氧化和抗肿瘤活性的比较研究[J]. 食品科学, 2011, 32(5): 27-31.
[13] HERRMANN M, LORENZ H M, VOLL R, et al. A rapid and simple method for the isolation of apoptotic DNA fragments[J]. Nucleic Acids Res, 1994, 22: 5506-5507.
[14] 高爱霞, 罗巨东, 吴庆婷, 等. 花青素对肺癌细胞NCI-H460 的体内外抗肿瘤效应[J]. 实验动物与比较医学, 2008, 28(2): 85-89.
[15] 池余刚, 钟玲, 伍霞, 等. 原花青素对卵巢癌SKOV3细胞增殖和凋亡的影响[J]. 第三军医大学学报, 2008, 30(23): 2203-2206.
[16] 吴自勍, 黄浩, 丁雪梅, 等. 原花青素对前列腺癌LNCaP 细胞增殖和凋亡的影响[J]. 南方医科大学学报, 2007, 27(4): 499-504.
[17] BOATRIGHT K M, SALVESEN G S. Mechanisms of caspase activation[J]. Curr Opin Cell Biol, 2003, 15: 725-731.
[18] 鲍永华, 郭永臣. 原花青素对SMMC-7721 肿瘤细胞凋亡及其端粒酶活性的影响[J]. 西北农林科技大学学报, 2007, 3v5(1): 37-40.
[19] 秦睿. 原花青素通过线粒体途径诱导人肝癌细胞HepG2凋亡及分子机制的研究[D]. 哈尔滨: 哈尔滨商业大学, 2010.
[20] LEVINE A J. p53, the cellular gatekeeper for growth and division[J]. Cell, 1997, 88: 323-331.
[21] HOFSETH L J, HUSSAIN S P, HARRIS C C. p53: 25 years after its discovery[J]. Trends Pharmacol Sci, 2004, 25: 177-181.
[22] VOUSDEN K H, LU X. Live or let die: the cell’s response to p53[J]. Nat Rev Cancer, 2002, 2: 594-604.
[23] OWEN-SCHAUB L B, ZHANG W, CUSACK J C, et al. Wild-type human p53 and a temperature-sensitive mutant induce Fas/APO-1 expression[J]. Mol Cell Biol, 1995, 15: 3032-3040.
Anti-Tumor Activity of Purple Sweet Potato Juice and Its Apoptosis-Inducing Mechanism in HepG2 Cells
CHEN Yong-qiang,LIU Jin-juan,CAO Cheng-liang,BIAN Guang-kai,JIANG Ji-hong*
(Key Laboratory of Biotechnology for Medicinal Plants of Jiangsu Province, Xuzhou Normal University, Xuzhou 221116, China)
This study was undertaken to explore the anti-tumor activity of purple sweet potato juice and its apoptosisinducing mechanism in HepG2 cells. The inhibitory effect of purple sweet potato juice at various concentrations on cell proliferation was examined by Alamar Blue assay. Cell apoptosis was determined by Hoechst 33258 fl uorescence staining, scanning electron microscopy (SEM) and agarose gel electrophoresis. Reverse transcriptase-polymerase chain reaction (RTPCR) and Western blotting analysis were used to detect the expression of apoptosis-related factors in HepG2 cells treated with purple sweet potato juice at different concentrations for 24 h and 48 h, respectively. The results showed that the cell proliferation was inhibited by purple sweet potato juice in a dose-dependent manner. Cell shrinkage and apoptotic bodies after treatment for 48 h in HepG2 cells were observed. Typical DNA ladders in apoptotic cells were also observed. In addition, purple sweet potato juice up-regulated Fas, FADD, Caspase-3, -8 and p53 mRNA and protein expression levels. Moreover, active fragments of Caspase-3, -8 and -9 showed a signif i cant increase, especially Caspase-3. Therefore, purple sweet potato juice can inhibit the proliferation of cancer cells and induce the apoptosis of HepG2 cells through extrinsic apoptotic pathway and p53 may also play an important role in this pathway.
purple sweet potato;HepG2;anti-tumor activity;apoptosis
R285.5; R151.4
A
1002-6630(2013)01-0263-05
2011-10-30
国家自然科学基金项目(30872028;31000005);江苏省高校自然科学基金项目(11KJB310011);
江苏高校优势学科建设工程项目;江苏高校优秀科技创新团队资助项目
陈永强(1986ü),男,硕士研究生,研究方向为生物化学与分子生物学。E-mail:chenyongqiang_163@163.com
*通信作者:蒋继宏(1962ü),男,教授,博士,研究方向为资源微生物及生物技术。E-mail:jhjiang@xznu.edu.cn
