一株乳酸乳球菌所产细菌素的生物学特性
2013-03-07唐春梅陈俊亮任广跃
唐春梅,陈俊亮,任广跃
(1.河北北方学院动物科技学院,河北 张家口 075000;2.河南科技大学食品与生物工程学院,河南 洛阳 471003)
一株乳酸乳球菌所产细菌素的生物学特性
唐春梅1,陈俊亮2,任广跃2
(1.河北北方学院动物科技学院,河北 张家口 075000;2.河南科技大学食品与生物工程学院,河南 洛阳 471003)
对乳酸乳球菌KLDS4.0326所产类细菌素进行分离纯化,并对细菌素的部分生物学特性进行研究。在排除酸性产物和过氧化氢的干扰后,菌株的无细胞发酵上清液对金黄色葡萄球菌和枯草芽孢杆菌等革兰氏阳性细菌以及大肠杆菌、沙门氏菌等革兰氏阴性细菌具有显著的抑制作用;经胰蛋白酶、胃蛋白酶、木瓜蛋白酶和蛋白酶K处理后,抑菌活性降低,表明抑菌成分为蛋白类物质;该细菌素具有良好的热稳定性,在酸性条件下抑菌活性稳定,并且具有较广的抑菌谱,能够抑制多种革兰氏阳性细菌和革兰氏阴性细菌。
乳酸乳球菌;细菌素;生物学特性
乳酸菌能够产生多种抗菌物质,如有机酸、双乙酰、丁酮、过氧化氢、抗真菌肽以及细菌素[1]。细菌素是某些细菌在代谢过程中通过核糖体合成机制产生的一类具有生物活性的蛋白质、多肽,这些蛋白复合物能够杀死或抑制与其有相同或相似生活环境的其他微生物[2]。虽然许多革兰氏阳性细菌和革兰氏阴性细菌也能够产生细菌素,但是由于乳酸菌细菌素可作为天然防腐剂,能抑制食品中腐败微生物和致病微生物的生长,所以其在食品产业具有的潜在应用价值备受关注。研究[3-4]表明,某些乳酸菌能有效抑制食源性致病菌中的革兰氏阳性细菌,如芽孢杆菌属、李斯特菌属、葡萄球菌属以及肉毒梭状芽胞杆菌属。此外,一些细菌素也能够有效抑制某些革兰氏阴性细菌[5-6]。由于乳酸菌细菌素能够有效抑制食源性致病菌,以及消费者对更多天然防腐剂的需求,其在食品领域将具有更广泛的应用前景[7-8]。
本实验首先对乳酸乳球菌KLDS4.0326产生的细菌素进行分离纯化,然后对细菌素的生物学特性如细菌素的抑菌谱,对表面活性剂、蛋白酶、pH值和温度的敏感性等进行研究,对于寻找新型乳酸菌细菌素具有一定的意义,并为将来开发新的细菌素天然防腐剂提供参考。
1 材料与方法
1.1 菌株、培养基与试剂
1.1.1 细菌素产生菌株
乳酸乳球菌KLDS4.0326来源于内蒙古传统乳制品酸马奶,分离鉴定后,冻存于乳品科学教育部重点实验室工业微生物菌种保藏中心(KLDS-DICC)。
1.1.2 指示菌菌株
金黄色葡萄球菌(S t a p h y l o c o c c u s a u re u s) ATCC25923、单核细胞增生李斯特氏菌(Listeria monocytogenes)NICPBP54002和沙门氏菌(Salmonella)ATCCl4028由中国药品生物制品检定所提供;大肠杆菌(Escherichia coli)ATCC25922由黑龙江省微生物研究所提供;其他标准菌株由KLDS-DICC提供。
1.1.3 培养基
乳酸乳球菌和肠球菌选择M17培养基 青岛海博生物技术有限公司;乳杆菌选择改良MRS培养基、单核细胞增生李斯特氏菌选择TSA-YE培养基、其他指示菌用营养肉汤及营养琼脂培养基 北京奥博星生物技术有限责任公司。
1.1.4 试剂
胃蛋白酶、胰蛋白酶、木瓜蛋白酶、过氧化氢酶美国Sigma公司;蛋白酶K 日本TaKaRa公司;HCl、NaOH、(NH4)2SO4均为国产分析纯试剂。
1.2 仪器与设备
SPX-150B生化培养箱 上海智城分析仪器制造有限公司;瑞士比欧KLF2000 3.7L发酵罐 瑞士比欧生物工程公司;Delta320pH计 瑞士梅特勒-托利多有限公司;ALPHA 1-4型冻干机 德国Marin Christ公司。
1.3 方法
1.3.1 制备无细胞发酵上清液
将冻干保存的乳酸乳球菌KLDS4.0326,接种于脱脂乳培养基中,置于30℃培养16h,再以1%的接种量接种于改良MRS培养基中,30℃培养至稳定期,在4℃、10000hg离心15min,收集上清液,调pH值至6.5,用0.22μm滤膜过滤上清液,保存于4℃冰箱备用[9-10]。
1.3.2 制备细菌素粗提液
取1L无细胞发酵上清液,用70%饱和度的硫酸铵盐析,在4℃振荡过夜,再于4℃、10000hg离心20min,收集沉淀,溶于0.02mol/L的乙酸钠缓冲液(pH6.5),所得溶液即为细菌素粗提液。
1.3.3 排除过氧化氢的干扰
过氧化氢酶溶解在20mol/L的乙酸盐缓冲液(pH6.5)中配成母液,加入无细胞发酵上清液中使过氧化氢酶的终质量浓度为5mg/mL,30℃水浴2h后,检测过氧化氢酶处理后无细胞发酵上清液的抑菌活性,用加入等量乙酸盐缓冲液的无细胞发酵上清液作为对照。
1.3.4 抑菌活性的检测
采用牛津杯双层琼脂法[11]:在无菌平皿中倾倒入10mL 2%琼脂。制备含0.7%琼脂指示菌培养基,接种体积分数1%过夜培养的指示菌菌液,将10mL含有指示菌的软琼脂培养基倾倒在事先倒好的琼脂培养基上,将预先灭菌的牛津杯放上,在牛津杯的孔中加入100μL发酵上清液,在超净工作台上静置3h,30℃培养48h,若在牛津杯周围出现抑菌圈,用游标卡尺测量抑菌圈直径,每种指示菌株做3个平行实验。
1.3.5 细菌素抑菌谱
选取典型的革兰氏阳性细菌ü ü乳酸乳球菌、肠球菌、乳杆菌、金黄色葡萄球菌、单核细胞增生李斯特氏菌、芽孢杆菌以及革兰氏阴性细菌üü大肠杆菌、假单胞菌和沙门氏菌等为指示菌,用细菌素粗提液进行抑菌实验。
1.3.6 细菌素对pH值敏感性及不同pH值条件下的热稳定性
取3mL无细胞发酵上清液,用2.0mol/L的NaOH和HCl溶液调整pH值至2~10,分别测其抑菌活性,然后分别在60、80、100、121℃保持20min,冷却后进行抑菌实验,用25℃放置20min的处理作为对照。
1.3.7 细菌素对蛋白酶的敏感性
取3mL无细胞发酵上清液,并调节pH值为以下各种酶的最适pH值。按终质量浓度1mg/mL分别加入胃蛋白酶、胰蛋白酶、蛋白酶K、木瓜蛋白酶、中性蛋白酶和碱性蛋白酶,在30℃温育2h,然后将pH值调至6.5,进行抑菌实验,用不加蛋白酶的无细胞发酵上清液作为对照。
1.3.8 细菌素对表面活性剂的敏感性
取3mL无细胞发酵上清液,分别加入SDS、吐温-20、吐温-80、EDTA和Triton X-100,使各物质的终质量浓度达到1mg/mL,30℃温育2h,进行抑菌实验,用不加表面活性剂的无细胞发酵上清液作为对照。
1.3.9 统计分析
2 结果与分析
2.1 排除过氧化氢的干扰
无细胞发酵上清液(pH6.5)用过氧化氢酶进行处理,以未经过氧化氢酶处理的发酵上清液作为对照,以金黄色葡萄球菌ATCC25923为指示菌进行抑菌实验,发现发酵上清液经过氧化氢酶处理后,抑菌圈直径为(13.29f0.14)mm,与作为对照的发酵上清液的抑菌圈直径((13.58f0.26)mm)相比略有下降,表明发酵上清液中的过氧化氢不是主要的抑菌物质,还有其他抑菌物质对指示菌起到抑制作用。
2.2 细菌素抑菌谱
选取20株有代表性的革兰氏阳性细菌和革兰氏阴性细菌为指示菌,用细菌素粗提液进行抑菌实验,结果见图1和表1。由图1可知,发酵上清液中的过氧化氢不是主要的抑菌物质,还有其他抑菌物质对指示菌起到抑制作用,从而达到排除过氧化氢干扰的目的。由表1可知,乳酸乳球菌KLDS4.0326产生的细菌素对20株指示菌中的18株有不同程度的抑制作用,其中不仅对革兰氏阳性细菌(金黄色葡萄球菌、单核细胞增生李斯特氏菌、枯草芽孢杆菌、粪肠球菌、屎肠球菌)具有较好的抑制作用,还可以抑制革兰氏阴性细菌(荧光假单胞菌、大肠杆菌、沙门氏菌等),表明KLDS4.0326所产细菌素具有较广的抑菌谱。

图 1 无细胞发酵上清液对金黄色葡萄球菌(a)和沙门氏菌(b)的抑制效果Fig.1 Antibacterial activity of the cell-free fermentation supernatant of strain KLDS 4.0326 against Staphylococcus aureusand Salmonella

表 1 乳酸乳球菌KLDS4.0326所产细菌素的抑菌谱(x±s,n=3)Table 1 Antibacterial activity of bacteriocin produced by strain KLDS4.0326 (x±s,n=3)
2.3 细菌素对pH值敏感性及不同pH值条件下的热稳定性
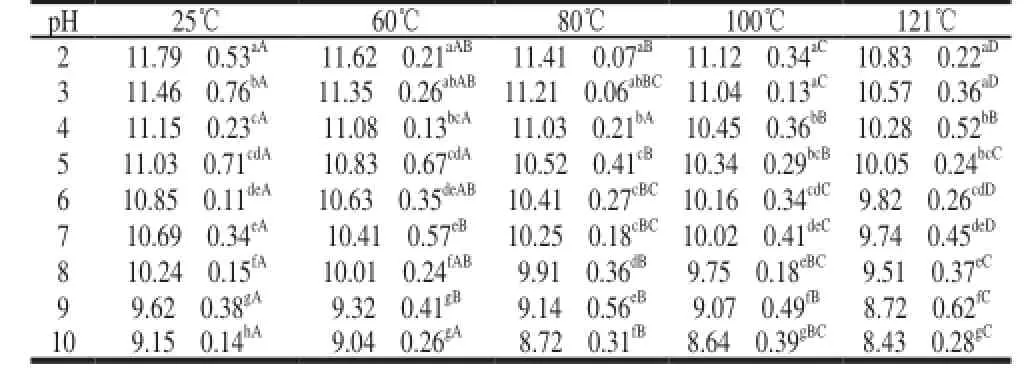
表 2 细菌素pH值敏感性以及不同pH值条件下的热稳定性Table 2 pH sensitivity and thermal stability of bacteriocin produced by strain KLDS4.0326
将无细胞发酵上清液先调至不同pH值后,测定其对金黄色葡萄球菌的抑制活性,再置于不同温度下加热15min后测其抑菌活性,结果见表2。可知,乳酸乳球菌KLDS4.0326所产细菌素在pH2~5条件下抑菌活性较强,随着pH值升高,抑菌活性逐渐下降。细菌素在酸性条件下能保持较高的抑菌活性,但是高pH值条件下抑菌活性减弱,可能是由于pH值变化导致细菌素的蛋白质结构构象发生改变[12-13]。这与许多乳酸菌所产生细菌素的特性相似,在低pH值时抑菌活性较强,在pH值偏中性时,抑菌活性减弱,此类细菌素属于酸性细菌素[14]。因此,乳酸乳球菌KLDS4.0326所产细菌素适合作为酸性食品防腐剂。无细胞发酵上清液经不同温度处理后,随着温度升高,抑菌活性逐渐下降,这是由于高温导致蛋白质或多肽失活,使得细菌素抑菌活性降低。在pH2~8范围内细菌素表现出较强的热稳定性,在pH4条件下,经121℃处理15min后,其抑菌活性下降7.8%。因此,在巴氏杀菌的条件下细菌素能保持较高的抑菌活性,使其具有在食品工业中应用的潜力。
2.4 细菌素对蛋白酶的敏感性

表 3 不同蛋白酶对细菌素抑菌活力的影响Table 3 Effect of different proteases on the antibacterial activity of bacteriocin produced by strain KLDS4.0326
由表3可知,经过胃蛋白酶、胰蛋白酶处理后抑菌活性略有下降,说明乳酸乳球菌KLDS4.0326细菌素能够对金黄色葡萄球菌和沙门氏菌产生抑制作用,此外,还可被蛋白酶K、木瓜蛋白酶、中性蛋白酶和碱性蛋白酶部分失活,使抑菌活性下降,结果表明该细菌素是一种蛋白类物质,由于可被蛋白酶降解而不会在体内残留,具有较高的安全性。
2.5 细菌素对表面活性剂的敏感性
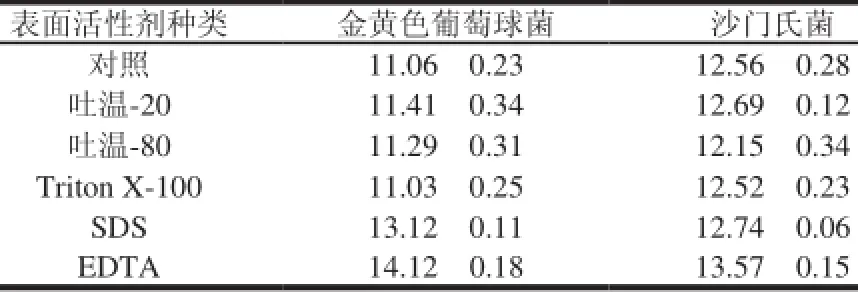
表 4 表面活性剂对细菌素抑菌活力的影响Table 4 Effect of different surfactants on the antibacterial activity of bacteriocin produced by strain KLDS4.0326
由表4可知,经吐温-20、吐温-80、Triton X-100处理后,对枯草芽孢杆菌和沙门氏菌的抑菌活性无显著变化(P>0.05);但是经SDS处理后细菌素抑菌活性增强。EDTA本身对金黄色葡萄球菌和沙门氏菌有一定的抑菌作用,因此,无细胞发酵上清液与抗菌物质同时使用比单独使用时抑菌效果好。这是因为抑菌物质对微生物的抑制作用是通过影响细胞亚结构而实现的,这些亚结构包括细胞壁、细胞膜、与代谢有关的酶、蛋白质合成系统及遗传物质[15]。因此,抑菌物质只要作用于其中的一个亚结构便能达到杀菌或抑菌的目的,当多种抑菌物质协同作用时,可产生更佳的抑菌效果。
3 结 论
乳酸乳球菌KLDS4.0326来源于内蒙古传统乳制品,其产生的细菌素对多种革兰氏阳性细菌以及革兰氏阴性细菌具有较强的抑制作用。在酸性条件下表现出良好的热稳定性;经多种蛋白酶处理后,抑菌活性降低,表明抑菌成分为蛋白类物质;经SDS和EDTA处理后,其抑菌活性显著增强。因此,乳酸乳球菌KLDS4.0326所产生的细菌素具有良好的热、酸稳定性和较广的抗菌谱,在食品保藏剂方面具有潜在的应用价值。
[1] de VUYST L, LEROY F. Bacteriocins from lactic acid bacteria: production, purification, and food applications[J]. J Mol Microbiol Biotechnol, 2007, 13: 194-199.
[2] DEEGAN L H, COTTER P C, HILL C, et a1. Bacteriocins: biological tools for biopreservation and shelf-life extension[J]. International Dairy Journal, 2006, 16(9): 1058-1071.
[3] TODOROV S D, DICKS L M T. Screening for bacteriocin-producing lactic acid bacteria from Boza, a traditional cereal beverage from Bulgaria[J]. Process Biochem, 2006, 41: 11-19.
[4] TODOROV S D, BOTES M, DANOVA S T, et al. Probiotic properties of Lactococcus lactis ssp. lactis HV219, isolated from human vaginal secretions[J]. J Appl Microbiol, 2007, 103(3): 629-639.
[5] TODOROV S D, DANOVA S T, van REENEN C A, et al. Characterization of bacteriocin HV219, produced by Lactococcus lactis subsp. lactis HV219 isolated from human vaginal secretions[J]. J Basic Microbiol, 2006, 46: 226-238.
[6] MILLETTE M, DUPONT C, ARCHAMBAULT D, et al. Partial characterization of bacteriocins produced by human Lactococcus lactis and Pediococccus acidilactici isolates[J]. J Appl Microbiol, 2007, 102(1): 274-282.
[7] CLEVELAND J, MONTVILLE T J, NES I F, et al. Bacteriocins: safe, natural antimicrobials for food preservation[J]. Int J Food Microbiol, 2001, 71: 1-20.
[8] GÁLVEZ A, ABRIOUEL H, LÓPEZ R L, et al. Bacteriocin-based strategies for food biopreservation[J]. Int J Food Microbiol, 2007, 120: 51-70.
[9] NIETO-LOZANO J C, REGUERA-USEROS J I, PELDEZMARTFNEZ M C, et a1. Effect of a bactedoein produced by Pediococcus acidilactici against Listeria monocytogenes and Clostridium perfringens on Spanish raw meat[J]. Meat Science, 2006, 72: 57-61.
[10] CABO M L, MURADO M A, GONZALEZ M P, et a1. A method for bacteriocin quantif i cation[J]. Journal of Applied Microbiology, 1999, 87(6): 907-914.
[11] POATTANACHAIKUNSOPON P, PHUMKHACHONN P. Isolation and preliminary characterization of a bacteriocin produced by Lactobacillus plantarum No.14 isolated from Nham, a traditional Thai fermented pork[J]. Journal of Food Protection, 2006, 69: 1937-1943.
[12] NETTLES C G, BAREFOOT S F. Biochemical and genetic characteristics of bacteriocins of food-associated lactic acid bacteria[J]. J Food Prot, 1993, 50(4): 338-356.
[13] DIMITRIS V, EUGENIA B, CHRISA V, et al. Survey of probiotic enterococci from traditional dairy products and their impact upon the infant intestinal microbiota[J]. The Journal of General and Applied Microbiology, 2009, 55(4): 311-315.
[14] O’SULLIVAN L, ROSS R P, HILL C. Potential of bacteriocinproducing lactic acid bacteria for improvements in food safety and quality[J]. Biochimie, 2002, 84(5/6): 593-604.
[15] LISBOA M P, BONATTO D, BIZANI D, et al. Characterization of a bacteriocin-like substance produced by Bacillus amyloliquefaciens isolated from the Brazilian Atlantic forest[J]. Int Microbiol, 2006, 9(2): 111-118.
Biological Characteristics of Bacteriocin Produced by Lactococcus lactis subsp. cremoris
TANG Chun-mei1,CHEN Jun-liang2,REN Guang-yue2
(1. College of Animal Science and Technology, Hebei North University, Zhangjiakou 075000, China;2. College of Food and Bioengineering, Henan University of Science and Technology, Luoyang 471003, China)
A bacteriocin-producing lactic acid bacteria strain was isolated from traditional dairy products in Inner Mongolia, and was identif i ed as Lactococcus. lactis subsp. cremoris KLDS 4.0326. Bacteriocin produced by KLDS 4.0326 was partially purif i ed and its characteristics were also preliminarily studied. The cell-free fermentation supernatant of strain KLDS 4.0326 with the exception of interferences from acidic products and hydrogen peroxide had potent inhibitory effects on both Grampositive bacteria (Staphylococcus aureus and Bacillus subtilis) and Gram-negative bacteria (Escherichia coli and Salmonella). After treatment with trypsin, pepsin, papain or proteinase K, its inhibitory activity decreased, indicating that the antibacterial component was protein. This bacteriocin showed good thermal stability and stable antibacterial activity under acidic conditions, and had a broad antibacterial spectrum against various species of Gram-positive bacteria and Gram-negative bacteria.
Lactococcus lactis;bacteriocin;biological characteristics
TS201.3
A
1002-6630(2013)01-0248-04
2011-09-30
唐春梅(1971ü),女,副教授,硕士,主要从事动物产品研究。E-mail:yanlei199881@163.com
