中心组合设计优化热带假丝酵母菌冷冻干燥保护剂
2013-03-07贺金梅
王 华,贺金梅,2
(1.中国农业科学院柑桔研究所,重庆 400712;2.西南大学食品科学学院,重庆 400715)
中心组合设计优化热带假丝酵母菌冷冻干燥保护剂
王 华1,贺金梅1,2
(1.中国农业科学院柑桔研究所,重庆 400712;2.西南大学食品科学学院,重庆 400715)
采用单因素试验和响应面中心组合设计,对热带假丝酵母菌真空冷冻干燥保护剂配方进行筛选和优化。通过Design-Expert软件对试验数据进行回归分析,得到保护剂最佳配方为:蔗糖14.15g/100mL、L-谷氨酸钠7.07g/100mL、聚乙二醇1.10g/100mL,菌体存活率预测值为81.46%,实际值为82.73%。
热带假丝酵母菌;保护剂;中心组合设计;响应面法
与液态微生物菌剂相比,固态微生物活菌剂,具有保藏期长、不易污染,而且在运输和贮藏、质量控制等方面有着其独特的优势[1-2],还可直接作为发酵剂、添加剂研制开发其他双歧保健食品和医药制剂等优点,因而受到越来越多的瞩目[3]。
目前,国内主要利用真空冷冻干燥技术生产固态活菌剂,但真空冷冻干燥过程中,冷冻和干燥两个过程会造成部分微生物细胞的死亡、损伤及某些酶蛋白分子的钝化[4],具体表现在以下几个方面:冷冻过程中水结冰时体积增大以及冰晶的机械作用,易破坏细胞内蛋白质活性部位一些较弱的化学键;水结冰后溶质浓度增加、pH值变化、离子强度增加、相分离;干燥过程中除去了与蛋白质、磷脂等生物大分子结合的大部分水分子,易导致蛋白质分子变性失活,细胞膜结构和功能改变。因此,为了减少冷冻和干燥过程中对细胞活性的影响,通常加入不同类型的保护剂。保护剂可以改变微生物干燥时的物理、化学环境,减轻或防止干燥或复水对细胞的损害,尽可能保持微生物原有的各种生理生化特性和生物活性[5-7],进而达到保护的目的,表1列出了常用的保护剂类型以及保护机理[8-11]。本实验以热带假丝酵母菌为发酵菌种,采用中心组合设计并结合响应面法,对热带假丝酵母菌冷冻干燥保护剂进行优化。

表 1 保护剂类型及其保护机理Table 1 Cryoprotectants and mechanisms of action
1 材料与方法
1.1 菌种与培养基
热带假丝酵母(Candida tropical)购自中国微生物菌种保藏中心。
菌种活化培养基:5e Bé麦芽汁液体培养基;菌液扩大培养基(马铃薯葡萄糖液体培养基):马铃薯300g、葡萄糖20g、蒸馏水1000mL;菌落计数培养基(PDA培养基):马铃薯300g、葡萄糖20g、琼脂20g、氯霉素0.1g、蒸馏水1000mL。
1.2 试剂与仪器
蔗糖(分析纯) 国药集团化学试剂有限公司;乳糖(分析纯) 成都市科氏化工试剂厂;聚乙二醇(分析纯)天津天泰精细化学品有限公司;L-谷氨酸钠(生化试剂)、甘油、β-环状糊精、硫酸锰、甘氨酸(均为分析纯) 成都市科氏化工试剂厂。
ZHWY-200B恒温振荡培养箱 上海智城分析仪器制造有限公司;H1850R高速冷冻离心机 湘仪离心机仪器有限公司;VFD-2000 冷冻干燥机 北京博医康实验仪器有限公司。
1.3 方法
1.3.1 工艺流程
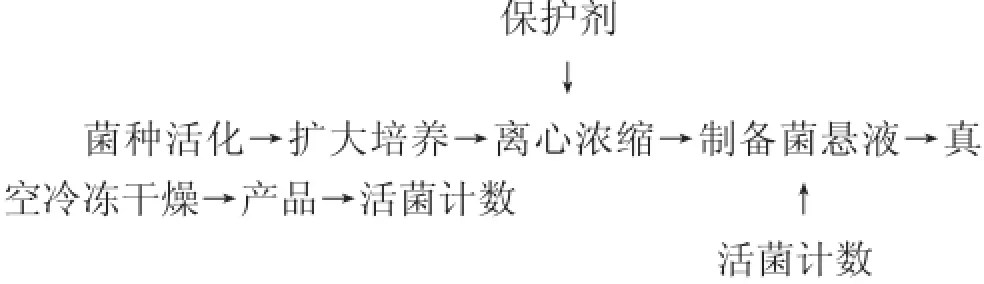
1.3.2 菌种培养和收集
菌种经过活化,然后在30℃、180r/min条件下振荡培养30h至稳定期前期,4℃、6000r/min离心20min,收集菌泥。
1.3.3 活菌计数
稀释平板菌落计数法[12],28~30℃培养48h。
1.3.4 冻干后样品的处理及菌体存活率计算
向冻干后样品中加入10mL无菌的生理盐水,于37℃培养箱中放置15min[13-14];然后采用稀释平板菌落计数法测定样品中的活菌数。
1.3.5 真空冷冻干燥工艺
在无菌条件下,用无菌水将离心收集到的菌泥稀释成活菌数为1h109CFU/mL的菌悬液;于无菌的培养皿中加入2mL菌悬液,然后按保护剂与菌泥体积比2:1的比例加入保护剂,保护剂与菌悬液平衡时间30min[15-16];冷冻干燥各参数为:预冻温度—40℃、预冻时间2h、升华温度—30℃、解析温度25℃、干燥时间24h、真空度3~10Pa[17-18]。
1.3.6 保护剂筛选
采用蔗糖、乳糖、聚乙二醇、L-谷氨酸钠、甘油、β-环状糊精、硫酸锰、甘氨酸8种保护剂,将上述几种保护剂用蒸馏水配成不同质量浓度的溶液,121℃灭菌20min后于4℃冰箱中备用。以蒸馏水作对照,测定冻干前后活菌数,计算菌体存活率。
1.3.7 中心组合设计
根据单因素试验结果,用Design-Expert软件中的中心组合设计,对热带假丝酵母冷冻干燥保护效果较好的3种保护剂蔗糖、L-谷氨酸钠、聚乙二醇进行优化,以冻干存活率为响应值,以确定热带假丝酵母冷冻干燥保护剂最佳组合。试验因素水平编码见表2。

表 2 保护剂优化试验中心组合设计因素水平编码表Table 2 Factors and their coded levels for central composite design
2 结果与分析
2.1 各种保护剂对热带假丝酵母菌冻干存活率的影响
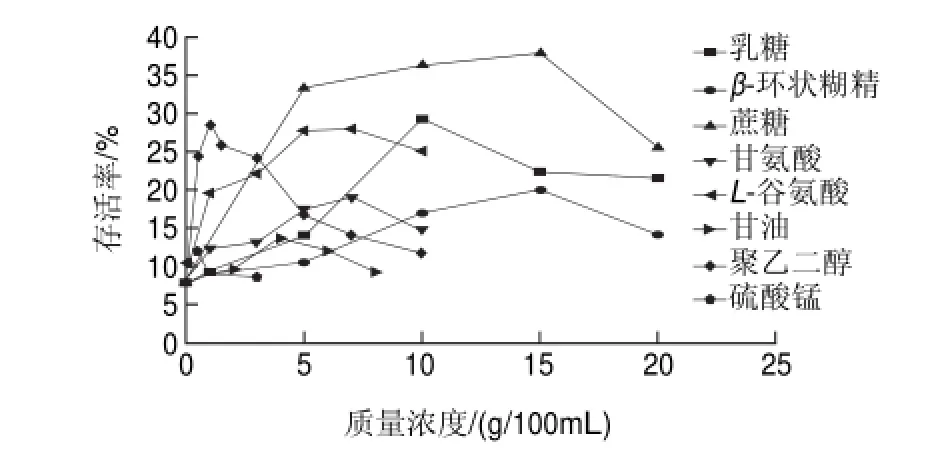
图 1 各种保护剂对热带假丝酵母菌冻干存活率的影响Fig.1 Effect of cryoprotectant type and concentration on the survival rate of Candida tropical after freeze-drying
从图1可以看出,没有添加任何保护剂的菌体冻干存活率只有8.21%,菌体存活率随着各种保护剂添加量的增加而增加;当乳糖、蔗糖、β-环状糊精、L-谷氨酸钠、甘氨酸、聚乙二醇、甘油、硫酸锰的质量浓度分别为10、15、15、7、7、1、4、0.5g/100mL时,菌体存活率最大,分别为29.19%、37.78%、19.89%、27.92%、18.96%、28.47%、13.7%、11.99%;由于高质量浓度的保护剂会加速细胞内的蛋白质聚合,形成较强玻璃化结构,反而不利于细胞的保存,且复水效果不好[19],所以,当保护剂的质量浓度超过它们的最佳质量浓度后,菌体存活率随着各种保护剂添加量的增加反而下降。
其中蔗糖、乳糖、L-谷氨酸钠、聚乙二醇对热带假丝酵母菌冻干保护的效果较好,蔗糖、乳糖、L-谷氨酸钠属于渗透型保护剂,聚乙二醇属于非渗透型保护剂[20]。蔗糖、乳糖、L-谷氨酸钠能透过细胞壁,进入细胞内,使细胞内溶质浓度升高,细胞内压力接近于细胞外压力,降低细胞外干燥或冻结引起的细胞脱水皱缩的程度和速度,从而减少了对细胞的损伤。聚乙二醇主要是保护细胞的表面免受伤害,在冻干时使溶液呈过冷状态,降低了溶液结冰的速度,避免细胞在冷冻或加热时由于盐类浓缩,使细胞脱水而导致细胞发生细胞壁和细胞膜的塌陷、渗透压性休克、蛋白质变性等不良后果[21]。另外,乳糖、蔗糖、聚乙二醇又是亲水性保护剂,它们的羟基基团可与蛋白质形成氢键,从而代替蛋白质极性基团周围的水分子,使蛋白质表面形成一层水化膜保护氢键,进而稳定蛋白质的高级结构,防止蛋白质因干燥而变性[8]。
由单因素试验研究表明,其他几种保护剂对热带假丝酵母菌的保护效果都比较差,然而,即便是最佳质量浓度的蔗糖,菌体最大冻干存活率也只有37.78%,因此,难以达到工业化生产冻干菌粉的目的。通常情况下,几种保护剂复合使用,保护效果要比单一保护剂的效果好。根据单因素试验结果,虽然乳糖的保护效果达到29.19%,但它属于还原糖,会与氨基酸发生美拉德反应,影响保护效果。因此,选用蔗糖、L-谷氨酸钠、聚乙二醇3种保护剂进行中心组合设计,以冻干存活率为响应值,以确定热带假丝酵母冷冻干燥保护剂最佳组合。
2.2 中心组合设计试验结果与分析

表 3 中心组合试验设计及结果Table 3 CCD arrangement and results
通过对蔗糖、L-谷氨酸钠、聚乙二醇3种保护剂进行中心组合设计(表2),利用Design-Expert软件对表3中的数据进行回归分析,得到二次回归方程:


表 4 二次多项模型方差分析Table 4 Analysis of variance for the fi tted regression quadratic model
二次多项式回归分析结果显示(表4),回归方程显著性检验F= 14.86>F0.01(9,10)=4.95,F失拟=3.06<F0.05(5,5)= 5.05,说明所建立的回归方程与实际情况拟合得好。通过Design-Expert软件对表3中的试验数据进行方差分析表明,X1、X3、X12、X22、X32对冻干存活率影响显著,其他各项影响不显著。
图2~4是根据多元回归分析所作的响应曲面图,由此可以对任何两因素交互影响热带假丝酵母菌菌体存活率进行分析,以确定最佳因素水平;随着蔗糖、L-谷氨酸钠、聚乙二醇质量浓度的增加,热带假丝酵母菌菌体存活率也随之提高,但各保护剂质量浓度增加到一定值后,菌体存活率反而开始下降。
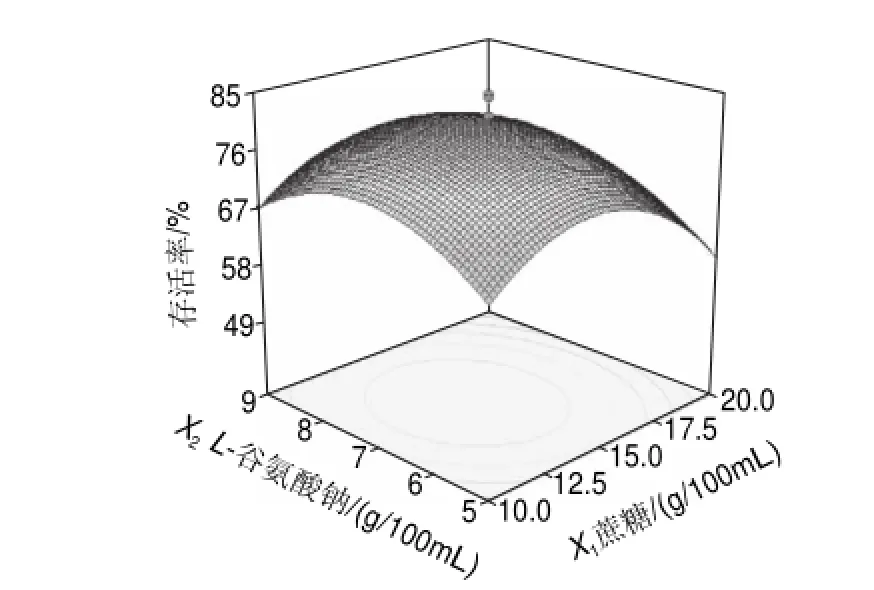
图 2 蔗糖和L-谷氨酸钠对热带假丝酵母菌菌体存活率交互影响的三维曲面图Fig.2 Response surface plot for the effect of sucrose and L-sodium glutamate on survival rate of cells
通过Design-Expert软件的数据优化程序求得当蔗糖、L-谷氨酸钠、聚乙二醇的质量浓度分别为14.15、7.07、1.10g/100mL时,热带假丝酵母菌菌体存活率能达到81.46%。按照保护剂的最佳配方,3次重复实验,热带假丝酵母菌菌体存活率平均值为82.73%,与预测值接近,说明所建立回归模型合理。

图 3 蔗糖和聚乙二醇对热带假丝酵母菌菌体存活率交互影响的三维曲面图Fig.3 Response surface plot for the effect of cross-interaction between sucrose and polyethylene glycol on the survival rate of Candida tropicalafter freeze-drying
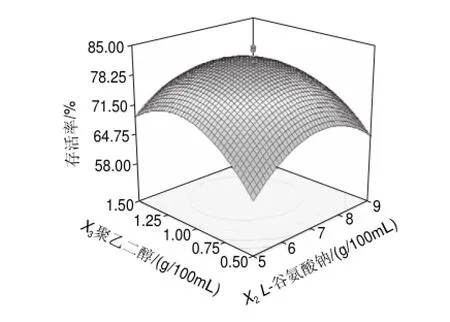
图 4L-谷氨酸钠和聚乙二醇对热带假丝酵母菌菌体存活率交互影响的三维曲面图Fig.4 Response surface plot for the effect of L-sodium glutamate and polyethylene glycol on the survival rate of Candida tropical after freeze-drying
3 结 论
研究采用单因素试验和中心组合设计以及响应面法,对热带假丝酵母菌真空冷冻干燥保护剂配方进行了筛选和优化。单因素试验结果表明,蔗糖、乳糖、L-谷氨酸钠、聚乙二醇的保护效果较好;通过响应面优化得到热带假丝酵母菌真空冷冻干燥保护剂的二次回归方程:Y=—149.69640+12.27837X1+27.85516X2+82.98039X3—0.013625X1X2—0.62050X1X3—1.04875X2X3—0.40639X12—1.87391X22—30.23713X32,保护剂最佳配方为蔗糖14.15g/100mL、L-谷氨酸钠7.07g/100mL、聚乙二醇1.10g/100mL,验证实验热带假丝酵母菌菌体存活率平均值为82.73%。
[1] NAN F U, CHEN X D. Towards a maximal cell survival in convective thermal drying process[J]. Food Research International, 2011, 44: 1127-1149.
[2] 南君勇. 真空冷冻干燥技术制备酵母菌菌粉的研究[D]. 天津: 天津大学, 2007.
[3] BAYROCK D, INGLEDEW W M. Mechanism of viability loss during fl uidized bed drying of baker’s yeast[J]. Food Research International, 1997, 30(6): 417-425.
[4] 田洪涛, 贾英民, 马雯, 等. 嗜热链球菌真空冷冻干燥前后发酵活力变化[J]. 中国乳品工业, 2001(6): 17-19.
[5] 黄科. 真空冷冻干燥乳酸菌的研究进展[J]. 西安文理学院学报: 自然科学版, 2009, 12(3): 49-52.
[6] 赵志华, 岳田利, 王燕妮, 等. 酿酒活性干酵母(AADY)的研究[J]. 中国酿造, 2006(11): 1-4.
[7] 靳志强, 李平兰. 培养基、保护剂和饥饿处里对冻干乳酸菌存活性的影响[J]. 食品科学, 2007, 28(7): 296-298.
[8] 朱永宁, 泉本腾利. 血红蛋白(Hb)的低温保护剂[J]. 吉林大学自然科学学报, 1999(3): 88-92.
[9] 朱敖兰, 杨洁. 生物制品冻干保护剂及其保护机理的研究进展[J].喀什师范学院学报, 2007, 28(6): 46-50.
[10] TIMASHEFF S N. Control of protein stability and reactions by weakly interacting cosolvents: the simplicity of the complicated[J]. Advance in Protein Chemistry, 1998, 51: 355-432.
[11] MAZZOBRE M A F, del PILAR BUERA M, CHIRIFE J. Protective role of trehalose on thermal stability of lactase in relation to its glass and crystal forming properties and effect of delaying crystallization[J]. LWT-Food Science and Technology, 1997, 30(3): 324-329.
[12] 食品安全国家标准. GB 4789.15ü2010 食品微生物学检验霉菌和酵母计数[S]. 北京: 中国标准出版社, 2010.
[13] 肖冬光, 邹海晏, 程志娟, 等. 酒精活性干酵母的活化与活细胞率的测定[J]. 酿酒科技, 1991(2): 25-27.
[14] 陈敏, 梁新乐, 励建荣. 葡萄酒活性干酵母复水活化条件的研究[J].江苏食品与发酵, 2001, 105(2): 6-9.
[15] 林云. 双歧杆菌冻干保护剂条件的研究[J]. 饲料研究, 2001(6): 4-7.
[16] 陆爱华, 王志耕, 许飞, 等. 德式保加利亚乳杆菌冻干工艺中菌悬浮液制备条件的研究[J]. 包装与食品机械, 2006, 24(4): 22-25.
[17] 陈涛. 真空冷冻干燥制备高效浓缩型两歧双歧杆菌酸奶发酵剂[D].呼和浩特: 内蒙古农业大学, 2011.
[18] 李心刚, 胡桂秋, 黄晶. 冻干工艺中预冻温度的确定[J]. 承德石油高等专科学校学报, 2005, 7(4): 19-20.
[19] 熊涛, 黄锦卿, 宋苏华, 等. 植物乳杆菌真空冷冻干燥保护剂配方优化[J]. 南昌大学学报, 2010, 34(6): 561-565.
[20] ZDENEK H. Protectants used in the cryopreservation of microorganisms[J]. Cryobiology, 2003, 46(3): 205-229.
[21] 卢行安, 陈明生, 袁杰利, 等. 乳酸菌冷冻干燥工艺的研究进展[J].中国微生态学杂志, 2001, 13(1): 58-61.
Optimization of Cryoprotectant Formulation for Candida tropical by Central Composite Design
WANG Hua1,HE Jin-mei1,2
(1. Citrus Research Institute, Chinese Academy of Agricultural Sciences, Chongqing 400712, China;2. College of Food Science, Southwest University, Chongqing 400715, China)
A cryoprotectant formulation consisting of sucrose, L-sodium glutamate and polyethylene glycol for Candida tropical was optimized using a response surface central composite design. By regression analysis of the experimental data obtained, the optimum cryoprotectant formulation was found to consist of 14.15 g/100 mL sucrose, 7.07 g/100 mL L-sodium glutamate and 1.01 g/100 mL polyethylene glycol. The predicted survival rate of Candida tropical with the addition of the optimized cryoprotectant formulation after freeze-drying was 81.46%, which was close to the actual value of 82.73%.
Candida tropical;cryoprotectant;central composite design (CCD);response surface methodology (RSM)
Q93.336
A
1002-6630(2013)01-0244-04
2012-09-06
国家现代农业(柑橘)产业技术体系建设专项(CARS-27-05B)
王华(1963ü),男,研究员,学士,研究方向为柑橘深加工及贮藏。E-mail:wanghua40@126.com
