鲤鱼肽的酶法制备工艺及其抗氧化性
2013-03-07马井喜孙永杰闵伟红
马井喜,孙永杰,冯 印,闵伟红*
(1.吉林农业大学发展学院生物食品学院,吉林 长春 130600;2.吉林农业大学食品科学与工程学院,吉林 长春 130118)
鲤鱼肽的酶法制备工艺及其抗氧化性
马井喜1,孙永杰1,冯 印1,闵伟红2,*
(1.吉林农业大学发展学院生物食品学院,吉林 长春 130600;2.吉林农业大学食品科学与工程学院,吉林 长春 130118)
以鲤鱼肉为原料,采用酶解技术制备鲤鱼抗氧化肽,研究其制备工艺和抗氧化肽的抗氧化性能。结果表明:鲤鱼抗氧化肽的制备工艺筛选条件为:碱性蛋白酶酶用量100U/mL、酶解时间5h、酶解温度50℃、pH8.5,此条件下鲤鱼肉蛋白肽的最高水解度为15.22%。采用Sephadex G-50对鲤鱼水解产物进行分离,水解产物分成分子质量小于5000D和分子质量大于5000D两个部分,采用亚油酸-硫氰酸钾法、DPPH自由基法和邻苯三酚法分别测定鲤鱼水解产物的抗亚油酸过氧化能力、DPPH自由基清除能力和超氧阴离子自由基清除能力,发现分子质量小于5000D的鲤鱼蛋白多肽是水解物中主要的抗氧化成分。
鲤鱼肉;酶解;小分子肽;抗氧化
我国淡水鱼资源丰富,鲤鱼的产量尤为突出,而且其蛋白质含量高达15%以上,氨基酸组成比例平衡,开发潜力巨大[1]。鲤鱼经碱性蛋白酶水解,可以得到小肽,由于小肽具有吸收快、营养平衡、易于利用的特点[2],可广泛应用于老年人保健食品、运动员营养食品等诸多方面[3]。本实验以鲤鱼肉蛋白为原料,进行鲤鱼肉酶解工艺参数的优化研究,在此基础上,研究鲤鱼抗氧化肽的分子质量分布变化和鲤鱼蛋白肽的抗氧化特性,探索鲤鱼深加工途径,为鲤鱼抗氧化肽的应用提供理论参考。
1材料与方法
1.1 材料与试剂
鲤鱼购于农贸市场。
碱性蛋白酶、中性蛋白酶、酸性蛋白酶、复合蛋白酶 美国Sigma公司;硫氰酸钾、冰醋酸 汕头市西陇化工厂;亚油酸 上海化学试剂公司;EDTA 汕头市光华化学厂;SDS-PAGE低分子质量标准蛋白、邻苯三酚、Folin-酚 北京鼎国生物技术有限责任公司;异丙醇、福林试剂、碳酸钠溶液、三氯乙酸、氢氧化钠、盐酸、酪素、硫酸铜均为国产分析纯。
1.2 仪器与设备
JA31001电子天平 上海精天电子仪器有限公司;DHG-9141A电热恒温干燥箱 上海精宏试验设备有限公司;1700紫外-可见分光光度计 日本岛津公司;HH-8数显恒温水浴锅 江苏省金坛市江南仪器厂;AUY220分析天平 德国Philippines公司;HZQ-C空气恒温振荡器 哈尔滨东联电子技术开发有限公司。
1.3 方法
1.3.1 鲤鱼肉蛋白的预处理
首先,新鲜的鲤鱼去头、尾、骨、内脏等杂质。取鲤鱼精肉,进行切块。切块之前微冻,再切成小块,然后进行脱脂处理[4]。具体过程:将样品与异丙醇1:1(V/V)混合,45℃条件下,恒温搅拌100min,然后进行抽滤。抽滤后将样品置于通风处挥发掉残余的异丙醇。去除异丙醇后,保存于冰箱中,作为基础原料备用。
1.3.2 鲤鱼蛋白肽的酶解工艺流程

操作要点:在组织捣碎机中匀浆10min;酶解,按不同的酶用量加入蛋白酶,在最适条件搅拌水解一定时间;将酶解液置于沸水浴中加热10min灭酶。
1.3.3 鲤鱼蛋白酶解方法以及单因素试验
称取已经脱脂处理的适量鲤鱼肉蛋白于盛有100mL蒸馏水的烧杯中混匀,经过预处理,调节到适宜温度和pH值,按照所需量加入蛋白酶进行水解,为了保持pH值不变,加入氢氧化钠溶液,并记录碱液消耗量,换算成水解度(DH)[5]。
1.3.3.1 pH值对水解反应的影响
称取已经脱脂处理的40g鱼肉(已去除水分)分别溶于pH值为1.0、2.0、3.0、4.0、5.0、6.0、7.0(酸性蛋白酶、胃蛋白酶)、5.0、6.0、7.0、8.0、9.0、10.0(碱性蛋白酶、中性蛋白酶、复合蛋白酶)的100mL水溶液中;然后按酶用量为100U/mL(均以底物计)加入酶,在50℃的水浴锅中水解4h,研究pH值对水解度的影响[6]。
1.3.3.2 酶解温度对水解反应的影响
称取已经脱脂处理的40g鱼肉分别溶于100mL水溶液中,其中酸性蛋白酶和胃蛋白酶用4mol/L的HCl调pH值为2.0;碱性蛋白酶用4mol/L的NaOH调pH值为8.0;复合蛋白酶的pH值为7.0。然后按酶用量为100U/mL加入酶,并分别在45、50、55、60、65、72℃的水浴锅中水解4h,研究温度对水解度的影响[7]。
1.3.3.3 酶解时间对水解反应的影响
称取已经脱脂处理的40g鲤鱼肉分别溶于100mL水溶液中,其他水解条件同1.3.3节,酶解时间为2、3、4、5、6、7h,研究酶解时间对水解度的影响[8]。
1.3.3.4 酶用量对水解反应的影响
称取已经脱脂处理的40g鲤鱼肉溶于100mL水溶液中,按酶用量为800、900、1000、1100、1200、1300U/mL加入酶,其他条件同1.3.3节,研究酶用量对水解度的影响[9]。
1.3.3.5 碱性蛋白酶水解鲤鱼蛋白的正交试验
参照单因素试验结果,为了确定最佳工艺参数,对各个因素进行正交优化设计。
1.3.4 SDS-聚丙烯酰胺凝胶电泳
SDS-聚丙烯酰胺凝胶电泳参考文献[10]。
1.3.5 抗氧化能力的测定方法
1.3.5.1 亚油酸过氧化反应
在5mL具塞玻璃试管加入1.5mL 0.15mol/L(pH7)的磷酸盐缓冲液,加入质量浓度20g/100mL待测鲤鱼蛋白水解物样品100μL,加入100μL 50mmol/L亚油酸的乙醇溶液和25μL 50mmol/L的FeCl2-EDTA溶液,采用漩涡分散器振荡后,盖上玻盖,于50℃暗处水浴保温,记录保温时间[11-12]。
1.3.5.2 邻苯三酚方法测定清除自由基能力
在一系列试管中加3mL 0.05mol/L的Tris-HCl缓冲液(pH8.2),分别加入质量浓度20g/100mL待测鲤鱼肽样品溶液100μL,空白组加入同体积蒸馏水,再加入100μL的0.45mol/L邻苯三酚溶液,振荡并计时,待计时至3min时立即加入100μL 3%抗坏血酸溶液,振荡,终止反应,再325nm波长处测吸光度。以抗氧化剂空白的吸光度为A0,加抗氧化剂时吸光度为AS,清除自由基能力SA(scavenging activity)可用公式(1)表示。

1.3.5.3 对DPPH自由基清除能力的测定
准确称取DPPH标准样品0.00395g,用溶剂溶解并定容至100mL,得浓度为0.1mmol/mL的母液备用。再用去离子水配制质量浓度为5.0mg/mL的鲤鱼酶解物。DPPH自由基是一种非常稳定的自由基,在有机溶剂中呈紫色,在517nm波长处有很大的吸收,当加入抗氧化剂后一部分自由基被清除,使在该波长处吸收减弱,所以借此来评价某种物质的抗氧化性。将上述所得母液稀释到各种质量浓度,取2mL各质量浓度的样品加入到2mL DPPH自由基混合摇匀,于25℃水浴加热20min左右,在517nm波长处测得样品吸光度(Ai),做2个样品(取平均值),同时以2mL样品溶液中加入2mL蒸馏水测得吸光度(Aj),除此之外,在取2mL蒸馏水代替样品加入2mL DPPH自由基溶液测得空白吸光度(A0)。同时以VC做阳性对照,按公式(2)计算DPPH自由基清除率[13-14]。

1.3.6 已知分子质量多肽标准品的凝胶层析
将已知分子质量标准品杆菌肽、血管紧缩素、亮氨酸脑啡肽和牛血清白蛋白分别配成1%的溶液,经微孔膜过滤后分别进样1mL[15-16],因为G-50凝胶的分离范围是1000~30000D,大于5000D的物质先直接从凝胶间隙出来,牛血清白蛋白的分子质量是67000D,因此其保留时间约等于分子质量为5000D物质的保留时间,其保留时间对应的分子质量为5000D左右。

表 1 标准物质的分子质量与保留时间Table 1 Molecular weights and retention times of protein markers
采用最小二乘法求出直线相应的回归方程式为:

式中:Y为分子质量对数;X为保留时间。因此,采用该回归方程可以根据某物质在凝胶柱的保留时间估算出该物质的分子质量大小。
2 结果与分析
2.1 5种蛋白酶水解鲤鱼蛋白单因素试验
2.1.1 pH值对水解反应的影响
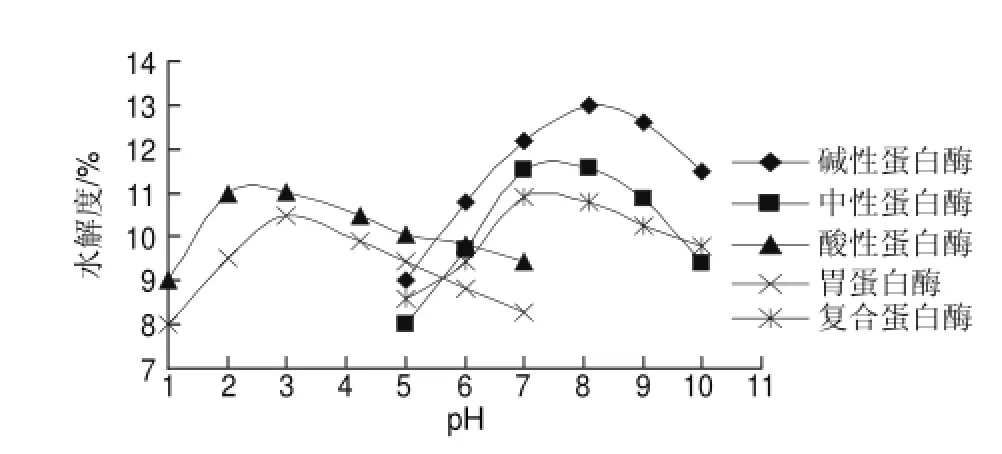
图 1 pH值对鲤鱼蛋白水解度的影响Fig.1 Effect of pH on degree of hydrolysis
由图1可知,碱性蛋白酶的水解效果最佳。在pH值小于8.0时,随pH值增大鲤鱼蛋白水解度升高;当pH8.0水解度达到最大值为12.99%,pH值继续升高水解度则降低。这是因为酶分子是一种特殊的蛋白质分子,具有若干个活性部位[2],酶的活性部位由结合位点和催化位点组成。结合部位和催化部位对反应体系的pH值变化比较敏感,其解离状态随pH值的变化而变化,这些变化影响了酶分子的特殊构象。因此pH值的变化直接影响了酶与底物的结合和催化,是酶催化反应的主要因素之一。中性蛋白酶次之,在pH7.0时水解效果最佳。酸性蛋白酶和胃蛋白酶的最适pH值为2~3,但随着pH值不断增大,水解度逐渐减小。复合蛋白酶的最适pH值为中性。
2.1.2 酶解温度对水解反应的影响
由图2可知,当温度小于60℃时,鲤鱼蛋白水解度随温度的增加而升高,当温度为60℃时,5种酶都达到了最佳的水解条件,其中碱性蛋白酶对蛋白质的水解效果最佳,水解度达到最大为13.22%,当温度继续增加时,酶对蛋白质的水解度下降,为此在本实验条件下碱性蛋白酶水解鲤鱼的最适温度为60℃。水解温度对蛋白酶的影响表明,温度较低时,温度升高加速水解反应处于主导地位;当温度较高时,酶失活处于主导地位,使水解速率加快的同时酶失活速率更快。

图 2 酶解温度对鲤鱼蛋白水解度的影响Fig.2 Effect of temperature on degree of hydrolysis
2.1.3 酶解时间对水解反应的影响

图 3 酶解时间对鲤鱼蛋白水解度的影响Fig.3 Effect of hydrolysis time on degree of hydrolysis
由图3可知,分别在5种酶最佳水解温度、pH值的条件下进行水解,碱性蛋白酶的效果最佳。即温度50℃、酶用量100U/mL、pH8时水解效果最佳。当酶解时间小于5h,随酶解时间的增加,水解度逐渐升高,而当酶解时间大于5h时,水解度增加不是很明显,为了节约时间,所以在本实验条件下碱性蛋白酶水解鲤鱼蛋白的最适酶解时间为5h,此时水解度为14.02%。另外,如果水解时间过长,就会使小分子肽水解成氨基酸,不利于能收集到更多具有较强抗氧化活性的多肽。中性蛋白酶的最适水解时间大约为5.5h;酸性蛋白酶的最佳水解时间大约为6h;胃蛋白酶的最适佳水解时间大约为5h;复合蛋白酶随着水解时间的增加,水解度不断增大,但是在7h后的变化也趋于平缓,它的最适水解时间大约为7h。
2.1.4 酶用量对水解反应的影响
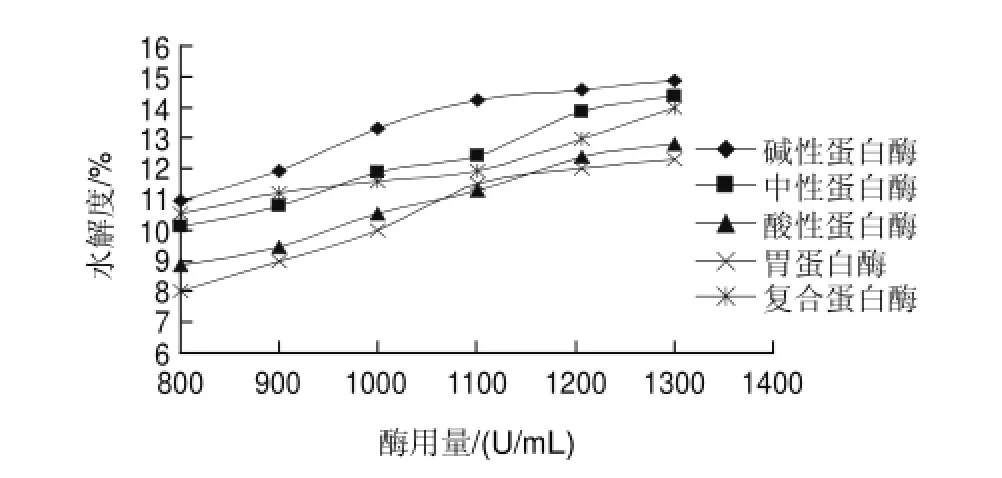
图 4 酶用量对鲤鱼蛋白水解度的影响Fig.4 Effect of enzyme dosage on degree of hydrolysis
由图4可知,分别在5种酶各自最适的温度、pH值、酶解时间的条件下进行水解,碱性蛋白酶的效果最佳,即温度50℃、酶解时间5h、pH8时水解效果最佳。当酶用量小于1100U/mL时,随酶用量的增加,水解度逐渐升高,而当酶用量大于1100U/mL时,水解度的变化幅度较小,由于酶的价格比较高,因此在本实验条件下碱性蛋白酶水解鲤鱼蛋白的最佳酶用量为1100U/mL,此时水解度为14.2%。
当水解反应温度、pH值、底物用量不变且足够大时,实验测得酶的数量越多则生成的多肽越多,水解度越大。相反,如果底物不足,酶分子过量,很多酶分子根本不能发挥作用,水解度相对降低,会造成不必要的浪费。
2.2 碱性蛋白酶水解鲤鱼蛋白正交试验
分别用碱性蛋白酶、中性蛋白酶、酸性蛋白酶、木瓜蛋白酶和复合蛋白酶酶解鲤鱼肉,通过单因素试验测定水解度,通过对5种实验用酶分别在不同实验条件下水解鱼肉蛋白进行对比分析。结果表明碱性蛋白酶的水解效果最好,中性蛋白酶次之。所以选用碱性蛋白酶作为实验用酶。正交试验的设计方案及结果见表2。由表2可知,利用极差分析法可得出各个因素对碱性蛋白酶对鲤鱼蛋白的水解效果的影响顺序为:B>A>D>C,即pH值>酶解温度>酶用量>酶解时间。酶解条件最佳反应组合为A3B3C2D1,即碱性蛋白酶最佳酶解工艺条件为酶解温度55℃、pH8.5、酶解时间4h、酶用量900U/mL,此时水解度为15.22%。

表 2 各个因素对水解度正交试验结果分析Table 2Factors and levels for orthogonal array design
2.3 Sephadex G-50测定鲤鱼蛋白肽混合物分子质量分布图5是鲤鱼蛋白经酶水解后,水解产物经过Sephadex G-50型凝胶柱层析所得到的洗脱图,从图中可看到多肽分子从大到小是连续分布的,即水解物存在着各种大小不等的肽分子。水解物中多肽主要分布在14~26管(鲤鱼蛋白肽A)、50~65管(鲤鱼蛋白肽B),这两处波峰处总面积占2/5左右。根据样品在凝胶柱的保留时间带代入回归方程,得出鲤鱼蛋白肽A的分子质量大约为10000D,鲤鱼蛋白肽B的分子质量大约为5000D。从总体上看该酶水解的产物比较分散,集中性差,鲤鱼蛋白的水解非常不均匀,水解物各成分分子质量相差很大。
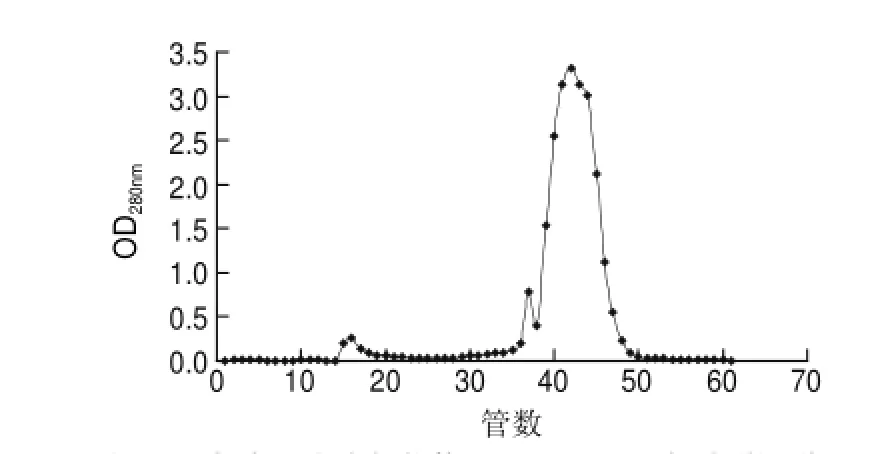
图 5 鲤鱼蛋白水解物的Sephadex G-50柱洗脱图谱Fig.5 Elution prof i le on Sephadex G-50 column of carp protein peptides
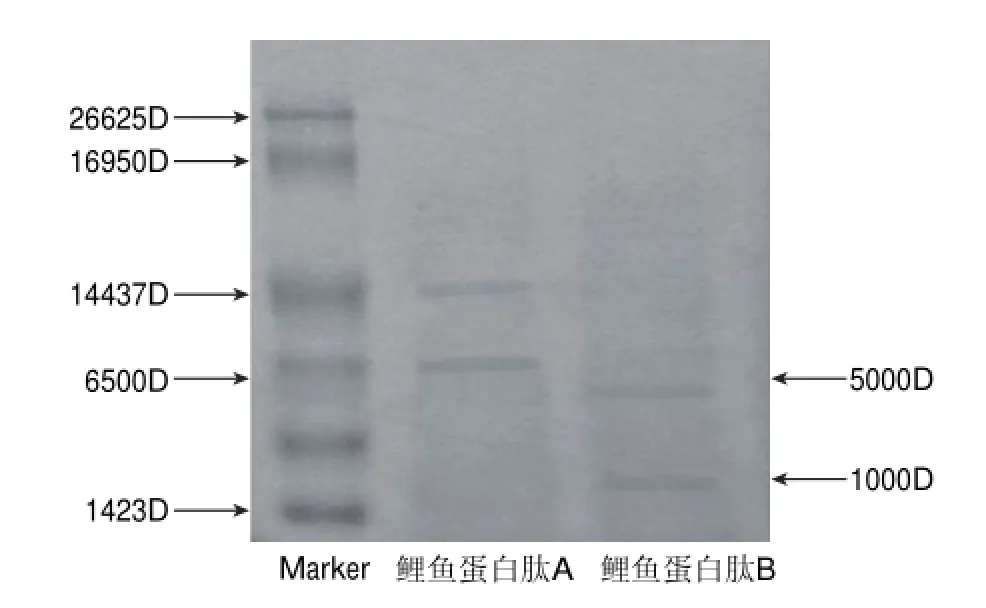
图 6 鲤鱼蛋白及其水解产物的SDS-PAGE图谱以及分子质量Fig.6 SDS-PAGE analysis of carp protein and hydrolysis products
图6显示的是鲤鱼蛋白采用碱性蛋白酶的水解物,对比图中标准物质的电泳带可以看出,鲤鱼蛋白肽A的分子质量分布在6500~15000D,鲤鱼蛋白肽B的分子质量分布在1000~5000D。
2.4 鲤鱼蛋白肽的抗氧化能力
2.4.1 抗亚油酸过氧化能力
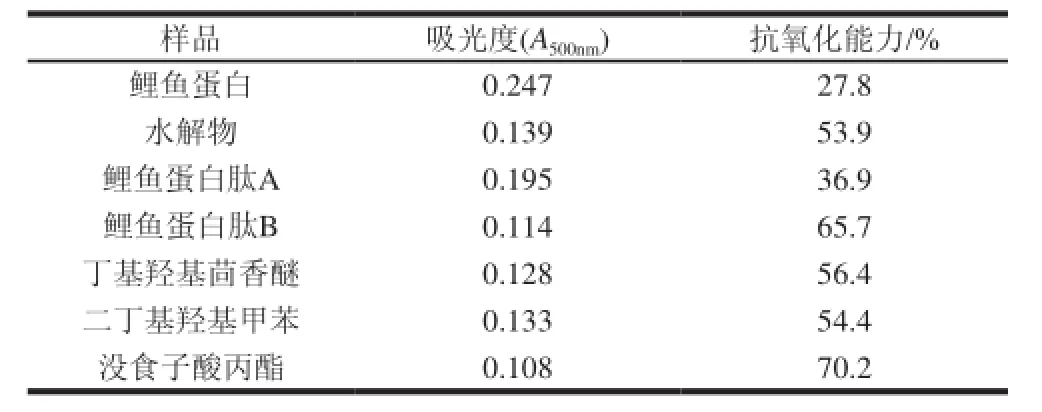
表 3 水解物各组分的抗氧化能力Table 3 Antioxidative activity of different fractions of hydrolysate determined by linoleic acid-potassium thiocyanate method
由表3可知,在浓度相同时,鲤鱼蛋白、鲤鱼蛋白水解产物及其分离组分鲤鱼蛋白肽A、鲤鱼蛋白肽B均具有明显的防止亚油酸过氧化能力。抗亚油酸过氧化能力从低到高的顺序依次是鲤鱼蛋白、鲤鱼蛋白肽A、水解物、鲤鱼蛋白肽B,说明分子质量1000~5000D的鲤鱼蛋白肽是水解物中起主要抗氧化作用的成分。通过和丁基羟基茴香醚、二丁基羟基甲苯、没食子酸丙酯阳性对照组比较[17],可以发现20g/100mL的鲤鱼蛋白肽B的防止亚油酸过氧化能力甚至强于0.02%丁基羟基茴香醚、0.02%二丁基羟基甲苯,而略弱于没食子酸丙酯。
2.4.2 清除自由基能力

表 4 鲤鱼蛋白肽清除自由基能力Table 4 Free radical scavenging capacity of different fractions of hydrolysate
由表4可知,清除自由基能力从低到高的顺序依次是鲤鱼蛋白、鲤鱼蛋白肽A、水解物、鲤鱼蛋白肽B、VC、VE阳性对照组。从这个顺序可以看出,水解物及其两个凝胶分离组分的清除自由基能力的顺序和抗亚油酸过氧化能力结果基本保持一致,更加表明小分子鲤鱼蛋白肽在水解物中起主要抗氧化作用[18-20],尽管和VE、VC相比鲤鱼蛋白肽B的清除自由基能力稍弱,但考虑到VE、VC是一种高效的抗氧化剂,为准确测定吸光度,在本实验中VC甚至是作为邻苯三酚自氧化反应的阻止剂来使用,鲤鱼蛋白肽B的清除自由基能力还是比较令人满意的。说明分子质量1000~5000D的鲤鱼肽是水解物中起主要抗氧化作用的成分。
2.4.3 DPPH自由基清除能力

表 5 鲤鱼蛋白肽清除DPPH自由基能力Table 5 DPPH scavenging capacity of different fractions of hydrolysate
由表5可知,鲤鱼蛋白多肽对DPPH自由基的清除率明显高于鲤鱼蛋白,鲤鱼蛋白肽B清除率可达到43.6%。
3 结 论
本实验采用正交试验方法研究并确定碱性蛋白酶最佳水解工艺条件。鲤鱼肽经Sephadex G-50凝胶层析分离经酶水解的鲤鱼蛋白,水解产物分成分子质量小于5000D和分子质量大于5000D两个部分,分别测定鲤鱼水解产物的抗亚油酸过氧化能力和清除自由基能力,确定分子质量小于5000D的鲤鱼蛋白肽是水解物中主要的抗氧化成分。本实验中获得的鲤鱼蛋白肽研究结果为其应用研究提供一定的科学理论依据。例如根据鲤鱼肽的抗氧化性,可以将其作为天然的防止食品腐败变质的添加剂应用到食品中,以取代化学合成的防腐剂;也可将其作为抗衰老成分添加到化妆品中发挥养颜和延缓衰老的作用。
[1] 朱健. 几种鲤鱼肌肉的一般营养成分及蛋白质氨基酸组成的比较[J]. 广东海洋大学学报, 2000(4): 13-14.
[2] 施佳慧. 鲐鲅鱼水解产物抗疲劳作用效果研究[J]. 中国食品学报, 2010(6): 35-36.
[3] 赵玉红. 鱼肽的抗疲劳功能研究[J]. 东北农业大学学报, 2005(4): 1-2.
[4] 林伟锋. 可控酶解从海洋鱼蛋白中制备生物活性肽的研究[D]. 广州: 华南理工大学, 2003: 40-43.
[5] SJODIN B, WESTING Y H, APPLE F S. Biochemical mechanisms for oxygen free radical formation during exercise[J]. Sports Med, 2009, 10: 236-254.
[6] 李岩. pH值渐变条件下双酶协同水解猪皮制备胶原蛋白寡肽的研究[J]. 食品科学, 2003, 24(7): 23-24.
[7] 许晶. 酶水解高温豆粕制备高水解度大豆肽的研究[J]. 食品与发酵工业, 2009(4): 12-13.
[8] 赵玉红. 鲢鱼副产物蛋白酶水解时间的确定及对产物的影响[J]. 齐齐哈尔大学学报, 2001(2): 2-3.
[9] 殷金莲. 碱性蛋白酶水解制备赤豆蛋白肽的工艺研究[J]. 粮油加工, 2010(2): 24-25.
[10] 郭尧君. 蛋白质电泳实验技术[M]. 北京: 科学出版社, 2005: 111-115.
[11] 韩少华. 邻苯三酚自氧化法测定抗氧化活性的方法研究[J]. 中国酿造, 2009(2): 11-12.
[12] JE J Y, PARK P J, KIM S K. Antioxidant activity of a peptide isolated from Alaska Pollack (Theragra chalcogramma) frame protein hydrolysate[J]. Food Res Int, 2005, 38(1): 45-50.
[13] 李巍青, 刘瑞兴. 酶解蛇肉低肽营养液的研制[J]. 食品工业科技, 2005(4): 2-3.
[14] 刘志强, 王晚英, 周建红. 酶法分步水解黄鳝肉制备黄鳝低肽研究[J]. 湘潭师范学院学报: 自然科学版, 2004(3): 3-4.
[15] KINSELLA J E. Milk protein: physieoehemicaland funetional properties[J]. Crit Rev FoodSei Natf, 1984, 21: 187.
[16] 朱健. 几种鲤鱼肌肉的一般营养成分及蛋白质氨基酸组成的比较[J]. 集美大学学报, 2008(4): 13-14.
[17] 成静. 白蛋白多肽体外抑制亚油酸过氧化及螯合亚铁离子的方法研究[J]. 中国食品工业, 2010(9): 15-16.
[18] 盘赛昆. 鲤鱼肉酶解物清除羟自由基的研究[J]. 食品研究与开发, 2009(9): 23-24.
[19] 沈澎. 胃蛋白酶制备鲤鱼鳞胶原蛋白肽及其特性研究[J]. 吉林农业, 2011(4): 12-13.
[20] 汪建斌. 大豆蛋白酶法水解产物抗氧化特性及产品的研究与开发[D]. 北京: 中国农业大学, 2002: 27-28.
Enzymatic Preparation of Bioactive Peptides from Carp Meat and Their Antioxidant Activity
MA Jing-xi1,SUN Yong-jie1,FENG Yin1,MIN Wei-hong2,*
(1. Biology-food School, Development College, Jilin Agricultural University, Changchun 130600, China;2. College of Food Science and Engineering, Jilin Agricultural University, Changchun 130118, China)
In this study, bioactive peptides were enzymatically prepared from carp meat using alkaline protease. The optimum conditions for preparing bioactive peptides were found to be hydrolysis at 50 ℃ and pH 8.5 for 5 h with an enzyme dosage of 100 U/mL. Under these conditions, the maximum degree of hydrolysis was 15.22%. The resulting hydrolysate was separated by Sephadex G-50 column chromatography into two fractions: greater than 5000 D and smaller than 5000 D. Peptides with molecular weight smaller than 5000 D were mainly responsible for the anti-linolie acid peroxidation activity and radical scavenging activities against DPPH and superoxide anion radicals of the hydrolysate.
carp meat;enzyme;small molecular peptide;antioxidation
TS218
A
1002-6630(2013)01-0225-05
2011-10-06
吉林省教育厅科研项目
马井喜(1981ü),男,讲师,硕士,研究方向为功能性食品。E-mail:majingxi0821@163.com *通信作者:闵伟红(1971ü),女,教授,博士,研究方向为发酵工程。E-mail:minwh2000@163.com
