蛹虫草多糖的酶法修饰及其抗氧化活性
2013-03-07贾俊强桂仲争吴琼英
贾俊强,沈 健,陈 炼,桂仲争,吴琼英,张 舒
(1.江苏科技大学蚕业研究所,江苏 镇江 212018;2.中国农业科学院蚕业研究所,江苏 镇江 212018;3.江苏科技大学生物与化学工程学院,江苏 镇江 212018)
蛹虫草多糖的酶法修饰及其抗氧化活性
贾俊强1,2,沈 健3,陈 炼3,桂仲争1,2,吴琼英3,张 舒3
(1.江苏科技大学蚕业研究所,江苏 镇江 212018;2.中国农业科学院蚕业研究所,江苏 镇江 212018;3.江苏科技大学生物与化学工程学院,江苏 镇江 212018)
为了提高蛹虫草多糖的抗氧化活性,采用α-淀粉酶对蛹虫草多糖进行酶法修饰。以DPPH自由基清除率为响应值,运用响应面分析法对α-淀粉酶修饰蛹虫草多糖的工艺进行优化,研究酶修饰后蛹虫草多糖清除DPPH自由基、螯合Fe2+和还原力等抗氧化活性,并对其三螺旋体结构进行分析。结果表明:对修饰多糖抗氧化活性的影响因素从大到小依次为:加酶量、酶解温度、酶解pH值;α-淀粉酶修饰蛹虫草多糖的最优工艺条件为:酶解温度48.5℃、酶解pH 5.8、加酶量259.5U/g,在此条件下,酶修饰后蛹虫草多糖对DPPH自由基的清除率预测值为81.4%,验证值为(81.6f1.6)%,结果重现性好,可用于实际预测。抗氧化实验表明,α-淀粉酶法修饰后,蛹虫草多糖清除DPPH自由基和螯合Fe2+的EC50值分别为:0.0247、1.0120mg/mL,分别比酶法修饰前提高了55.1%和39.8%;同时,蛹虫草多糖的还原力也得到了显著提高(P<0.05)。三螺旋体结构分析表明,蛹虫草多糖经α-淀粉酶修饰后,其三螺旋体结构有轻微破坏,但仍然保持三螺旋体结构。
蛹虫草多糖;酶法修饰;工艺优化;抗氧化;三螺旋体结构
蛹虫草(Cordyceps militaris),又名北冬虫夏草,北虫草,东北虫草,属于真菌门,子囊菌亚门,核菌纲,球壳目,麦角菌科,虫草属[1],是一种珍贵药用真菌。蛹虫草多糖作为蛹虫草的有效成分之一,具有提高免疫力[2]、抗氧化[3]、抗肿瘤[4]和降血糖[5]等功效,具有很高的药用价值和保健价值。
研究发现,多糖分子质量大小是影响其生物活性的主要因素之一[6],因此,通过改变分子质量成为提高多糖生物活性的主要方法之一,如:茶多糖经β-D-半乳糖苷酶降解后,能显著提高免疫低下模型小鼠的免疫力。目前,改变多糖分子质量的方法主要为降解法,包括酸解法、酶法和超声波降解法等[7-8],其中,酶法具有专一性、高效性、酶解条件和过程易于控制、无副反应等优点,在多糖分子修饰中应用越来越广泛[8]。然而,迄今为止,利用酶法修饰蛹虫草多糖以提高其生物活性的研究鲜见报道。本研究在前期实验的基础上,选择α-淀粉酶对蛹虫草多糖进行分子修饰,优化出最优酶解工艺,并对修饰后蛹虫草多糖的抗氧化活性以及三螺旋体结构的变化进行研究,以期为蛹虫草多糖类药物的制备与开发提供参考。
1 材料与方法
1.1 材料与试剂
蛹虫草由中国农业科学院蚕业研究所提供,经60℃烘干后粉碎,过100目筛得到蛹虫草粉。
α-淀粉酶(酶活力为3700U/g) 北京索莱宝科技有限公司;1,1-二硝基-2-三硝基苯肼(DPPH) 美国Sigma公司;其余化学试剂均为分析纯。
1.2 仪器与设备
乌氏黏度计(毛细管直径0.5~0.6mm) 上海化学试剂公司;H-2050R-1冷冻离心机 湖南湘仪离心机仪器有限公司;DNG-9143BS电热恒温鼓风干燥箱 上海新苗医疗器械制造有限公司;SSY-H恒温水浴锅 上海三申医疗器械有限公司;WH-2漩涡混合仪 上海沪西分析仪器厂;FDU-2100冷冻干燥机 上海爱朗仪器有限公司;UV-2100分光光度计 上海尤尼柯仪器有限公司。
1.3 方法
1.3.1 蛹虫草多糖的提取与纯化
取100g蛹虫草粉,加入1000mL蒸馏水,80℃条件下搅拌提取4h,在3000r/min离心10min,取上清液,残渣用1000mL蒸馏水在相同条件下重复提取1次,合并上清液,减压浓缩至约300mL,缓慢加入无水乙醇至上清液中乙醇体积分数为90%,静置过夜,收集沉淀物,得到蛹虫草粗多糖。
将蛹虫草粗多糖用蒸馏水溶解后,用DEAE-52阴离子交换柱层析进行纯化,依次用0、0.1、0.2、0.3mol/L NaCl溶液各洗脱20min,收集多糖组分,将多糖组分透析48h后冷冻干燥备用。
1.3.2 酶法修饰单因素试验
1.3.2.1 酶解温度的影响
用蒸馏水将蛹虫草多糖配制成质量浓度为0.5g/100mL溶液,加酶量为240U/g,酶解pH5.0,分别在40、45、50、55、60℃条件下用α-淀粉酶酶解15min,酶解结束后,在沸水浴中灭酶10min,冷却后在3000r/min离心10min,收集上清液并冷冻干燥,得到酶法修饰后的蛹虫草多糖。
1.3.2.2 酶解pH值的影响
用蒸馏水将蛹虫草多糖配制成质量浓度为0.5g/100mL溶液,加酶量为240U/g,酶解温度为55℃,分别在酶解pH 4.0、5.0、6.0、7.0、8.0用α-淀粉酶酶解15min,酶解结束后,在沸水浴中灭酶10min,冷却后在3000r/min离心10min,收集上清液并冷冻干燥,得到酶法修饰后的蛹虫草多糖。
1.3.2.3 加酶量的影响
用蒸馏水将蛹虫草多糖配制成质量浓度为0.5g/100mL溶液,酶解pH 5.0,酶解温度为55℃,分别在加酶量为200、240、280、320、360U/g用α-淀粉酶酶解15min,酶解结束后,在沸水浴中灭酶10min,冷却后在3000r/min离心10min,收集上清液并冷冻干燥,得到酶法修饰后的蛹虫草多糖。
1.3.3 响应面法对酶法修饰工艺进行优化
在单因素试验基础上,以酶解温度、酶解pH值和加酶量为自变量,DPPH自由基清除率为响应值,进行三因素三水平响应面试验设计[9]。各因素水平及编码如表1所示,采用Design-Expert 7.1 统计软件对试验结果进行统计分析。
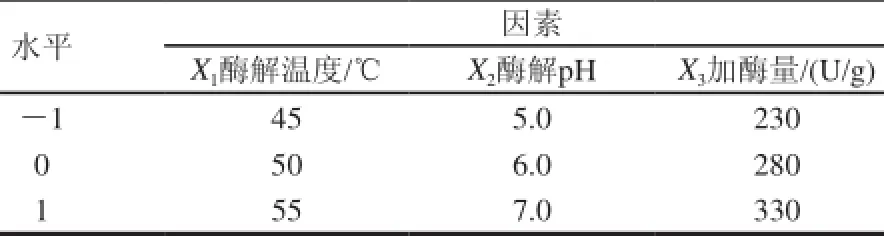
表 1 响应面试验因素水平表Table 1 Factors and levels of response surface tests
1.3.4 增比黏度的测量
根据参考文献[10],用乌氏黏度计测量多糖的增比黏度。在25℃水浴中,用秒表计算出20mL蒸馏水流经乌氏黏度计的时间,记为t0;然后在相同条件下,用秒表计算出20mL多糖溶液3.0mg/mL流经乌氏黏度计的时间,记为t,按式(1)计算多糖的增比黏度。

式中:ηsp为增比黏度;t0为蒸馏水流经乌氏黏度计的时间/s;t为多糖溶液流经乌氏黏度计的时间/s。
1.3.5 体外抗氧化活性分析
1.3.5.1 对DPPH自由基清除率的测定
取2mL(质量浓度分别为0.024、0.030、0.036、0.045、0.060mg/mL)待测样品于试管中,加入2mL 0.1mmol/L DPPH无水乙醇溶液,混合均匀,室温避光反应30min,在517nm波长处测吸光度(Ai);另取2mL待测样品于试管中,加入无水乙醇2mL,室温避光反应30min,在517nm波长处测吸光度(Aj);以2mL浓度为0.1mmol/L DPPH无水乙醇溶液和2mL无水乙醇反应做为参比,在517nm波长处测吸光度(A0)。按照式(2)计算待测样品对DPPH自由基的清除率。

式中:Sa为DPPH自由基清除率/%;A0为2mL 0.1mmol/L的DPPH无水乙醇溶液加2mL无水乙醇的吸光度;Ai为2mL 0.1mmol/L的DPPH无水乙醇溶液加2mL待测样品的吸光度;Aj为2mL无水乙醇加2mL待测样品的吸光度。
1.3.5.2 对Fe2+的螯合能力测定
取3mL(质量浓度分别为0.5、1.0、2.0、3.0、4.0mg/mL)待测样品溶液,加入0.05mL 2mmol/L FeCl2溶液,混匀后加入0.2mL 5mmol/L Ferrozine溶液,混匀,室温静置反应10min,在562nm波长处测吸光度(A1)。空白组以双蒸水代替待测样品溶液,在562nm波长处测吸光度(A0)。按照式(3)计算待测样品对Fe2+的螯合率[12]。

式中:Fa为对Fe2+的螯合率/%;A0为空白吸光度;A1为待测样品参与反应的吸光度。
1.3.5.3 还原力的测定
在2.5mL pH6.6磷酸盐缓冲液中加入待测样品溶液1mL(质量浓度分别为0.072、0.090、0.120、0.180、0.360mg/mL)和2.5mL 1g/100mL铁氰化钾溶液,混匀后50℃恒温20min,再加入2.5mL 10g/100mL三氯乙酸溶液,在3000r/min离心分离10min,取2.5mL上层清液,加入2.5mL蒸馏水和0.5mL 0.1g/100mL FeCl3溶液,在700nm波长处测定吸光度,还原力以吸光度大小表示[13]。
1.3.6 三螺旋体结构分析
蛹虫草多糖的三螺旋体结构分析采用文献[14]提出的方法, 0.2mol/L NaOH 刚果红与多糖混合液表示将5.0mg刚果红和75.0mg多糖溶于100mL 0.2mol/L NaOH溶液中;0.6mol/L NaOH 刚果红与多糖混合液表示将5.0mg刚果红和75.0mg溶于100mL 0.6mol/L NaOH溶液中;0.2mol/L NaOH 刚果红溶液表示将5.0mg刚果红溶于100mL 0.2mol/L NaOH溶液中。
2 结果与分析
2.1 酶法修饰蛹虫草多糖的单因素试验结果
2.1.1 酶解温度

图 1 酶解温度对DPPH自由基清除率的影响Fig.1Effect of hydrolysis temperature on DPPH radical scavenging rate
由图1可知,随着酶解温度的提高,蛹虫草多糖对DPPH自由基的清除率逐渐增加,在50℃时达到最大;随着酶解温度进一步提高,蛹虫草多糖对DPPH自由基的清除率逐渐下降,酶解温度各水平间存在显著性差异(P<0.05)。因此,在50℃时酶法修饰效果较好。
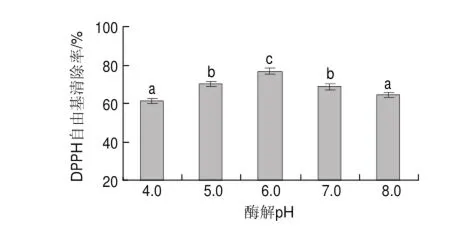
图 2 酶解pH值对DPPH自由基清除率的影响Fig.2Effect of hydrolysis pH on DPPH radical scavenging rate
2.1.2 酶解pH值由图2可知,随着酶解pH值的增加,蛹虫草多糖对
DPPH自由基的清除率逐渐增加,在pH6.0时达到最大;当酶解pH值进一步增加时,蛹虫草多糖对DPPH自由基的清除率有所降低,不同酶解pH值间存在显著性差异(P<0.05)。因此,在pH6.0时酶修饰效果较好。
2.1.3 加酶量
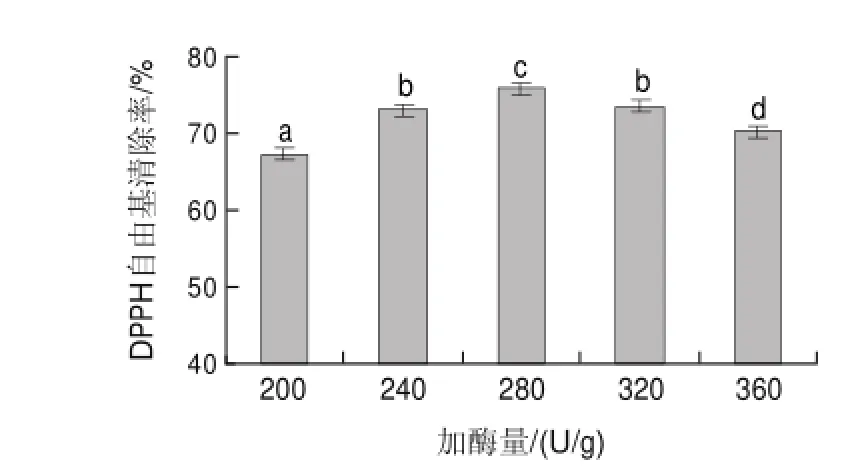
图 3 加酶量对DPPH自由基清除率的影响Fig.3Effect of enzyme dosage on DPPH radical scavenging rate
由图3可知,不同加酶量对酶修饰蛹虫草多糖的DPPH自由基清除率的影响存在显著性差异(P<0.05);随着加酶量的增加,蛹虫草多糖对DPPH自由基的清除率先增加后减小;在加酶量280U/g时,DPPH自由基清除率最大,因此,在加酶量280U/g时酶修饰效果较好。
2.2 酶法修饰蛹虫草多糖的正交试验结果
2.2.1 酶法修饰蛹虫草多糖回归方程的建立与分析
以酶解温度、酶解pH值和加酶量为自变量,以酶法修饰后蛹虫草多糖对DPPH自由基的清除率为响应值,采用Design-Expert 7.1 统计软件对试验方案进行设计,共有15次试验,试验方案与结果如表2所示。
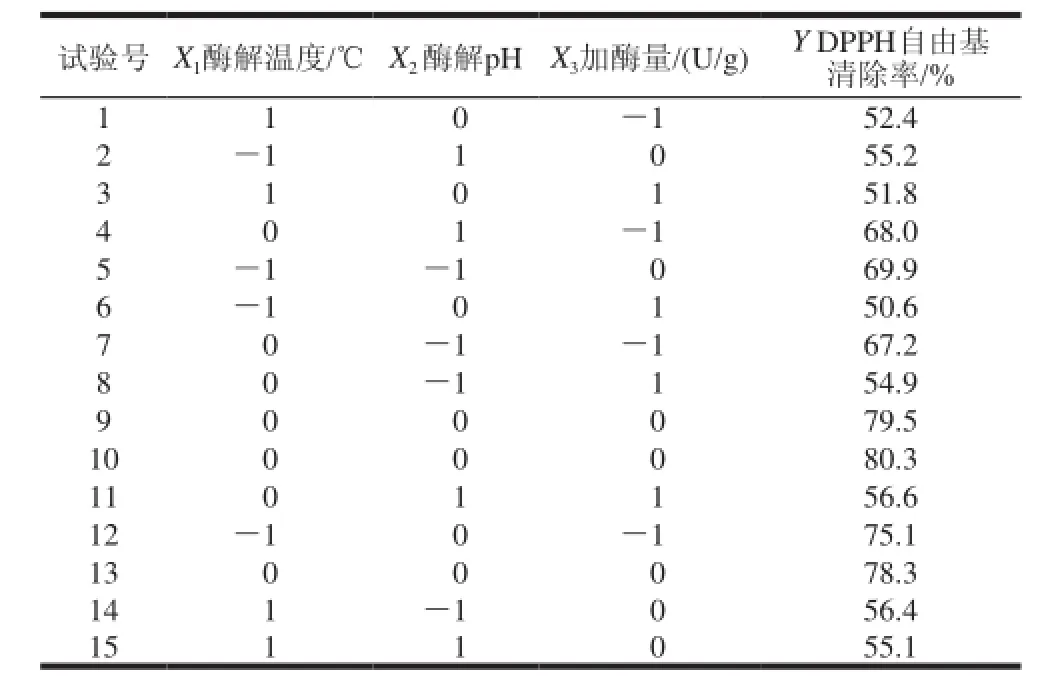
表 2 响应面分析条件及试验结果Table 2 Conditions of response surface analysis and experimental results
采用Design-Expert 7.1统计软件对表2试验数据进行二次多项回归拟合,建立了酶法修饰后蛹虫草多糖对DPPH自由基的清除率与酶解温度、酶解pH值和加酶量的3个因素的二次多项回归模型为:
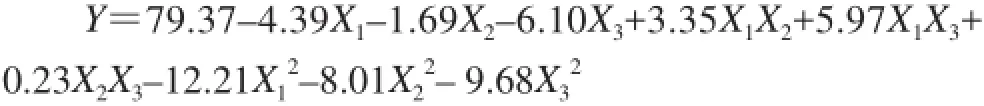
表3模型的方差分析表明,该模型的失拟项P=0.0570,差异不显著(P>0.05),响应面回归模型P=0.0029,达到极显著水平(P<0.01),且复相关系数R2为0.9690,说明回归方程的拟合度较好[15]。模型的调整确定系数为0.9132,可以较好地解释该模型的变化[15]。综上所述,该模型拟合程度良好,可用该模型分析和预测酶法修饰在不同条件下蛹虫草多糖对DPPH自由基的清除能力大小。此外,各因素对酶修饰蛹虫草多糖的DPPH自由基清除能力的影响大小依次为:加酶量>酶解温度>酶解pH值;X3、X12、X22和X32对DPPH自由基清除率(Y)影响极显著(P<0.01),X1和X1X3对DPPH自由基清除率(Y)较显著(P<0.05),X2、X1X2和X2X3对DPPH自由基清除率(Y)影响不显著(P>0.05)。
2.2.2 酶法修饰蛹虫草多糖的最优条件的确定与验证
采用Design-Expert 7.1统计软件作出酶解温度、酶解pH值和加酶量之间的响应曲面图如图4a、b、c所示。
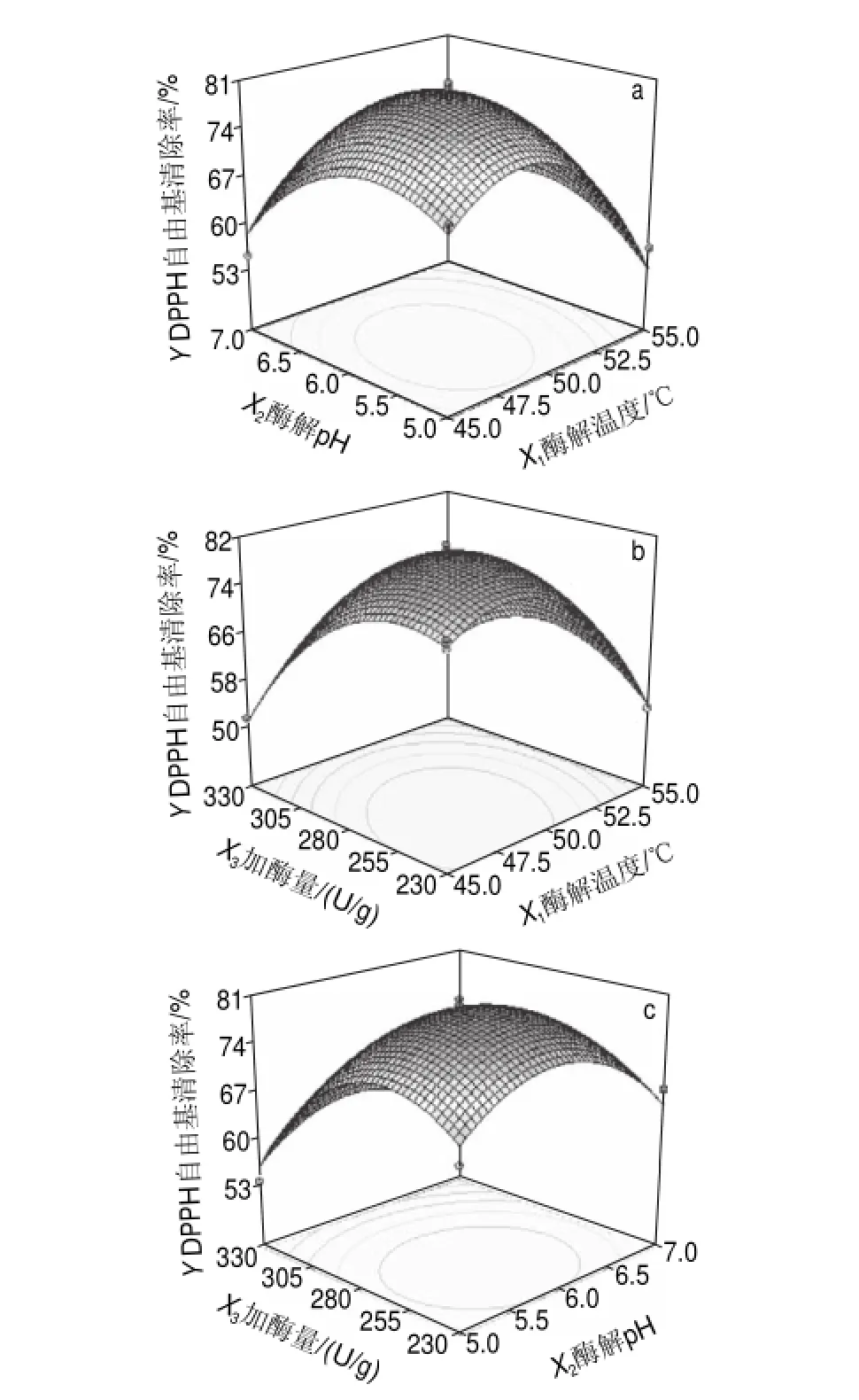
图 4 两两因素交互作用对DPPH自由基清除率影响的响应面曲面图Fig.4Response surface plots for the effect of cross-interaction among factors on DPPH scavenging rate
由图4a可知,随着酶解温度和酶解pH值的增加,酶法修饰蛹虫草多糖对DPPH自由基清除率逐渐升高,但当酶解温度和酶解pH值增加到一定值后,酶法修饰蛹虫草多糖对DPPH自由基清除率呈下降的趋势,因此,在加酶量不变的情况下,酶解温度与酶解pH值的响应曲面存在极值,在酶解温度47~50℃和酶解pH5.5~6.0范围内,酶法修饰蛹虫草多糖对DPPH自由基的清除率较大。
由图4b可知,随着酶解温度和加酶量的持续增加,酶法修饰蛹虫草多糖对DPPH自由基清除率先逐渐升高到一定值后,又呈下降的趋势。因此,在酶解pH值不变的情况下,酶解温度与加酶量的响应曲面存在极值,在酶解温度45~50℃和加酶量230~280U/g范围内,酶法修饰蛹虫草多糖对DPPH自由基的清除率较大。
由图4c可知,随着酶解pH值和加酶量的持续增加,酶法修饰蛹虫草多糖对DPPH自由基清除率先增加后减小。因此,在酶解温度不变的情况下,酶解pH值与加酶量的响应曲面也存在极值,在酶解pH5.5~6.0℃和加酶量230~280U/g范围内,酶法修饰蛹虫草多糖对DPPH自由基的清除率较大。
从上述分析可以看出,酶解温度、酶解pH值和加酶量之间的响应曲面均存在极值,因此,可以通过对二次回归的数学模型取一阶偏导获得最优试验条件,对二次回归的数学模型取一阶偏导[16],最终得到最优酶修饰条件为:酶解温度48.5℃、酶解pH 5.8、加酶量259.5U/g。在此条件下,酶法修饰蛹虫草多糖对DPPH自由基的清除率预测可达到81.4%。对以上酶法修饰条件进行验证实验,经3次平行实验,酶法修饰蛹虫草多糖对DPPH自由基的清除率分别为80.4%、81.1%、83.4%,平均值为(81.6f1.6)%。验证结果与理论预测值基本一致。表明预测值和真实值之间有很好的拟合性,进一步验证了模型的可靠性。
2.3 酶法修饰对蛹虫草多糖的增比黏度影响
增比黏度是反映多糖分子质量大小的重要指标之一。在多糖质量浓度一定的情况下,增比黏度与分子质量大小呈正相关关系,分子质量越大,增比黏度越大,分子质量越小,增比黏度越小[10]。由表4可知,酶法修饰后蛹虫草多糖的增比黏度显著降低(P<0.05),说明经过酶法修饰后蛹虫草多糖的分子质量变小。
表 4 酶修饰对蛹虫草多糖的增比黏度影响(±s,n=3)Table 4 Effect of enzymatic modif i cation on specif i c viscosity of polysaccharide extract from Cordyceps militaris(±s,n=3)
注:上标字母不同表示差异显著(P<0.05)。
测试样品未修饰多糖酶法修饰多糖ηsp0.101f0.004a0.058f0.005b
2.4 酶法修饰对蛹虫草多糖的抗氧化活性影响
2.4.1 清除DPPH自由基能力
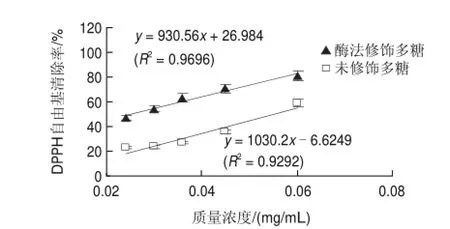
图 5 酶法修饰对蛹虫草多糖清除DPPH自由基能力的影响Fig.5 Effect of enzymatic modif i cation on DPPH radical scavenging activity of polysaccharide extract from Cordyceps militaris
由图5可知,随着多糖质量浓度的增加,酶法修饰蛹虫草多糖和未修饰蛹虫草多糖对DPPH自由基的清除率均逐渐增强,且都呈现良好的量效和线性关系(R2>0.92)。根据回归方程,计算出酶法修饰前和修饰后蛹虫草多糖对DPPH自由基的清除能力的EC50值分别为0.0550、0.0247mg/mL。酶法修饰后,蛹虫草多糖对DPPH自由基的清除能力提高了55.1%。可能的原因是:蛹虫草多糖的主链主要由(1→6)-β-D-甘露糖组成,支链主要由(1→4)-α-D-葡萄糖和(1→6)-β-D-半乳糖组成[3],当蛹虫草多糖被α-淀粉酶法修饰后,因为α-淀粉酶能够水解多糖中的α-1,4-糖苷键[17],所以蛹虫草多糖支链中的(1→4)-α-D-葡萄糖聚合物会被降解,使蛹虫草多糖中某些生物活性基团暴露出来,最终使蛹虫草多糖对DPPH自由基的清除能力增强;此外,研究发现,分子质量对多糖的生物活性有重要影响,在一定分子质量范围内,分子质量越小其生物活性越强[6]。
2.4.2 螯合Fe2+能力
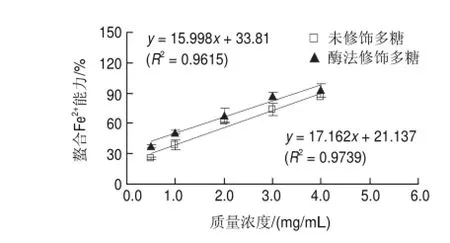
能力的影响Fig.6图 6 酶法修饰对蛹虫草多糖螯合Fe2+Effect of enzymatic modif i cation on chelating capacity for Cordyceps militaris ferrous ions of polysaccharide extract from
Fe2+可通过Fenton反应使过氧化物产生自由基,进而导致人类的一些心血管疾病,因次通过降低Fenton反应中Fe2+浓度可以有效预防氧化损伤[18]。由图6可知,酶修饰前和修饰后蛹虫草多糖的质量浓度分别与Fe2+螯合能力呈现良好的线性关系(R2>0.96),根据回归方程计算得到它们的EC50分别为1.6818、1.0120mg/mL;酶法修饰后,蛹虫草多糖Fe2+螯合能力得到显著提高,比修饰前提高了39.8%。在螯合反应中,螯合剂具有孤电子对,能与金属离子形成环状螯合物,从而达到螯合金属离子的目的[19],蛹虫草多糖被α-淀粉酶修饰后,由于其支链中的(1→4)-α-D-葡萄糖聚合物被降解,蛹虫草多糖内部能够提供孤电子对的活性基团暴露出来,能与Fe2+能够充分形成环状螯合物,因而螯合Fe2+能力增强。
2.4.3 还原力
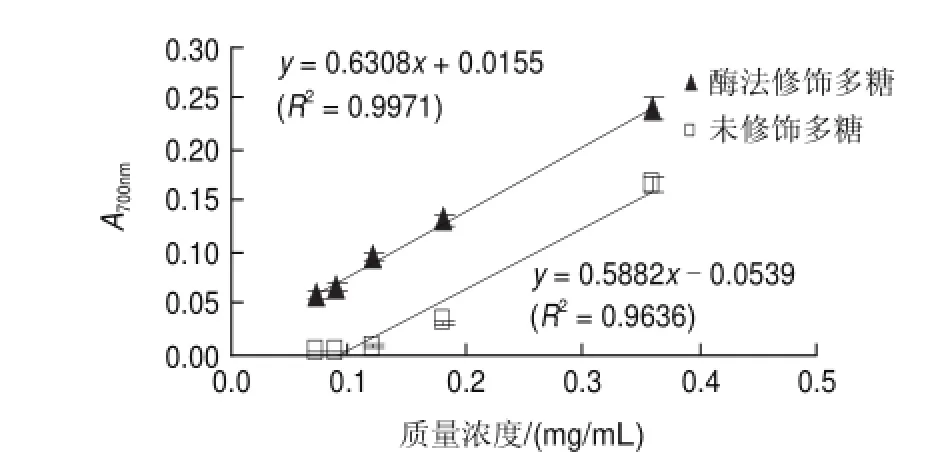
图 7 酶修饰对蛹虫草多糖还原力的影响Fig.7Effect of enzymatic modif i cation on reducing power of Cordyceps militaris polysaccharide extract from
还原力是评价物质抗氧化活性的指标之一,其抗氧化机理是具有还原力的物质能与自由基发生反应,使自由基成为较稳定的物质,以中断脂质过氧化的连锁反应[20]。由图7可知,酶法修饰前和修饰后蛹虫草多糖的质量浓度均与其还原力呈现正相关性,且具有良好的线性关系(R2>0.97);与酶法修饰前蛹虫草多糖相比,修饰后蛹虫草多糖的还原力得到显著的提高(P<0.05)。杨文鸽等[21]采用H2O2降解龙须菜多糖时发现,随着龙须菜多糖分子质量的降低,其还原能力逐渐增强,并且呈现明显的量效关系,这与本实验的研究结果一致。原因可能与蛹虫草多糖经α-淀粉酶法修饰后分子质量变小有关,小分子质量多糖一般结构松散,氢键作用弱,活性基团易暴露在外,能提供更多的电子,因而还原力也增强[21]。
2.5 酶法修饰后蛹虫草多糖的三螺旋体结构分析
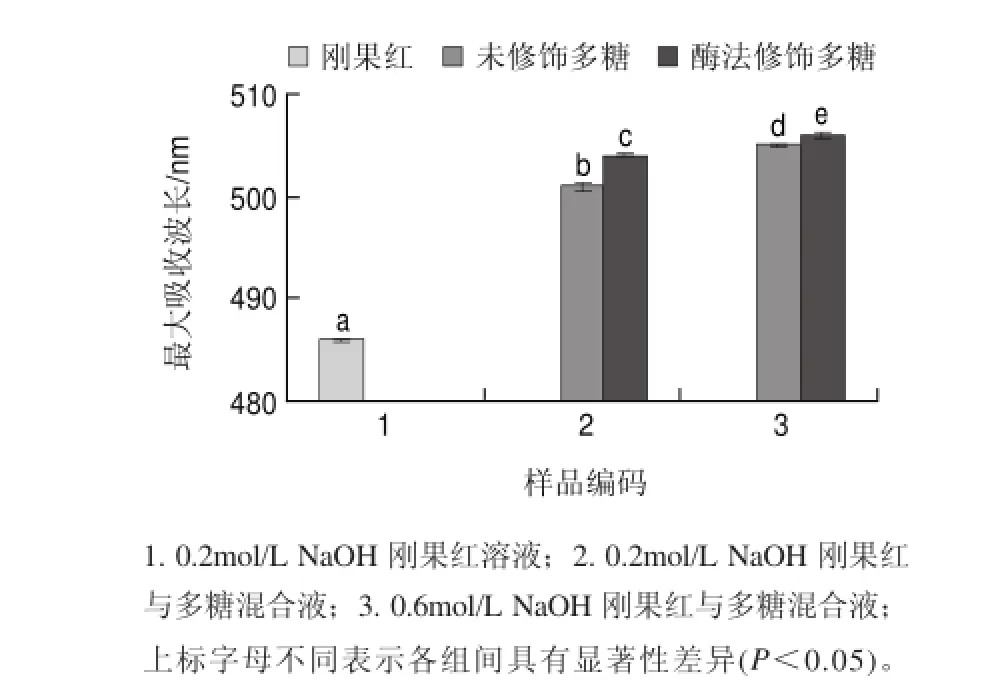
图 8 不同NaOH浓度下刚果红与蛹虫草多糖混合液的吸收波长Fig.8Wavelengths of maximum absorbance of Congo red and its mixtures with polysaccharide extract from Cordyceps militaris in the presence of NaOH at various concentrations
研究发现,三螺旋体结构对多糖的生物活性,特别是抗肿瘤活性具有重要的作用[22]。由图8可知,0.2mol/L NaOH刚果红溶液在486nm波长处有最大吸收波长,0.2mol/L NaOH 刚果红与未修饰蛹虫草多糖混合液在501nm波长处有最大吸收波长,吸收波长红移了15nm,当NaOH溶液浓度提高到0.6mol/L时,刚果红与未修饰蛹虫草多糖混合液的最大吸收波长又红移了4nm,这说明未修饰蛹虫草多糖的分子链中存在三螺旋体结构[23]。0.2mol/L NaOH 刚果红与酶法修饰后蛹虫草多糖混合液在504nm波长处有最大吸收波长,比刚果红的最大吸收波长红移了18nm;随着NaOH溶液浓度提高到0.6mol/L时,刚果红与酶法修饰后蛹虫草多糖混合液又红移了2nm,这说明酶法修饰后蛹虫草多糖的分子链中也存在三螺旋体结构[23]。在相同NaOH浓度下,与未修饰蛹虫草多糖相比,酶法修饰后蛹虫草多糖与刚果红混合液的最大吸收波长红移了1~3nm,这说明α-淀粉酶修饰会使蛹虫草多糖的三螺旋体结构遭到轻微破坏[14,23],而这种三螺旋体结构的轻微破坏或许对蛹虫草多糖的抗氧化活性具有重要作用[14]。
3 结 论
采用响应面分析法优化了α-淀粉酶修饰蛹虫草多糖的工艺,各因素对酶法修饰蛹虫草多糖的抗氧化活性的影响大小为:加酶量>酶解温度>酶解pH值;确定最优工艺条件为酶解温度48.5℃、酶解pH5.8、加酶量259.5U/g,酶法修饰后蛹虫草多糖对DPPH自由基的清除率为(81.6f1.6)%。抗氧化实验表明,α-淀粉酶修饰能够明显提高蛹虫草多糖的抗氧化活性;α-淀粉酶修饰后,蛹虫草多糖清除DPPH自由基和螯合Fe2+的EC50值分别为0.0247、1.0120mg/mL,分别比酶法修饰前提高了55.1%和39.8%;此外,酶法修饰后,蛹虫草多糖的还原力也得到了显著提高(P<0.05)。三螺旋体结构分析表明,蛹虫草多糖经α-淀粉酶修饰后,尽管三螺旋体结构发生了轻微破坏,但仍然保持着三螺旋体结构。
[1] 孙军德, 房琳琳, 王颖, 等. 蛹虫草不同菌株的生物学特性及系统发育研究[J]. 沈阳农业大学学报, 2011, 42(3): 306-310.
[2] LEE J S, KWON J S, YUN J S, et al. Structural characterization of immunostimulating polysaccharide from cultured mycelia of Cordyceps militaris[J]. Carbohydrate Polymers, 2010, 80(4): 1011-1017.
[3] YU Rongmin, YANG Wei, SONG Liyan, et al. Structural characterization and antioxidant activity of a polysaccharide from the fruiting bodies of cultured Cordyceps militaris[J]. Carbohydrate Polymers, 2007, 70(4): 430-436.
[4] PARK S E, YOO H S, JIN C Y, et al. Induction of apoptosis and inhibition of telomerase activity in human lung carcinoma cells by the water extract of Cordyceps militaris[J]. Food and ChemicalToxicology, 2009, 47(7): 1667-1675.
[5] LEE J S, KWON J S, WON D P, et al. Study on macrophage activation and structural characteristics of purif i ed polysaccharide from the liquid culture broth of Cordyceps militaris[J]. Carbohydrate Polymers, 2010, 82(3): 982-988.
[6] SUN Yongxu, LIANG Haitao, CAI Guangzhi, et al. Sulfated modification of the water-soluble polysaccharides from Polyporus albicans mycelia and its potential biological activities[J]. International Journal of Biological Macromolecules, 2009, 44(1): 14-17.
[7] ZHOU Cunshan, MA Haile. Ultrasonic degradation of polysaccharide from a red algae (Porphyra yezoensis)[J]. Journal of Agricultural and Food Chemistry, 2006, 54(6): 2223-2228.
[8] 孟春, 郭养浩, 石贤爱, 等. 海藻多糖生物活性及分子修饰[J]. 中国生物工程杂志, 2004, 24(3): 35-39.
[9] ZHANG Chi, FAN Daidi, SHANG Longan, et al. Optimization of fermentation process for human-like collagen production of recombinant Escherichia coli using response surface methodology[J]. Chinese Journal of Chemical Engineering, 2010, 18(1): 137-142.
[10] 钟广泉, 郑必胜. 超声场作用下裂褶多糖溶液的黏度变化规律[J].现代食品科技, 2007, 23(5): 26-27.
[11] WU Qiongying, JIA Junqiang, TAN Guangxiu, et al. Physicochemical properties of silkworm larvae protein isolate and gastrointestinal hydrolysate bioactivities[J]. African Journal of Biotechnology, 2011, 10(32): 6145-6153.
[12] ZHU Kexue, ZHOU Huiming, QIAN Haifeng. Antioxidant and free radical-scavenging activities of wheat germ protein hydrolysates (WGPH) prepared with alcalase[J]. Process Biochemistry, 2006, 41(6): 1296-1302.
[13] 韩林, 张海德, 李国胜, 等. 槟榔籽总酚提取工艺优化与抗氧化活性试验[J]. 农业机械学报, 2010, 41(4): 134-139.
[14] 何晋浙, 邵平, 孟祥河, 等. 灵芝多糖的结构特征分析[J]. 分析化学, 2010, 38(3): 372-376.
[15] 葛静微, 罗均, 李小定, 等. 响应面分析法优化血红素提取工艺[J].食品科学, 2010, 31(8): 60-64.
[16] 陈海华, 李国强. 响应面分析法优化酶法提取谷朊粉工艺的研究[J].中国粮油学报, 2010, 25(12): 106-110.
[17] 黄惠华, 黄少斌, 梁汉华. 茶多酚对米曲霉α-淀粉酶的回收及其特性的影响[J]. 食品科学, 2002, 23(7): 30-34.
[18] GÜLÇIN Ì, HUYUT Z, ELMASTAŞ M, et al. Radical scavenging and antioxidant activity of tannic acid[J]. Arabian Journal of Chemistry, 2010, 3(1): 43-53.
[19] 张长水. 螯合物稳定性的探讨[J]. 河南职业技术师范学院学报, 2004, 32(3): 68-69.
[20] 徐金瑞, 张名位, 刘兴华, 等. 黑大豆种皮花色苷体外抗氧化活性研究[J]. 营养学报, 2007, 29(1): 54-57.
[21] 杨文鸽, 谢果凰, 徐大伦, 等. 龙须菜多糖的降解及其降解产物的抗氧化活性[J]. 水产学报, 2009, 33(2): 342-347.
[22] YANAKI T, ITO W, TABATA K, et al. Correlation between the antitumor activity of a polysaccharide schizophyllan and its triplehelical conformation in dilute aqueous solution[J]. Biophysical Chemistry, 1983, 17(4): 337-342.
[23] MAO Chingfeng, HSU Mingching, HWANG Weihsin. Physicochemical characterization of grifolan: thixotropic properties and complex formation with congo red[J]. Carbohydrate Polymers, 2007, 68(3): 502-510.
Enzymatic Modif i cation and Antioxidant Activity of Polysaccharides from Cordyceps militaris Fruit Bodies
JIA Jun-qiang1,2,SHEN Jian3,CHEN Lian3,GUI Zhong-zheng1,2,WU Qiong-ying3,ZHANG Shu3
(1. Sericultural Research Institute, Jiangsu University of Science and Technology, Zhenjiang 212018, China;2. Sericultural Research Institute, Chinese Academy of Agricultural Sciences, Zhenjiang 212018, China;3. School of Biotechnology and Chemical Engineering, Jiangsu University of Science and Technology, Zhenjiang 212018, China)
Polysaccharides were extracted from Cordyceps militaris fruit bodies and modif i ed using α-amylase for enhanced antioxidant activity. Response surface methodology was employed to optimize conditions for the enzymatic modif i cation of polysaccharides based on DPPH radical scavenging activity. In addition, modif i ed polysaccharides were tested for DPPH radical scavenging activity, ferrous ion chelating capacity and reducing power as well as triple-helical conformation. The optimized hydrolysis parameters were in decreasing order of their effects on DPPH radical scavenging activity of modif i ed polysaccharides: enzyme dosage, temperature and pH and their optimal conditions were 259.5 U/g, 48.5 ℃ and 5.8, respectively. Under these conditions, the maximum predicted and experimental DPPH radical scavenging rates of modif i ed polysaccharides were 81.4% and (81.6 f 1.6)%. The results of the validation experiments showed good reproducibility and thus, the fitted prediction model is applicable in practice. The antioxidant tests showed that the EC50values of modif i ed polysaccharides for scavenging DPPH radical and chelating ferrous ions were 0.0247 mg/mL and 1.0120 mg/mL, respectively, which were 55.1% and 39.8% higher than before the modif i cation, respectively. Meanwhile, the reducing power of polysaccharides signif i cantly increased (P<0.05) after the modif i cation (P<0.05), and the triple-helical conformation was well maintained but slightly damaged.
polysaccharides from Cordyceps militaris fruit bodies;enzymatic modification;process optimization;antioxidant activity;triple-helical conformation
TS201.2;S886.9
A
1002-6630(2013)01-0114-07
2011-11-14
江苏省科技支撑计划项目(BE2011389);江苏省高校科研成果产业化推进拨款项目(JHB2011-43);
江苏省高等学校大学生实践创新训练计划项目(2011年);江苏科技大学本科生创新计划项目(2011年)
贾俊强(1973ü),男,助理研究员,博士,研究方向为生物资源开发与利用。E-mail:junqiangjia2008@163.com
