超高压处理对不同品种猕猴桃浆多酚含量及其抗氧化活性的影响
2013-03-07杨小兰郭晓晖夏春燕李富华
杨小兰,袁 娅,郭晓晖,夏春燕,李富华,明 建,2,3,*
(1.西南大学食品科学学院,重庆 400715;2.西南大学 国家食品科学与工程实验教学中心,重庆 400715;3.农业部农产品贮藏保鲜质量安全与风险评估实验室,重庆 400715)
超高压处理对不同品种猕猴桃浆多酚含量及其抗氧化活性的影响
杨小兰1,袁 娅1,郭晓晖1,夏春燕1,李富华1,明 建1,2,3,*
(1.西南大学食品科学学院,重庆 400715;2.西南大学 国家食品科学与工程实验教学中心,重庆 400715;3.农业部农产品贮藏保鲜质量安全与风险评估实验室,重庆 400715)
对4种猕猴桃浆(黄心猕猴桃、绿心猕猴桃、红阳猕猴桃、聚香猕猴桃)进行超高压(500MPa,20min)处理,分析超高压处理前后猕猴桃浆中游离酚、结合酚含量及其抗氧化活性变化。结果表明:超高压处理能显著提高猕猴桃浆多酚含量(P<0.05),其中,黄心猕猴桃游离酚含量增加了78.68μg/mL,聚香猕猴桃结合酚含量提高了15.58μg/mL。DPPH自由基清除率、还原力和ABTS+•清除率实验表明:4种猕猴桃游离酚抗氧化活性强于其结合酚的,超高压处理可提高其抗氧化活性,但效果不显著。
猕猴桃;超高压;多酚;抗氧化
猕猴桃,又称奇异果、中国醋粟,是猕猴桃属中多个栽培种水果的通称,其营养价值丰富,富含矿物质、VC,被誉为果中之王[1]。猕猴桃属浆果,对乙烯敏感,采收时又正值高温季节,果实采后易变软腐烂,通常会对采后猕猴桃及时进行加工,以便于保藏[2]。高流体静压又称超高压(ultra high pressure,UHP),是指在室温或较低温度条件下将物料放入液体介质中,利用100~1000MPa压力产生的极高静压影响细胞形态,使形成生物高分子立体结构的氢键、离子键和疏水键等非共价键发生变化,达到杀菌、钝酶以及物料改性的目的[3-5]。超高压处理只影响猕猴桃浆中非共价键酚类化合物,而共价键的酚类化合物却不发生变化,所以能较好地保持猕猴桃原有的营养品质、质构、风味、色泽等[5]。
水果中含有各种各样的抗氧化剂,包括多酚类化合物和维生素,多酚类化合物例如花色苷、黄酮、黄烷醇以及单宁酸等[6-9]。植物多酚具有较强的抗氧化性和清除自由基的能力[10-11]。现代药理研究发现,植物多酚具有良好的抑菌、抗癌、抗氧化等生物活性[12-14]。猕猴桃富含多酚类物质,本研究以黄心、绿心、红阳、聚香4个品种的猕猴桃为研究对象,通过超高压处理,对比分析超高压处理对不同品种猕猴桃多酚及其抗氧化性的的影响,从而进一步了解来自不同产区不同品种的猕猴桃的营养价值,给公众提供更全面的信息以供消费者选择。
1 材料与方法
1.1 材料、试剂与仪器
1.1.1 材料
黄心、绿心、红阳、聚香4个品种的猕猴桃采购自重庆市北碚区重百超市。
1.1.2 试剂
丙酮、甲醇、正己烷、乙酸乙酯(均为分析纯) 成都市科龙化工试剂厂;甲醇、磷酸、乙腈、无水乙醇均为色谱纯 天津四友化工厂;没食子酸、DPPH、ABTS (纯度≥99%) 美国Sigma公司。其他化学试剂均为分析纯。
1.1.3 仪器与设备
HPP-L3型超高压处理设备 天津华泰森淼生物工程技术有限公司;UV-2450型紫外分光光度计、LC-20A高效液相色谱仪 日本岛津公司。
1.2 方法
1.2.1 标准曲线的制作[15]
准确称取25mg没食子酸,去离子水溶解并定容至25mL,以该没食子酸溶液为原液,依次配制成质量浓度分别为0、20、60、100、150、200、300、400、500、600μg/mL的梯度液。取100μL标准溶液与400μL去离子水于玻璃试管中,加100μL福林-酚试剂,混匀,6min后加入1mL 7% Na2CO3溶液和0.8mL去离子水,混匀后避光放置,90min后于760nm波长处测定吸光度。并绘制标准曲线y= 0.0043x + 0.0168(R2= 0.9983)。
1.2.2 猕猴桃浆多酚提取和测定[16-17]
猕猴桃预处理:4种猕猴桃→去皮→切分→打浆→定量→袋装→真空封口→超高压(500MPa,20min)→—18℃保存,其中,对照组为未经超高压处理。
游离酚提取:准确称取10g样品,加入50mL 80%冷冻丙酮,漩涡振荡5min后均质3min(12000r/min),将该混合液抽滤,重复提取1次。合并两次滤液,于45°C条件下旋转蒸发至干,以体积比90:10的盐酸-甲醇溶液定容至25mL,将提取液于—80°C条件下贮存,备用。
结合酚提取:向提取游离酚的残渣中加入20mL 2mol/L的NaOH溶液,于在氮气环境下消化90min,使用盐酸调至中性,以正己烷除脂,加入30mL乙酸乙酯,漩涡振荡10min后于4000hg离心10min,收集上清液。乙酸乙酯提取过程重复5次,合并5次提取液,在45°C条件下旋转蒸发至干。以体积比90:10的盐酸-甲醇溶液定容至25mL,将提取液于—80°C条件下贮存,备用。
样品多酚含量检测:准确吸取样液100μL,其余操作同1.2.1节,按照公式(1)计算样品多酚含量。

式中:A样品为不同浓度提取液的吸光度;A空白为甲醇空白试剂的吸光度。
1.2.4 还原力测定[19]
取1mL不同浓度的样液加入2.5mL PBS(0.2mol/L,pH 6.6)溶液和2.5mL 1g/100mL铁氰化钾溶液,混合物在50℃条件下水浴20min,冷却后加入2.5mL的10g/100mL TCA溶液,混合物于3000hg离心10min,取该混合物的上清液2.5mL,加入2.5mL去离子水和0.5mL 0.1g/100mL氯化铁溶液,在700nm波长处测吸光度,以甲醇溶液做空白,VC和茶多酚(EGCG)做对照组。
1.2.5 ABTS+g清除率测定[20]
将5mL 7mmol/L ABTS+g和88μL的140mmol/L过硫酸钾混合,在室温、避光的条件下静置过夜(12~16h),得ABTS+g储备液,使用时用10mmol/L pH7.4的磷酸盐缓冲液稀释成工作液,使其在室温条件下,在734nm波长处的吸光度为0.70f0.02。将提取液用甲醇配成0.01、0.02、0.03、0.04、0.05、0.06、0.07mg/mL系列梯度样品质量浓度,测定时在96孔微量滴定板的每孔中加入200μL的ABTS+g工作液,再加入10μL的样品,以200μL ABTS+g工作液加10μL溶剂为空白,混合10s,6min后读取405nm波长处的吸光度,计算每种样品对ABTS+g的清除率。以甲醇溶液做试剂空白,VC和茶多酚做对照组,ABTS+g清除率计算如公式(3)。
ABTS+·清除率/%
式中:w为多酚含量/(μg/mL);ρ为没食子酸质量浓度/(μg/mL);V为提取液体积/mL;N为稀释倍数;V0为取样量/mL。
1.2.3 DPPH自由基清除率测定[18]
取1mL不同浓度的样液加入5mL 0.1mmol/L的DPPH溶液,避光放置50min后,于520nm波长处测吸光度,以甲醇溶液做空白,VC和茶多酚做对照组,按照公式(2)计算DPPH自由基清除率。
式中:A样品为提取液的吸光度;A空白为甲醇空白试剂的吸光度。
1.3 数据处理
数据采用Origin8.0统计分析,实验重复3次,结果用fs表示,用SPSS软件进行统计处理,采用Turkey法进行显著性分析(P<0.05)。
2 结果与分析
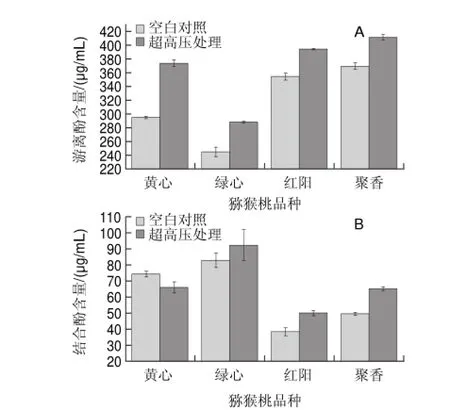
图 1 超高压处理对猕猴桃浆中游离酚(A)、结合酚(B)含量的影响Fig.1Effect of UHP treatment on polyphenols (free phenols (A) and bound phenols (B)) of kiwifruit juice
2.1 超高压处理对猕猴桃浆多酚含量的影响90.17%;超高压处理后,游离酚DPPH自由基清除率呈现类似规律,0.5μg/mL时,黄心猕猴桃DPPH自由基清除率最低,为41.74%,4μg/mL时,红阳猕猴桃DPPH自由基清除率最高,为94.18%。超高压处理前后,同等质量浓度条件下游离酚DPPH自由基清除率无显著变化(P<0.05)。
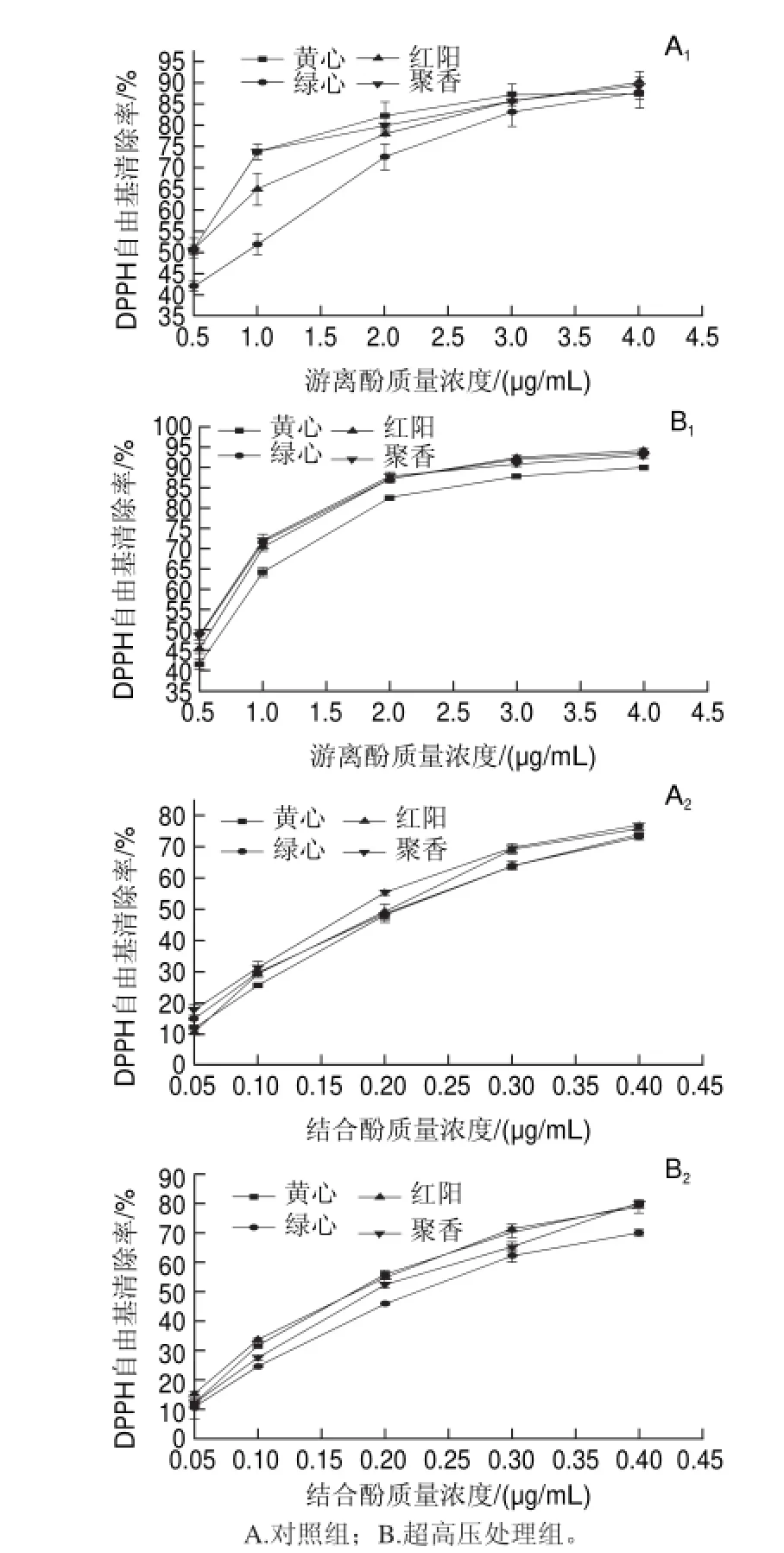
图 2 超高压处理对猕猴桃浆多酚的DPPH自由基清除率影响Fig.2Effect of UHP treatment on DPPH radical scavenging rate of kiwifruit polyphenols
由图1可知,猕猴桃多酚主要存在形式是游离态。对比超高压处理对4种猕猴桃多酚含量影响,发现超高压处理能显著增加猕猴桃中游离酚、结合酚含量(P<0.05)。对于游离酚,超高压处理前,4种猕猴桃浆游离酚含量如下:聚香猕猴桃(369.35μg/mL)>红阳猕猴桃(354.15μg/mL)>黄心猕猴桃(294.85μg/mL)>绿心猕猴桃(244.62μg/mL);超高压处理后各品种间含量变化趋势不变,其中增量最大的为黄心猕猴桃(增量为78.68μg/mL);对于结合酚,超高压处理前,4种猕猴桃结合酚含量如下:绿心猕猴桃(82.84μg/mL)>黄心猕猴桃(74.16μg/mL)>聚香猕猴桃(49.58μg/mL)>红阳猕猴桃(38.50μg/mL);超高压处理后各品种间含量变化趋势不变,其中增量最大的为聚香猕猴桃(增量为15.58μg/mL)。由此,超高压处理有助于提升不同品种猕猴桃多酚含量,但不同类型多酚(游离酚、结合酚)趋势有所不同,原因可能是超高压处理过程中部分结合酚转变为游离酚所致。
2.2 超高压处理对猕猴桃浆多酚DPPH自由基清除率的影响
超高压处理前后4种猕猴桃游离酚、结合酚的DPPH自由基清除率见图2。对于游离酚,超高压处理前,伴随多酚质量浓度上升(0.5~4μg/mL),各猕猴桃DPPH自由基清除率均显著上升(P<0.05)。对照组多酚含量0.5μg/mL时,绿心猕猴桃DPPH自由基清除率最低,为42.02%,4μg/mL时,红阳猕猴桃DPPH自由基清除率最高,为
对于结合酚,超高压处理前,伴随多酚质量浓度上升(0.05~0.4μg/mL),各猕猴桃DPPH自由基清除率均显著上升(P<0.05)。对照组多酚含量0.05μg/mL时,红阳猕猴桃DPPH自由基清除率最低,为10.64%,0.4μg/mL时,聚香猕猴桃DPPH自由基清除率最高,为76.82%;超高压处理后,0.05μg/mL时,绿心猕猴桃DPPH自由基清除率最低,为10.72%,0.4μg/mL时,聚香猕猴桃DPPH自由基清除率最高,为76.87%。
超高压处理前后,同等质量浓度下游离酚、结合酚的DPPH自由基清除率差异不显著,说明超高压处理前后猕猴桃多酚组分未改变。同等质量浓度的结合酚DPPH自由基清除率高于游离酚的。结合表1,参照品(VC、茶多酚),相同DPPH自由基清除率下,猕猴桃多酚(游离酚、结合酚)质量浓度低于参照品质量浓度。

表1 VC和茶多酚 DPPH自由基清除率Table 1 DPPH radical scavenging rates of vitamin C and EGCG
2.3 超高压处理对猕猴桃浆多酚还原力影响
还原力可以作为化合物潜在抗氧化能力的标志,抗氧化物质的抗氧化活性是由其将Fe3+络合物还原为Fe2+络合物的能力表示[20]。图3为超高压处理前后,4种猕猴桃游离酚与结合酚的还原力。由图可知,超高压处理前,对于游离酚,伴随其质量浓度的增大,还原力逐渐增强(P<0.05),在同等质量浓度下,各样品还原力大小关系如下:茶多酚>VC>聚香猕猴桃多酚>红阳猕猴桃多酚>黄心猕猴桃多酚>绿心猕猴桃多酚,结合酚呈现类似规律。超高压处理后,各品种猕猴桃多酚(游离酚、结合酚)在等质量浓度条件下其还原力与处理前相比无显著性差异(P<0.05);且游离酚还原力强于结合酚还原力。

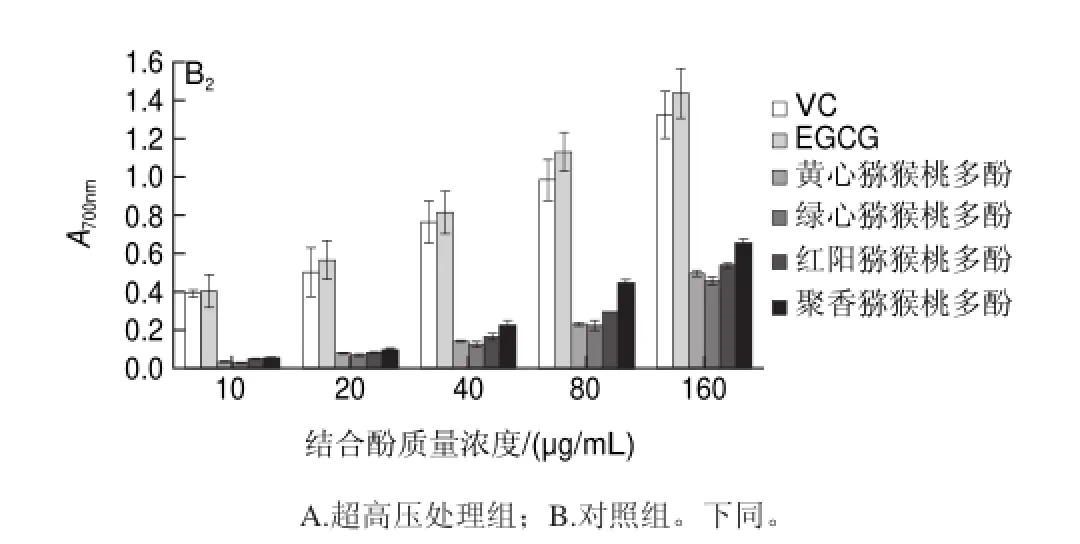
图 3超高压处理对猕猴桃多酚还原力影响Fig.3 Effect of UHP treatment on reducing power of kiwifruit polyphenols
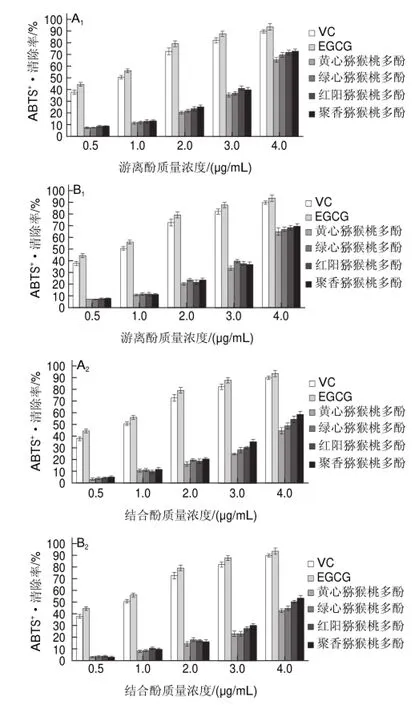
图 4 超高压处理对猕猴桃多酚ABTS+·清除抑制率的影响Fig.4Effect of UHP treatment on ABTS+· scavenging rate of kiwifruit polyphenols
2.4 超高压处理对猕猴桃浆多酚ABTS+g清除率的影响
图4为超高压处理前后各组样品中游离酚、结合酚ABTS+g清除率。由图可知,超高压处理前后猕猴桃游离酚在等质量浓度下ABTS+g清除率差异不明显,超高压处理后其清除率略有所上升,伴随多酚质量浓度升高,抗氧化性增强,超高压处理下聚香猕猴桃游离酚ABTS+g清除率达到最大值72.66%,等同于2μg/mL的VC抗氧化性。对比超高压处理下等质量浓度猕猴桃不同形态多酚,游离酚氧化性略大于结合酚抗氧化性,对照组呈现同样规律。
3 结 论
通过超高压处理,可以显著提高猕猴桃浆多酚含量(P<0.05),其中,黄心猕猴桃游离酚含量增加了78.68μg/mL,聚香猕猴桃结合酚含量提高了15.58μg/mL。
通过DPPH自由基清除率、还原力和ABTS+•清除率3种抗氧化能力的测定,反映出不同品种的猕猴桃浆中多酚(游离酚、结合酚)在超高压处理前后抗氧化能力的差异性。伴随样液多酚质量浓度提高,各抗氧化性指标均有所增强。DPPH自由基清除率最为灵敏,低质量浓度下即可显示强氧化性,对照组各品种间猕猴桃浆多酚清除DPPH自由基能力大小为聚香>红阳>黄心>绿心。结合酚抗氧化性强于游离酚抗氧化性;超高压处理后多酚抗氧化性大于处理前抗氧化性。还原力和ABTS+•清除率与DPPH自由基清除率和还原力测定结论相似,但同等质量浓度下,游离酚抗氧化性大于结合酚抗氧化性。
[1] 何佳, 张宏森, 张海宁, 等. 果浆酶和果胶酶对猕猴桃出汁率的影响[J]. 食品科学, 2012, 33(8): 76-79.
[2] 方亮, 江波, 张涛, 等. 超高压中温协同处理对猕猴桃果汁品质的影响[J]. 安徽农业科学, 2007(33): 10843-10844.
[3] 郭晓晖, 方国姗, 明建, 等. 超高压处理对草莓汁香气成分的影响[J].食品科学, 2012, 33(11): 39-43.
[4] 赵玉生, 姚二民, 赵俊芳. 超高压处理对猕猴桃汁品质的影响[J]. 食品科学, 2008, 29(1): 60-63.
[5] 赵玉生, 赵俊芳. 猕猴桃汁的超高压杀菌效果[J]. 食品科技, 2007(4): 146-148.
[6] FANG L, JIANG B, ZHANG T. Effect of combined high pressure and thermal treatment on kiwifruit peroxidase[J]. Food Chemistry, 2008, 109: 802-807.
[7] 方敏, 王耀峰, 宫智勇. 15种水果和33种蔬菜的抗氧化活性研究[J].食品科学, 2008, 29(10): 97-100.
[8] 欧阳玉祝, 李佑稷, 张萍, 等. 添加芦荟提取物对猕猴桃果汁抗氧化性的影响[J]. 食品科学, 2008, 29(10): 71-74.
[9] 王菲, 栾云峰, 刘长江. 软枣猕猴桃总黄酮体外抗氧化活性[J]. 食品科学, 2011, 32(17): 168-171.
[10] MARIA E, GONZALEZ, DIANE M, et al. Thermal, high pressure, and electric fi eld processing effects on plant cell membrane integrity and relevance to fruit and vegetable quality[J]. Journal of Food Science, 2010, 75: 121-130.
[11] 王岸娜, 徐山宝, 刘小彦, 等. 福林法测定猕猴桃多酚含量的研究[J].食品科学, 2008, 29(7): 398-401.
[12] 陈根洪. 藤茶总多酚的提取及其抗氧化活性研究[J]. 食品科学, 2011, 32(6): 127-130.
[13] KATALINIC V, MILOS M. Screening of 70 medicinal plant extracts for antioxidant capacity and total phenols[J]. Food Chemistry, 2006, 94: 550-557.
[14] BURSAL E, GÜLÇIN İ. Polyphenol contents and in vitro antioxidant activities of lyophilised aqueous extract of kiwifruit (Actinidia deliciosa)[J]. Food Research International, 2011, 44: 1482-1489.
[15] SUN J, CHU Y, WU X, et al. Antioxidant and antiproliferative activities of common fruits[J]. Journal of Agricultural and Food Chemistry, 2002, 50(25): 7449-7454.
[16] OKARTER N, LIU C, SORRELLS M E, et al. Phytochemical content and antioxidant activity of six diverse varieties of whole wheat[J]. Food Chemistry, 2010, 119(1): 249-257.
[17] CHEUNG L M, CHEUNG P C K, OOI V E C. Antioxidant activity and total phenolics of edible mushroom extracts[J]. Food Chemistry, 2003, 81(2): 249-255.
[18] ARDESTANI A, YAZDANPARAST R. Antioxidant and free radical scavenging potential of Achillea santolina extracts[J]. Food Chemistry, 2007, 104(1): 21-29.
[19] SOONG Y, BARLOW P J. Antioxidant activity and phenolic content of selected fruit seeds[J]. Food Chemistry, 2004, 88(3): 411-417.
[20] ZHANG A, FANG Y, WANG H, et al. Free-radical scavenging properties and reducing power of grape cane extracts from 11 selected grape cultivars widely grown in China[J]. Molecules, 2011, 16(12): 10104-10122.
Effect of Ultra High Pressure (UHP) on Polyphenol Content and Antioxidant Activity in Kiwifruit Juice from Different Cultivars
YANG Xiao-lan1,YUAN Ya1,GUO Xiao-hui1,XIA Chun-yan1,LI Fu-hua1,MING Jian1,2,3,*
(1. College of Food Science, Southwest University, Chongqing 400715, China;2. National Food Science and Engineering Experimental Teaching Center, Southwest University, Chongqing 400715, China;3. Laboratory of Quality and Safety Risk Assessment for Agro-products on Storage and Preservation (Chongqing), Ministry of Agriculture, Chongqing 400715, China)
Ultra high pressure (UHP) (500 MPa, 20 min) was used for the treatment of kiwifruit juice from four species (yellow kiwifruit, green kiwifruit, Hongyang kiwifruit and Juxiang kiwifruit) for evaluating the content and antioxidant activity of polyphenols. Results indicated that UHP could signif i cantly improve polyphenol (free phenol and bound phenol) contents (P<0.05). Especially, the content of free phenol from yellow kiwifruits revealed an improvement of 78.68 μg/mL; the content of bound phenol from Juxiang kiwifruits revealed an improvement of 15.58 μg/mL. The antioxidant activities of four cultivars of kiwifruits were evaluated by DPPH radical scavenging method, reducing power method and ABTS radical scavenging method. Results indicated that antioxidant activity of free polyphenols was higher than that of bound polyphenols. Therefore, UHP treatment can improve the antioxidant activity of four kinds of kiwifruit pulp, but not signif i cantly.
kiwifruit;ultra high pressure;polyphenol;antioxidant activity
TS255.3
A
1002-6630(2013)01-0073-05
2012-10-08
中央高校基本科研业务费专项(XDJK2012B014)
杨小兰(1988ü),女,硕士研究生,研究方向为农产品加工及贮藏工程。E-mail:873395723@qq.com
*通信作者:明建(1972ü),男,副教授,博士,研究方向为食品化学与营养学。E-mail:mingjian1972@163.com
