丙泊酚的配伍研究
2013-03-06曾令全龙万梅傅洪魏安宁
曾令全,龙万梅,傅洪,魏安宁
(1.重庆市第十三人民医院麻醉科,重庆 400053;2.重庆市第七人民医院药剂科,重庆 400054;
3.重庆市中医院麻醉科,重庆 400021;4.重庆医科大学附属第二医院麻醉科,重庆 400010)
·临 床·
丙泊酚的配伍研究
曾令全1,龙万梅2,傅洪3,魏安宁4
(1.重庆市第十三人民医院麻醉科,重庆 400053;2.重庆市第七人民医院药剂科,重庆 400054;
3.重庆市中医院麻醉科,重庆 400021;4.重庆医科大学附属第二医院麻醉科,重庆 400010)
目的 考察室温下6 h内,丙泊酚乳剂与利多卡因注射液和/或地塞米松注射液配伍后的稳定性。方法 采用离心分光光度法、苏丹染色实验、电导率测定以及混合液pH值和激光粒度分析等方法来考察丙泊酚(A组)、丙泊酚与利多卡因9∶1混合(B组)、丙泊酚与利多卡因4∶1混合(C组)、丙泊酚与利多卡因及0.5%地塞米松以3∶1∶1的比例混合(D组)的稳定性。结果 室温下6 h内,B、C、D组与A组比较,稳定常数(Ke)值明显增高(P<0.05)。各组未见分层和颜色变化。B组与A组比较,各时点pH值明显降低,具有显著性差异(P<0.05),D组与B组比较,各时点pH值明显升高(P<0.05)。电导率值为A组<B组<C组<D组。各组丙泊酚含量均下降,下降程度各组无差异。各组在相同时点的粒径无统计学差异。结论 丙泊酚与利多卡因注射液和(或)地塞米松注射液配伍后,未出现脂肪乳水解;配伍后稳定性下降,并随时间延长,进一步下降。但平均粒径未发生明显变化,说明尚可以使用,不会发生栓塞。
丙泊酚乳剂;利多卡因;地塞米松;激光粒度分析;配伍
据统计,从1999年开始,丙泊酚注射液在我国医院中的用药普及率达60%~70%,目前已达90%左右,是应用最多的静脉麻醉药。但静脉注射后5~20 s常在注射部位产生烧灼样的疼痛,增加患者的痛苦和术后不良回忆。在国外,困扰患者的33项临床问题调查中,丙泊酚注射痛位于第7位。在门诊手术的33个常见麻醉问题中其发生频率名列第3位[1]。丙泊酚注射痛发生率达28%~90%[2],可以通过预注利多卡因来预防。一项关于丙泊酚注射疼痛防治荟萃分析显示,丙泊酚与利多卡因混用的效果优于利多卡因预注[3]。丙泊酚和其他药物混合时,肉眼很难观察其是否发生化学反应,因此必须进行物理和化学两方面的研究,以判断2种药物混合后是否随时间和环境的变化而发生稳定性的变化。有研究报道,当乳剂中微滴直径>5 µm就有形成肺部脂肪栓塞的危险[4]。此外,药物浓度在混合后是否会随时间和温度改变而发生变化,混合使用是否会产生药物不良反应,是否存在配伍禁忌,均需进一步检测,以明确药物混合使用的安全性。目前国内外应用的丙泊酚剂型为脂肪乳剂,这一剂型属于热力学不稳定的非均相系,因此与其他注射液混合后使用,很可能会产生影响其稳定性的因素,使乳剂产生粒径增大、破乳、分层或药物含量变化等现象,影响临床安全合理用药。我院所使用的丙泊酚乳剂商品名为力蒙欣(主要成分为丙泊酚),其药品说明书规定丙泊酚只能用5%葡萄糖注射液混合使用,并且混合比例不能超过1/5。用于麻醉诱导时,丙泊酚可以大于20∶1的比例与0.5%或1%的利多卡因注射液混合使用。为了给临床用药的配伍提供理论依据,本试验考察了丙泊酚分别以9∶1,4∶1的比例与2%利多卡因注射液,以3∶1∶1的比例与2%利多卡因注射液及0.5%地塞米松配伍后,在1~6 h内的pH、吸光度、电导率、苏丹染色、药物颗粒直径及其变化,分析其配伍稳定性。
1 仪器与试剂
1.1 仪器
PHS-2CW型酸度计(上海理达仪器厂);尤尼柯UV-2000紫外可见分光光度计(上海玖纵精密仪器有限公司);DDS-307型微机型电导仪(上海般特仪器有限公司);TG16B高速离心机(昆明诺金科技有限公司);Waters 2695高效液相色谱仪(Waters公司);DP20型显微镜成像系统(Olympus);PM200电子天平(METTLER);Nano-ZS90激光粒度分析仪(英国马尔文)。
1.2 试剂
丙泊酚(商品名:力蒙欣,10 mL·(100 mg)-1,西安杨森有限公司生产,批号:1203301);利多卡因注射液(5 mL,西南药业股份有限公司,批号:120702);地塞米松注射液(2 mL,西南药业股份有限公司,批号:120405)。丙泊酚对照品(四川省药品食品检验所提供,批号:100806-200801,纯度:99%);醋酸钠(分析纯,北京康普汇维科技有限公司);甲醇(色谱纯,Fisher)。
2 方法
2.1 离心分光光度法测定乳剂粒径的变化
精密量取丙泊酚10 mL(A组),利多卡因1 mL+丙泊酚9 mL(B组),利多卡因2 mL+丙泊酚8 mL(C组),利多卡因2 mL+丙泊酚6 mL+地塞米松2 mL (5 mg)(D组)4种制剂各自混合均匀后,各取1.5 mL混合液,于0,10,30,60,90,120,180,240,300,360 min,10 900 r·min-1离心15 min,取离心前的乳剂及离心后的下层液各0.1 mL,分别加水稀释至10 mL,以水为空白,于500 nm处测定其吸收度值(乳剂离心前后测得的吸收度分别为A0,A),计算其稳定性常数Ke,即离心前后吸收度A0,A的变化百分率。Ke表达式为Ke=(A0-A)/A0×100%,Ke值越小,乳剂越稳定。
2.2 苏丹染色实验
精密量取A、B、C、D 4组混合均匀的混合制剂各1.5 mL,于0,10,30,60,90,120,180,240,300,360 min取一滴混合液置于载玻片上,进行苏丹染色,乳滴外液如被染成红色则有破乳现象发生则记为阳性(+),否则记为阴性(-)。
2.3 电导率的测定
各取3.0 mL A、B、C、D 4组混合均匀后的混合制剂于0,10,30,60,90,120,180,240,300,360 min测定电导率,记录结果。
2.4 pH值的测定
精密量取A、B、C、D 4组混合均匀的混合制剂各3.0 mL,于0,10,30,60,90,120,180,240,300,360 min测定pH,记录结果。
2.5 丙泊酚含量的测定
2.5.1 丙泊酚含量测定采用HPLC[5]色谱条件为ODS柱(Waters,4.6 mm×250 mm,5 µm);流动相为甲醇:醋酸钠-醋酸缓冲液(1 000 mL水中加入0.3 mL醋酸,醋酸钠调pH为6.0)(75∶25);流速1.0 mL·min-1;紫外检测波长270 nm;进样量10 µL。
2.5.2 标准曲线的绘制 精密称取丙泊酚对照品10 mg,置于l0 mL量瓶中,用甲醇-水(70∶30)溶解并定容即得1 000 µg·mL-1的对照品溶液,精密量取对照品溶液5.0,2.0,1.0,0.5,0.25,0.125 mL置于5 mL量瓶中,用甲醇-水(70∶30)定容即得浓度400,200,100,50,25 µg·mL-1的系列溶液。取溶液各10 µL进样,每个浓度平行进样3次,以浓度C对面积的平均值A进行回归,回归方程为:A=4 562C+66 480,r=0.999 8,可见丙泊酚在浓度25~1 000 µg·mL-1内线性关系良好。
2.5.3 混合液中丙泊酚含量的测定 精密量取A、B、C、D 4组混合制剂各0.1 mL,于0,10,30,60,90,120,180,240,300,360 min加入到5 mL量瓶中,用甲醇-水(70∶30)定容后混匀静置30 min,取0.5 mL液体于离心管中,10 900 r·min-1离心10 min,取上清液10 µL进样,按标准曲线计算浓度。
2.6 激光粒度分析
精密量取A、B、C、D 4组混合制剂混合均匀后,于0,10,30,60,90,120,180,240,300,360 min取0.1 mL,稀释到100 mL,加1.5 mL到激光粒度分析仪样品池中,以大豆油折光率1.47为样品的折光率,以水的折光率1.333为离散剂折光率,记录测量结果。
3 结果
3.1 吸光度及稳定性常数
丙泊酚乳剂及配伍后6 h内的吸光度及由吸光度计算出的稳定参数Ke值,结果显示4组之间相同时点的吸光度及Ke值有统计学差异(P<0.05)。B、C、D组与A组比较,Ke值明显增高(P<0.05)。B、C、D组间Ke值比较无统计学差异。A组吸光度随时间变化不呈线性增高。B组吸光度随时间变化呈线性增高,回归系数为0.001,截距为2.497,其r=0.664(P<0.05),见表1。
3.2 苏丹染色结果
丙泊酚乳剂及配伍后1 h和6 h,各组均未见分层和颜色变化,结果见图1。

图1 丙泊酚乳剂及配伍后颜色变化(200×) A-A组1 h;B-A组6 h;C-B组1 h;D-B组6 h;E-C组1 h;F-C组6 h;G-D组1 h;H-D组6 hFig 1 The color changes of propofol and its compatibility(200×)A-group A, 1 h; B-group A, 6 h;C-group B, 1 h; D-group B, 6 h; E-group C, 1 h; F-group C, 6 h; G-group D, 1 h; H-group D, 6 h
3.3 pH值变化
丙泊酚乳剂及配伍后6 h内,与A组比较,B、C组各时点pH值明显降低(P<0.05),与B、C组比较,D组各时点pH值明显升高(P<0.05)。其余各组间比较无统计学差异。pH值变化见表2。
3.4 电导率值变化
各组之间电导率值在相同时点具有显著性差异(P<0.05),电导率值为A组<B组<C组<D组。B组电导率随时间变化呈线性增高,回归系数为0.581,截距为26,r=0.822(P<0.05)。C组电导率随时间变化呈线性增高,回归系数为1.777,截距为1 970,r=0.775(P<0.05)。D组电导率随时间变化呈线性增高,回归系数为0.631,截距为3 740,r=0.809(P<0.05)。结果见表3。
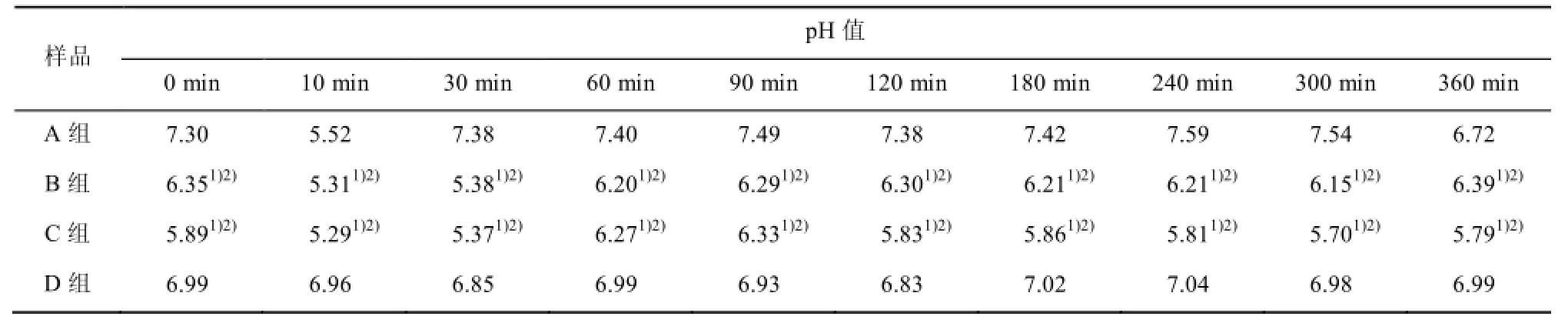
表2 丙泊酚及配伍后的pH值变化Tab 2 The changes of pH

表3 丙泊酚及配伍后的电导率变化Tab 3 The conductivity changes
3.5 丙泊酚含量变化
各组随时间延长,丙泊酚含量均下降,线性回归系数:A组为-0.019(P<0.05),B组为-0.022 (P<0.05),C组为-0.021(P<0.05),D组为-0.020 (P<0.05),各组回归系数间比较无统计学差异。结果见表4。
3.6 粒径变化
各组在相同时点的粒径无统计学差异,丙泊酚乳剂及配伍后2,6 h的粒径变化见表5。
4 讨论
根据韩继洪等[6]提出的离心分光光度法评价乳剂的物理稳定性可知,同样条件下,稳定性常数Ke越小,则乳剂越稳定。6 h内丙泊酚与利多卡因以及地塞米松注射液配伍后的Ke值均增高,说明丙泊酚和利多卡因及地塞米松注射液配伍后稳定性有所下降。由B组看出,随时间延长,丙泊酚与利多卡因混合液的稳定性逐渐下降。
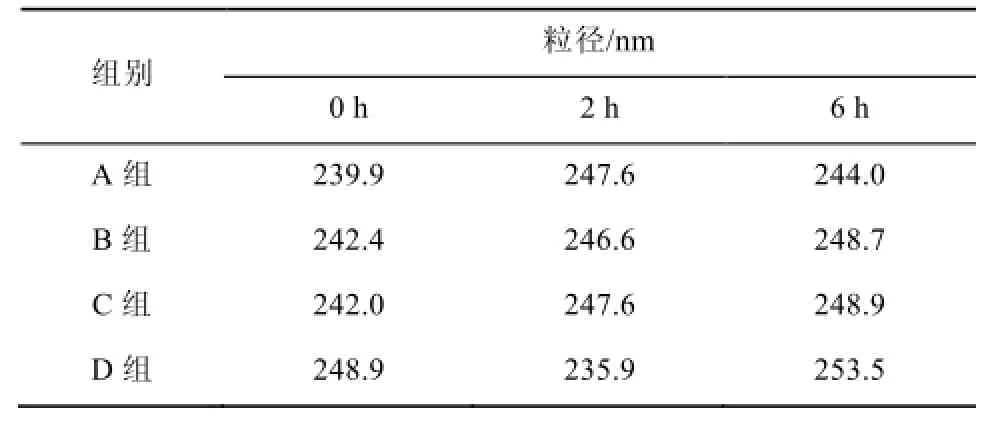
表5 丙泊酚乳剂及配伍后不同时间粒径变化Tab 5 The changes of particle size at different time
丙泊酚和其他3种制剂配伍后6 h的混合液经苏丹染色实验表明均呈阴性,即乳剂未发生破乳现象。丙泊酚配伍后混合液的电导率值增大,是因为乳剂中加入了水溶性的电解质,使混合液中离子增加。随着时间延长,混合液的电导率逐渐升高,电导率表征油相体积分数变化程度和乳状液的稳定性[7],乳剂中油珠上浮,聚集、聚并。随着时间的延长,油珠上浮增加,对乳状液中离子运动的阻碍作用减弱,因此,其电导率值逐渐增加。
当pH<5时,乳滴之间的静电排斥力会减少,粒径会增大。脂肪乳的最佳pH值应在6~7,因为在这个范围内,一方面,卵磷脂乳滴周围可以形成良好的保护膜,另一方面,在这个pH值下,可以降低卵磷脂的水解。脂肪乳的主要降解途径是其中的磷脂及甘油三酯的水解,从而可引起介质的pH降低[8]。由本实验所测定的pH值可以看出,丙泊酚与利多卡因注射液配伍后的pH值降低,丙泊酚与利多卡因及地塞米松注射液配伍后并且在6 h内,混合液的pH较丙泊酚与利多卡因注射液配伍增加,但只是pH值的简单加减,未随时间延长发生变化,说明溶液混合后并未引起丙泊酚乳剂的降解。但由于乳剂的pH一般应保持在7.0~8.5内,以减小水解的影响,使乳剂稳定,所以基于pH的考虑,丙泊酚与利多卡因注射液和/或地塞米松注射液配伍后,使pH下降明显,应尽快使用,以防止水解反应的发生。
丙泊酚含量测定证实,丙泊酚与利多卡因注射液和/或地塞米松注射液配伍后,丙泊酚含量均下降,但单纯丙泊酚组比较无显著性差异。丙泊酚为酚类化合物,易于氧化,当暴露于空气中,在使用时保存在安瓶中的惰性气体被驱除,药物容器空间有空气,氧在水中有一定溶解度,丙泊酚因此逐渐降解,含量随时间缓慢下降[9]。但其丙泊酚含量下降值均<10%(t0.9),仍属有效。本实验结果与夏亚东等[10]观察到丙泊酚与硫喷妥钠混合后,含量下降情况类似。
混合液的粒径分析,丙泊酚与利多卡因注射液和(或)地塞米松注射液配伍后,乳剂的平均粒径及粒径分布未发生明显的变化,说明使用上仍然安全,不会发生栓塞。
总之,丙泊酚与利多卡因注射液和/或地塞米松注射液配伍后,3种配伍方式比较,pH值改变,但只是简单加和,未随时间发生变化,即未出现脂肪乳水解。配伍后电导率增加不等,以丙泊酚9 mL+利多卡因1 mL增加最小,并随时间延长,进一步增加,说明配伍后稳定性下降,油相上浮,提示使用前需要摇匀。3种配伍后,平均粒径未发生明显变化,说明尚可以使用,不会发生栓塞。由于体内血液复杂成分的影响,丙泊酚联合用药在体内的稳定性,尚需要进一步研究,将混合药物加入空白血浆中,丙泊酚及利多卡因含量的变化,可以通过高效液相色谱同时测定[11],笔者将对之进一步研究。
REFERENCES
[1] MAEARIO A, WEINGER M. TMONG P, et a1. Which clinical anesthesia outcmese are both eommon and important to avoid? The perspective of a panel of expert anesthesiologists [J]. Anesth Analg, 1999, 88(5): 1085-1091.
[2] KAM E, ABDUL-LATIF M S, MECLUSKEY A. Comparison of propofo1-lipuro with pmpofol mixed with lidoeaine 10 mg on pmpofol injection Pain [J]. Anaesthesia, 2004, 59(12): 1167-1169.
[3] JALOTA L, KALIRA V, GEORGE E, et al. Prevention of pain on injection of propofol: systematic review and meta-analysis [J]. BMJ, 2011(342): 1110-1136.
[4] XUE Z G. The problem need to pay attention to when inject mixed drug [J]. Shanghai Med J(上海医学), 2010(4): 341-341.
[5] LI G L, SU D X. Determination of intravenous emulsion of propofol by HPLC [J]. Chin Pharm J(中国药学杂志), 1999, 34(4): 272.
[6] HAN J H, SU D S. Studies on the physical properties of an anticancer drug FT-207 fat emulsion [J]. J Shenyang Coll Med(沈阳药学院学报), 1991, 8(1): 14-17.
[7] ZHANG W, LI M Y, LIN M Q, et al. Electrical conductivity and stability of O/W emulsions [J]. Acta Petrol Sin(Petrol Proc Sec(石油学报:石油加工), 2008, 24(5): 592-596.
[8] LU B. New Techniques and New Dosage Forms of Drugs(药物新剂型与新技术) [M]. Beijing: People's Medical Publishing House, 1998: 93.
[9] CUI D F. Pharmacy(药剂学) [M] Beijing: People's Medical Publishing House, 2011: 360.
[10] XIA D Y, XU J H, WANG Y, et al. Determination of propofol and thiopenal in a 1∶1 volume mixture by HPLC and its chemical stability [J]. China Pharm(中国药师), 2007, 10(9): 881-883.
[11] YANG W C, GENG Y J, ZHANG Y N, et al. Determination of propofol and lidocaine concentration in plasma by HPLC [J]. J Harbin Med Univ(哈尔滨医科大学学报), 2011, 45(3): 240-242.
Compatibility of Propofol Emulsion
ZENG Lingquan1, LONG Wanmei2, FU Hong3, WEI Anning4
(1.Department of Anesthesiology, the Thirteenth People’s Hospital of Chongqing, Chongqing 400053, China; 2.Pharmacy Division, the Seventh People’s Hospital of Chongqing, Chongqing 400053, China; 3.Department of Anesthesiology, Chongqing TCM Hospital, Chongqing 400021, China; 4.Department of Anesthesiology, the Second Affiliated Hospital of Chongqing Medical University, Chongqing 400010, China)
OBJECTIVE To investigate the compatibility of propofol emulsion combined with lidocaine injection and/or dexamethasone injection. METHODS Centrifugal spectrophotometry, Sudan test, conductivity measuring, pH and laser particle size analysis were used to observe the stability of propofol(group A), propofol and lidocaine mixed by 9∶1(group B), propofol and lidocaine mixed by 4∶1(group C), propofol and lidocaine and dexamethasone mixed by 3∶1∶1(group D) within 6 hours under room temperature. RESULTS The Keof group B, C, D were significantly increased compared with group A, (P<0.05). Each group showed no stratification and color change. The pH of group B was decreased compared with group A at each time(P<0.05). The conductivity value of group A<B<C<D. The content of propofol decreased in each group, but there were no differences in decend degree. The particle size had no significant difference between each group at the same time. CONCLSION When propofol combined with lidocaine injection and/or dexamethasone injection, fat hydrolysis doesn’t occur. Stability decreases, and further down along with time. But the average particle size has no significantly changed, that showes it still can be used, no embolism will occur.
propofole mulsion; lidocaine; dexamethasone; laser particle size analysis; compatibility
R969
A
1007-7693(2013)10-1126-06
2013-01-30
重庆市卫生局医学科研计划项目(2011-2-392)
曾令全,男,硕士,副主任医师 Tel: 15923921235 E-mail: zenglingquan2231@126.com
