羧甲基壳聚糖超小超顺磁氧化铁纳米粒在大鼠体内的药动学特点及组织分布
2013-03-06范彩霞陈志喜高文慧赖水招郑锦坤
范彩霞,陈志喜,高文慧,赖水招,郑锦坤
(1.汕头大学附属粤北人民医院,广东 韶关 512026;2.广州医学院附属肿瘤医院,广州 510005)
羧甲基壳聚糖超小超顺磁氧化铁纳米粒在大鼠体内的药动学特点及组织分布
范彩霞1,陈志喜1,高文慧2,赖水招1,郑锦坤1
(1.汕头大学附属粤北人民医院,广东 韶关 512026;2.广州医学院附属肿瘤医院,广州 510005)
目的 考察羧甲基壳聚糖超小超顺磁氧化铁纳米粒(O-carboxymethyl chitosans ultrasmall superparamagnetic iron oxide nanoparticles,OCMCS-USPIO-NPs)在SD大鼠体内的药动学特征及组织分布,为其临床应用提供依据。方法 SD大鼠随机分为生理盐水组、OCMCS-USPIO-NPs组和葡聚糖超顺磁氧化铁纳米粒组(dextran-SPIO-NPs),原子分光光度法测定血浆和心、肝、脾、肺和肾等组织的铁含量,DAS 药动学软件对血药浓度-时间数据处理,求得OCMCS-USPIO-NPs组和dextran-SPIO-NPs组在大鼠体内的主要药动学参数;绘制组织内铁含量-时间曲线结合普鲁士蓝染色,比较OCMCS-USPIO- NPs和Dextran-SPIO-NPs在大鼠体内组织分布特点。结果 OCMCS-USPIO-NPs组和dextran-SPIO-NPs组的主要药动学参数(AUC,MRT,t1/2,CL,V2,差异显著(P<0.05),且OCMCS-USPIO-NPs组t1/2>7 h;OCMCS-USPIO-NPs组在肝、脾和肺的组织分布浓度显著低于dextran-SPIO-NPs组。结论 OCMCS-USPIO-NPs能逃避网状内皮系统吞噬,具有长循环作用。
超小超顺磁氧化铁纳米粒;原子分光光度法;药动学;组织分布
超顺磁氧化铁纳米粒(superparamagnetic oxide iron nanoparticles,SPIO-NPs)具有超顺磁性、细胞毒性低、包被的高分子物质表面有特异性功能基团,可以与其他药物、对比剂结合等理化特性使其常作为MRI对比剂、靶向给药系统载体、热疗剂,在医学研究及临床上广泛应用,是目前医学研究的热点和前沿[1-2]。根据粒径不同,SPIO-NPs可以分为2类:普通的SPIO-NPs(粒径>50 nm)和超小的超顺磁氧化铁纳米粒(USPIO-NPs、粒径<50 nm)[3],普通SPIO-NPs主要用于巨噬细胞丰富的组织脏器疾病(如肝脏、脾脏、淋巴结和骨髓等器官疾病)的诊断。由于USPIO-NPs颗粒较小而且表面包有较厚的高分子物质,能逃避血管网状内皮系统的吞噬,而具有长循环作用,可以用于肿瘤的淋巴转移、炎症和退行性疾病的诊断。临床试验证明USPIO粒子对淋巴结网状内皮系统具有亲和性,可通过淋巴管输送到淋巴结而被淋巴结内的巨噬细胞摄取,肿瘤淋巴转移部位由于淋巴细胞被肿瘤细胞取代对USPIO的摄取下降,淋巴结肿瘤转移部位与正常淋巴结的对比度得以增强,可用于头、颈部、盆腔肿瘤淋巴结转移的评价,对癌症患者的治疗和预后具有重要的临床价值[4-6]。
本课题组已采用“二步法”成功完成羧甲基壳聚糖超小超顺磁氧化铁纳米粒(O-carboxymethyl chitosans ultrasmall superparamagnetic iron oxide nanoparticles,OCMCS-USPIO-NPs)制备工艺优化筛选,理化性质表征、细胞毒性评价及体外抗吞噬细胞吞噬作用考察[7]。在此基础上,本实验以SD大鼠为模型动物,自制葡聚糖超顺磁氧化铁纳米粒(dextran-SPIO-NPs)(粒径>220 nm)为阳性对照,原子分光光度法测定OCMCS-USPIO-NPs血浆及心、肝、脾、肾、肺等组织的铁含量,考察其体内药动学特点及组织分布情况,进一步证实其抗网状内皮系统吞噬的特性,为进一步研究其在肿瘤淋巴结转移,血管造影等应用奠定基础。
1 材料与仪器
1.1 试剂与试药
OCMCS-USPIO-NPs(批号:2012-08-10,透射电镜粒径为9.5 nm,流体粒径为36.7 nm,铁含量为5.67 mg·mL-1)和dextran-SPIO-NPs(批号:20120809,透射电镜粒径为11.2 nm,流体粒径为223.4 nm,铁含量为5.82 mg·mL-1)均由本课题组研制;NH4Fe(SO4)2·12H2O、盐酸、硝酸、高氯酸、高纯乙炔(分析纯,均购自广州化学试剂有限公司)。Milli-Q超纯水。
1.2 仪器
平板加热器(上海昌安电子科技有限公司);AA6300C原子吸收光谱仪(日本岛津);TMP电子天平(德国Satorius公司);xw-80A型漩涡振荡器(江苏海门林贝仪器有限公司);低温离心机(美国THERMO LEGEND公司)。
1.3 动物
SPF级SD大鼠,♂,体质量(300±10)g,购自南方医科大学实验动物中心,合格证号:SCXK(粤)2006-0015。
2 方法
2.1 方法学考察
2.1.1 标准工作曲线的制备 精密称取NH4Fe(SO4)2·12H2O配制100 μg·mL-1的铁对照品溶液。精密量取该铁对照品溶液0,0.05,0.1,0.2,0.4,0.6,0.8,0.9,1.0,1.5,2.0,2.5 mL至西林瓶中,加入蒸馏水,空白血浆或含有20%组织的组织悬液0.25 mL和1 mL混酸(硝酸-高氯酸体积比3∶1),室温下消化24 h后用平板加热器蒸干,待冷却后加入3%的盐酸溶液1 mL溶解西林瓶中的Fe3+离子,并转入50 mL量瓶,用水稀释至刻度,摇匀,配制成浓度为0,0.1,0.2,0.4,0.8,1.2,1.6,1.8,2.0,3.0,4.0和5.0 μg·mL-1的系列铁对照品溶液。在波长248.3 nm;灯电流:8.0 mA;光谱通带:2 nm;空气流量:15.0 L·min-1;乙炔流量:2.1 L·min-1;燃烧器高度:7.5 mm的条件下测定吸光度,以吸光度为纵坐标,样品浓度为横坐标,绘制铁吸光度-浓度标准曲线。
2.1.2 样品的处理 用移液器精密量取0.2 mL血浆或各组织50 mg于西林瓶中,加入1 mL混酸(硝酸-高氯酸体积比3∶1),室温下消化24 h后用平板加热器蒸干,待冷却后加入3%的盐酸溶液1 mL溶解西林瓶中的Fe3+离子,转入100 mL量瓶,用超纯水稀释,取适量注入原子分光光度计中,空气-乙炔火焰,在248.3 nm波长处测定吸光度(A),代入标准曲线方程求出铁含量,再按照稀释比例求算血浆内的铁含量[8]。
2.1.3 回收率测定 分别配制0.1,1.4,3.2 μg·mL-1的铁对照品溶液及含有空白血浆或各组织20%的匀浆液,每个浓度3份,分别精密量取1 mL加入0.2 mL 0.1 mol·L-1盐酸溶液中,加入1 mL混酸(硝酸-高氯酸体积比3∶1),室温下消化24 h后用平板加热器蒸干,待冷却后加入3%的盐酸溶液1 mL溶解西林瓶中的Fe3+离子,转入100 mL量瓶,用超纯水稀释,取适量注入原子分光光度计中,空气-乙炔火焰,在248.3 nm波长处测定吸光度(A),代入标准曲线方程求出铁含量,计算回收率,回收率=(C测定值/C实际加入浓度)×100%。
2.1.4 日间精密度考察 分别配制高、中、低浓度(3.2,1.4和0.1 μg·mL-1)的铁对照品溶液,精密量取1 mL加入0.2 mL 0.1 mol·L-1盐酸溶液、血浆或心、肝、脾、肺和肾的组织溶液中,按“2.1.3”项下方法处理,每个浓度 6 份样品,分别在同一天内不同时间点连续测定5次和连续测定 5 d,每天1次,计算日内与日间精密度。
2.2 药动学实验
取SD大鼠,♂,30只,随机分成空白组(6只)、OCMCS-USPIO-NPs组(12只)和dextran-SPIO-NPs组(12只),2组给药组内部随机平均分成:盐水及Fe 5.87 mg·kg-1和13.27 mg·kg-1的2种纳米粒,并于0,0.25,0.5,1,2,4,6,8,12,24 h后眼底静脉丛采血0.5 mL,置于肝素钠化的EP管中,5 000 r·min-1离心10 min,取0.2 mL上清液测定铁含量。
2.3 组织分布考察
取SPF级SD大鼠100只,随机分成空白对照组(4只)、dextran-SPIO-NPs组(高、低浓度组各24只)、OCMCS-USPIO-NPs组(高、低浓度组各24只)。禁食12 h后(自由饮水),空白对照组尾静脉一次给予1.2 mL生理盐水,给药组分别尾静脉一次给予5.90 mg·kg-1或13.27 mg·kg-1的dextran-SPIO-NPs或OCMCS-USPIO-NPs,并于给药后的2,4,6,8,10,12,14,16 h处死动物(每个时间点3只),取心、肝、脾、肺、肾并用生理盐水洗净残血,滤纸吸干水分后准确称取50 mg各组织,测定各时间点的组织铁含量。
普鲁士蓝染色评价组织分布情况:取空白组和16 h时高浓度两给药组大鼠的心、肝、脾、肺、肾,于10%福尔马林溶液中固定24 h。取出固定后的标本,修成4 mm3小块,流水冲洗4 h,依次加入75%,80%,90%,95%的乙醇溶液各1 h,再用100%乙醇脱水3次,每次20 min;二甲苯透明2次,每次10 min;58 ℃石蜡浸泡1 h,62 ℃软蜡浸透 30 min,硬蜡包埋后常温保存。切片前30 min,蜡块置于4 ℃预冻,载玻片采用多聚赖氨酸处理后37 ℃烘干,常规石蜡4 μm切片,组织切片常规脱蜡至水,2%亚铁氰化钾、2%盐酸水溶液混合液(1∶1)染色5~30 min,蒸馏水充分水洗,0.5%伊红水溶液复染30~60 s。经各梯度乙醇脱水,二甲苯透明,树胶封固。三价铁呈蓝色,其他组织浅红色,光学显微镜观察并拍照。
2.4 数据处理
血铁浓度以各时间点血浆铁浓度均值减去各时间点空白血浆铁浓度的均值表示,绘制血药浓度(C)-时间(t)曲线(±s ),将血药浓度时间数据经DAS 2.1.1药动学统计软件处理,并进行方差分析,双单侧t检验及(1-2α)%置信区间法评价OCMCSSPIO-NPs组与dextran-SPIO-NPs组的生物等效性,由于考察指标数据有方差不齐的情况,故将AUC(0-∞)经对数转换后进行方差分析,用双单侧t检验进行生物等效性判断,MRT采用非参数法秩和检验统计分析,P<0.05为有显著性差异。
3 结果
3.1 药动学考察
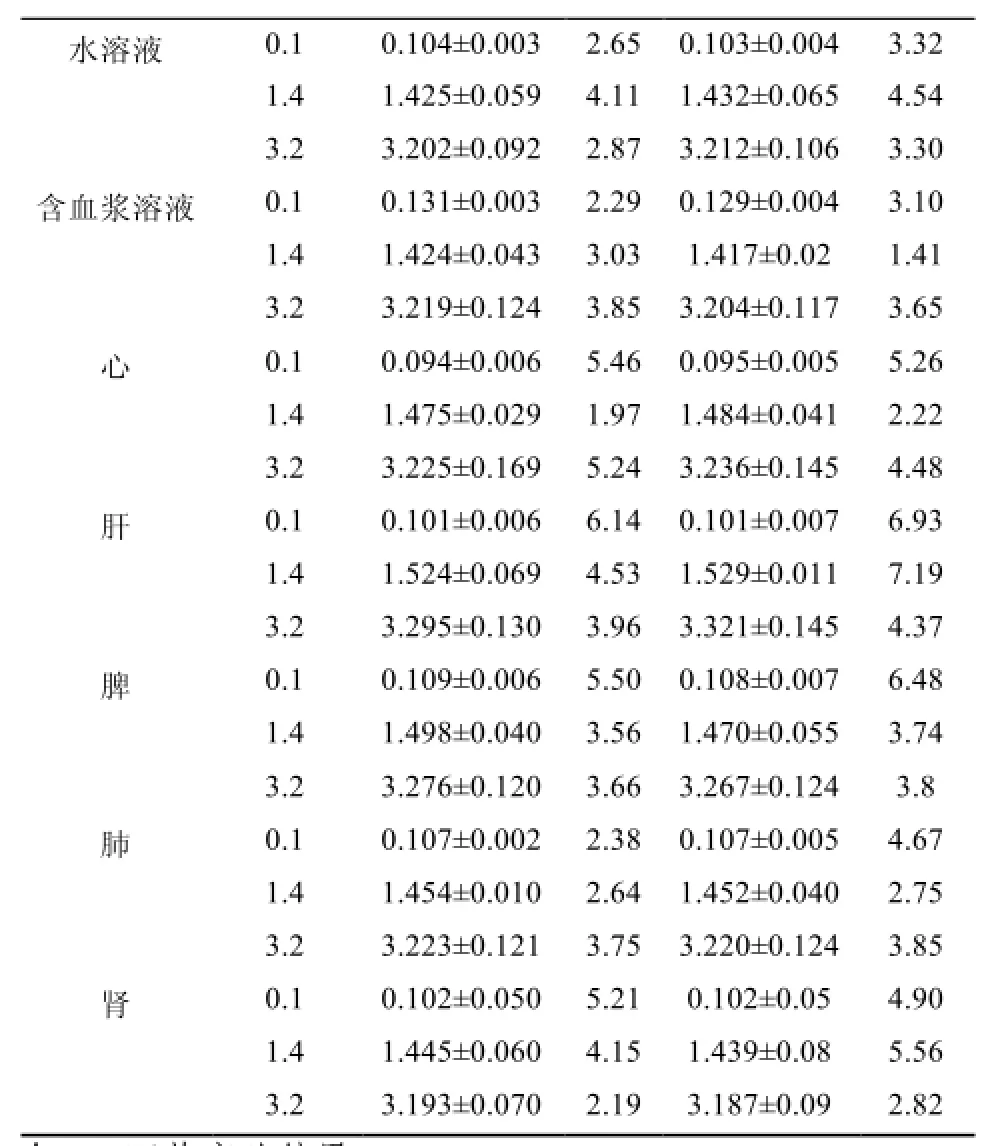
3.1.1 方法学考察结果 在0.1~5 μg·mL-1内,在规定的测定条件下,铁对照品酸处理溶液、含铁对照品的血浆和各组织匀浆液中,铁对照品酸处理液的原子吸收光度值与铁浓度线性相关,其标准曲线,线性范围及相关系数见表1;高、中、低浓度铁对照品溶液(3.2,1.4,0.1 μg·mL-1)在水溶液、血浆溶液及心、肝、脾、肺和肾等组织的日间、日内精密度见表2,回收率测定结果见表3。由表2、表3可见日内、日间精密度RSD均<10%(n=5),各浓度的回收率均在80%~120%,证实该测定方法是可靠的。
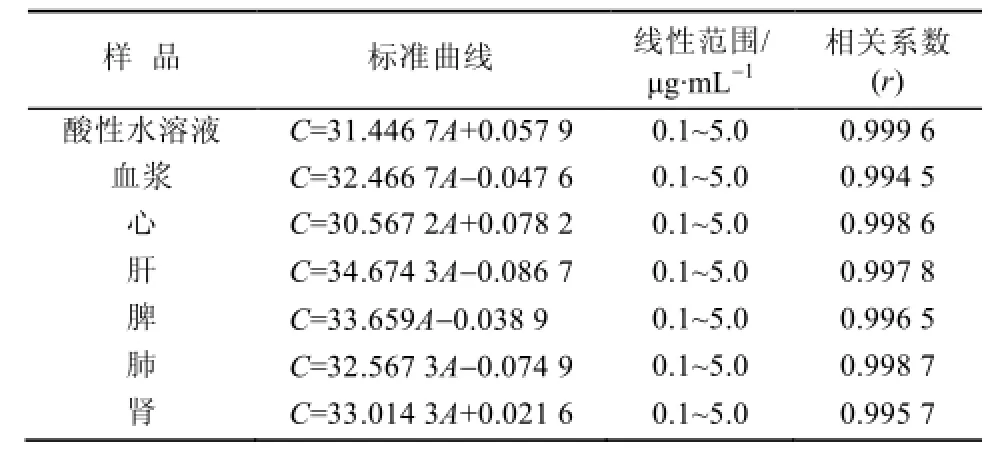
表1 含铁标准品各组织样品的标准曲线、浓度范围和相关系数(n=6)Tab 1 Standard curves, linear ranges and correlation coefficient of iron standard in organ samples (n=6)

表2 精密度实验结果(n=5)Tab 2 Results of precision test (n=5)
?

表3 回收实验结果(n=6)Tab 3 Results of recovery tests(n=6)

?
3.1.2 药动学结果 2组大鼠分别尾静脉给予高、低浓度的dextran-SPIO-NPs、OCMCS-USPIO-NPs,血药浓度随时间变化的情况见图1。图中血铁浓度低于空白血浆铁浓度的点均以血铁浓度为0表示,虚线表示本底血浆的波动,实线是给予高、低浓度的纳米粒后,扣除本底铁波动得到的药时曲线图。经DAS2.1.1软件处理,分别求出统计矩参数,OCMCS-USPIO-NPs组与dextran-SPIO-NPs组做两样本t检验,结果见表4。

图1 尾静脉给予生理盐水及高、低浓度的OCMCS -USPIO-NPs(A)、dextran-SPIO-NPs(B)后测得的大鼠血浆铁浓度药时曲线(n=6,x±s )Fig 1 Concentration-time curve of iron in rats plasma following high or low dose of OCMCS-USPIO-NPs(A), dextran-SPIONPs(B) or physiological saline injected through tail vein(n=6,x±s )
表4 尾静脉分别给予高、低浓度的OCMCS-USPIO-NPs或dextran-SPIO-NPs后测得的大鼠血浆铁浓度的主要药动学参数(n=6,±s )Tab 4 Main pharmacokinetic parameters of iron in rats’ plasma following high or low dose of OCMCS-USPIO-NPs or dextran-SPIO-NPs injected through tail vein(n=6,±s )

表4 尾静脉分别给予高、低浓度的OCMCS-USPIO-NPs或dextran-SPIO-NPs后测得的大鼠血浆铁浓度的主要药动学参数(n=6,±s )Tab 4 Main pharmacokinetic parameters of iron in rats’ plasma following high or low dose of OCMCS-USPIO-NPs or dextran-SPIO-NPs injected through tail vein(n=6,±s )
?

?
3.2 组织分布考察
dextran-SPIO-NPs组、OCMCS-USPIO-NPs组的组织分布图见图2。组织分布考察将0 h内各大鼠组织内铁含量为基数,将(各个时间点铁含量-0 h组织内铁含量)/0 h组织内铁含量,求得组织相对铁含量,消除背景干扰,对组织情况进行评价。其中组织铁中含量与组织本身铁含量差低于1%记做1%,表示脏器内没有磁性纳米粒滞留,给药组与空白组铁含量相近;数值>1%时,纳米粒在该脏器内蓄积,>100%时有大量蓄积。

图2 尾静脉给予不同剂量dextran-SPIO-NPs(A)和OCMCS-USPIO-NPs(B)后各时间点大鼠心、肝、脾、肺和肾内的铁含量(n=3,±s ) A-低浓度(5.90 mg·kg-1);B-高浓度(13.27 mg·kg-1)Fig 2 Retention of iron in rats’hearts, livers, spleens lungs and kinneys versus time after one intravenous injection of different dosage of dextran-SPIO-NPs (A) or OCMCS-USPIO- NPs(n=3,±s ) A-low concentration(5.90 mg·kg-1); B-high (13.27 mg·kg-1) concentration
粒径是决定USPIO-NPs体内分布的重要因素,粒径<50 nm的OCMCS-USPIO-NPs理论上具有部分逃避肝、脾吞噬的特性,而粒径>100 nm的dextran-SPIO-NPs很可能被肝、脾吞噬。组织分布结果表明,2组主要分布于肝、脾部位。就dextran-SPIO-NPs组而言,低浓度组在2~8 h肝、脾吞噬了大量的纳米粒(>150%),16 h肝脏内仍有少量纳米粒(约37%),但脾脏铁含量降至正常水平(约5%);其高浓度组2~16 h肝、脾内始终存在大量的纳米粒(200%左右)。对于OCMCS-USPIO-NPs组,低浓度时肝、脾吞噬量分别在100%(2~8 h)和30%(2~4 h)左右,16 h铁含量降至正常水平(1%左右),其他脏器未见明显的吞噬;高浓度时肝、脾对纳米粒的吞噬量上升至110%~190%(2~16 h)和60%~120%(2~16 h),心脏发现有少量吞噬(14%左右),这可能是由于药物主要集中于血液中,导致心脏内残留血液中铁含量上升,其他脏器未见明显的吞噬。
此外,可以从数据中分析出肝、脾累积吞噬量的变化规律:dextran-SPIO-NPs组肝脏累积吞噬量的均值随剂量的倍增而成倍的增加,从501%上升至1 004%,而脾脏的累积吞噬量均值的增加远远大于剂量的倍增,从364%上升至1 013%,OCMCS-USPIO-NPs组遵从同样的规律,肝脏的从276%上升至585%,脾脏的从56.1%上升至315.4%。这说明低浓度时纳米粒大多是由肝脏吞噬的,并且高浓度下仍然未达到吞噬的饱和状态,而脾脏在低浓度时仅仅吞噬少量的纳米粒,却在高浓度时被调动起来,参与吞噬更多的纳米粒,导致总吞噬量随剂量的倍增更快的增加(dextran-SPIO-NPs组从865%上升至2018%;OCMCS-USPIO-NPs组从332%上升至900%)。
空白组大鼠和高浓度2组给药组大鼠16 h的各组织普鲁士蓝染色切片图见图3。空白组(1~5组)大鼠心、肝、脾、肺和肾组织普鲁士蓝染色均为阴性;dextran-SPIO-NPs组(6~10组),大鼠肝、脾组织可见大量的普鲁士蓝铁染色,呈深蓝色。而心、肾和肺组织普鲁士蓝染色呈阴性,可能是由于dextran-SPIO-NPs粒径大,被血管网状内皮系统的枯否细胞大量吞噬,导致在肝、脾等含枯否丰富的组织大量富集,使致其体内半衰期短,表观分布容积小;在OCMCS-SPIO-NPs组(11~15组),心、肝、脾、肺和肾组织普鲁士蓝染色后,肝、脾存在少量蓝色的普鲁士蓝铁染色散点,其颜色较浅,呈淡蓝色,说明有少量OCMCS-SPIONPs被含枯否细胞丰富的肝、脾摄取;大鼠肺切片普鲁士蓝染色后,只有极少量的普鲁士蓝染色的蓝色散点,可能由于OCMCS- USPIO-NPs粒径小,半衰期长,分布广。而dextran-SPIO-NPs由于粒径较大,易被网状内皮系统摄取,在含枯否丰富的血管网状内皮系统如肝、脾等组织普鲁士蓝染色深于OCMCS-USPIO-NPs,其结果与原子分光光度法测定组织内铁含量测定结果一致也与我们前期体外抗吞噬细胞吞噬结果相一致[6]。
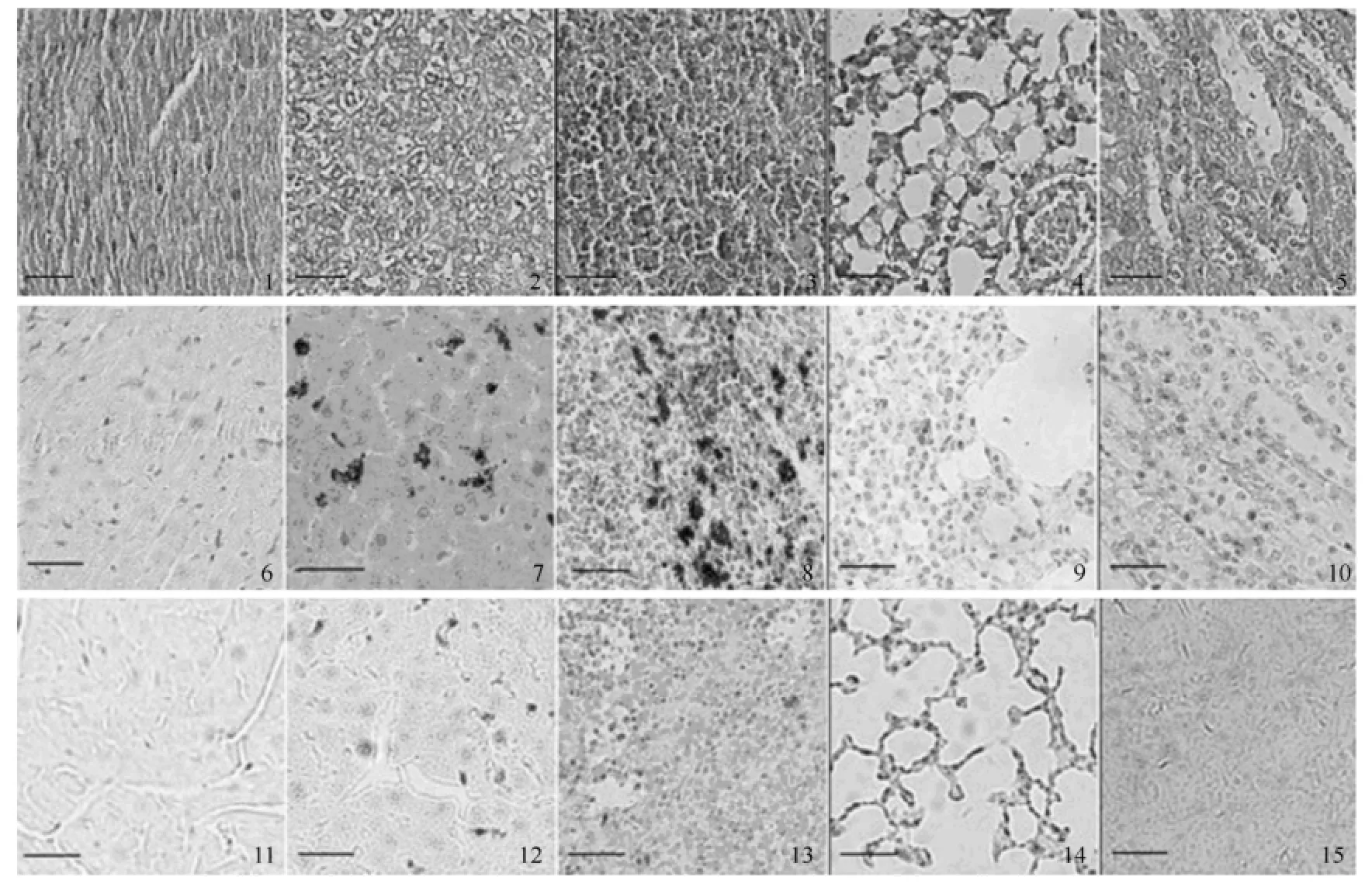
图3 空白组、dextran-SPIO-NPs组、OCMCS-USPIO-NPs组和dextran-SP10-NPs组大鼠的心、肝、脾、肺和肾的普鲁士蓝染色图(200×,标尺为5 μm) 1~5-空白组的心、肝、脾、肺和肾;6~10-dextran-SPIO-NPs组的各脏器;11~15-OCMCS-USPIO-NPs组的各脏器Fig 3 Prussian blue staining of SD rats’ heart, liver, spleen, lung and kidney in control, dextran-SPIO-NPs, OCMCS-USPIO-NPs and dextran-SP10-NPs groups 1-5-heart, liver, spleen, lung and kidney of control group; 6-10-the same organs of dextran-SPIO-NPs group; 11-15-the same organs of OCMCSUSPIO-NPs group(200×, the scale bars are 5 μm)
4 讨论
由图1可知,基础血浆铁浓度(空白组血浆铁浓度)随时间变化而波动,1 h时基础铁浓度出现释放峰,之后缓慢下降,4 h以后在5 mg·L-1左右波动,24 h时恢复初始水平。6只空白鼠基础血浆铁浓度各时间点间具有显著性差异(P<0.05),说明空白基底随时间变化存在波动。动物体内本身含有铁,自体对铁的调节以及个体差异、饮水对铁的补充都会影响药动学特征。从实验结果可知,大鼠基础血浆浓度1 h有释放峰,这可能是由于失血过多引起的体内铁调节:机体调动了储备的铁,造成了暂时的铁浓度激增。为了消除自体铁浓度的波动,测定血浆中铁含量采用空白鼠(注射了生理盐水的大鼠)在每个时间点与实验鼠同步采血,用同一时间点的实验鼠血铁浓度减去空白鼠血铁浓度的方法,将因本底波动带来的血浆铁浓度波动扣除。消除本底的干扰后,药时曲线仍具有一定的趋势,从图1可以看出,低浓度组2种纳米粒的药时曲线变化与铁本底的波动接近,由药动学数据的统计结果可知:相对于dextran-SPIO-NPs (t1/2=2.2 h),无论是高浓度还是低浓度组,OCMCSUSPIO-NPs表现出长循环的特征,半衰期(t1/2)显著延长(P<0.05),药时曲线下面积(AUC)显著性增加(P<0.05),体内滞留时间(MRT)显著性延长,这可能是dextran-SPIO-NPs粒径>100 nm,进入体内后迅速被肝、脾吞噬,体内半衰期短和AUC小,而粒径<50 nm的OCMCS-USPIO- NPs部分逃避了肝、脾的吞噬,在血液中维持了较长的时间和较高的浓度,因此半衰期延长,肝、脾等网状内皮系统普鲁士蓝颜色变浅,可通过被动靶向机制,实现肿瘤淋巴造影,该结果与文献报道一致[3]。
REFERENCES
[1] GUPTA A K, GUPTA M. Synthesis and surface engineering of iron oxide nanoparticles for biomedical applications [J]. Biomaterials, 2005, 26(6): 3995-4021.
[2] SUN C, LEE J S H, ZHANG M Q. Magnetic nanoparticles in MR imaging and drug delivery [J]. Adv Drug Deliv Rev, 2008, 60(4): 1252-1265.
[3] CHATTERJEE J, HAIK Y, CHEN C J. Size dependent magnetic properties of iron oxide nanoparticles [J]. J Magn Magn Mater, 2003, 257(1): 113-118.
[4] COROT C, ROBERT P, IDEE J M, et al. Recent advances in iron oxide nanocrystal technology for medical imaging J]. Adv Drug Deliv Rev, 2006, 58(14): 1471-1504.
[5] MOGHIIMI S M, HUNTER A C, MURRAY J C. Longcirculating and target-specific nanoparticles: theory to practice [J]. Pharmacol Rev, 2001, 53(2): 283-318.
[6] PLASSAT V, MARTINA M.S, BARRATT G, et al. Sterically stabilized superparamagnetic liposomes for MR imaging and cancer therapy: Pharmacokinetics and biodistribution [J]. Int J Pharm, 2007, 344(1/2): 118-127.
[7] FAN C X, GAO W H, CHEN Z L, et al. The synthesis and characterization of O-carboxymethyl-chitosan ultra-small superparamagnetic iron oxide nanoparticles [J]. Chin J Mod Appl Pharm (中国现代应用药学), 2010, 27(9): 825-831.
[8] LIU J Y, ZHANG Y, WANG K P. The relationship between the pharmacokinetic parameters and dose of Angelica sinensis polusaccharide-iron complex in rats [J]. Chin Hosp Pharm J(中国医院药学杂志), 2012, 303(3): 183-185.
Pharmacokinetics, Tissue Distribution of O-Carboxymethyl Chitosans Ultrasmall Superparamagnetic Iron Oxide Nanoparticles in Rats
FAN Caixia1, CHEN Zhixi1, GAO Wenhui2, LAI Shuizhao1, ZHENG Jinkun1
(1.Affiliated Yuebei People’s Hospital, Shantou University, Medical College, Shaoguan 512026, China; 2.Affiliated Cancer Hospital of Guangzhou Medical College, Guangzhou 510005, China)
OBJECTIVE To study pharmacokinetics features and tissue distribution of OCMCS-USPIO-NPs in SD rats in vivo to provide evidence for their clinical use in future. METHODS SD rats were divided into three groups: blank group, OCMCMS-USPIO-NPs group and dextran-SPIO-NPs group, then iron content in plasma and different tissue including heart, liver, spleen, lung and kidney were determined by atomic absorption spectroscopy. The iron concentration-time in plasma and tissues was drawn. The plasma concentration-time data of iron were analyzed by DAS 2.1.1 statistical software and the main pharmacokinetics parameters was caculated. Statistics analysis combined with Prussian blue staining were used to demonstrate OCMCS-USPIO-NPs and dextran-SPIO-NPs tissue distribution difference in rats. RESULTS There was significant difference between OCMCS-USPIO-NPs group and dextran-SPIO-NPs group in the main pharmacokinetics parameters of iron, including AUC, MRT, t1/2, CL, V2(P<0.05), the t1/2in OCMCS-USPIO-NPs group were longer than 7 h in high or low dose group. Compared with dextran-SPIO-NPs group, not only statistical analysis but also Prussian blue staining results indicated the iron content in liver, spleen and lung in OCMCS-USPIO-NPs group were significant lower than dextran-SPIO-NPs. CONCLUSION OCMCS-USPIO-NPs can escape the RES capture to gain longer-circulation time.
ultrasmall superparamagnetic iron oxide nanoparticles; atomic absorption spectroscopy; pharmacokinetics; tissue distribution
R969.1
A
1007-7693(2013)10-1088-07
2012-12-14
广东省自然科学基金博士启动项目(S2011040003279);韶关市科学计划项目[韶科(卫)2011-20];韶关市卫生局项目(Y11029)
范彩霞,女,博士,主管药师 Tel: (0751)8101272 E-mail: mydream0509@qq.com
