益智多糖含量测定
2013-03-06赵祥升董娜冯锦东杨美华
赵祥升,董娜,冯锦东,杨美华,3
(1.中国医学科学院药用植物研究所海南分所,海南 万宁 571533;2.河南科技学院生命科技学院,河南 新乡 453003;3.中国医学科学院药用植物研究所,北京 100193)
益智多糖含量测定
赵祥升1,董娜2,冯锦东1,杨美华1,3
(1.中国医学科学院药用植物研究所海南分所,海南 万宁 571533;2.河南科技学院生命科技学院,河南 新乡 453003;3.中国医学科学院药用植物研究所,北京 100193)
目的 研究益智中多糖含量的测定方法。方法 水提醇沉法提取粗多糖,Sevage法除蛋白,H2O2脱色,流水透析和冷冻干燥制备多糖。1-苯基-3-甲基-5-吡唑啉酮(PMP)柱前衍生,HPLC测定其单糖组成。以益智精制多糖测得多糖对葡萄糖的换算因子,苯酚-硫酸法测定益智中多糖的含量。结果 益智多糖由葡萄糖、鼠李糖、半乳糖、甘露糖和阿拉伯糖5种单糖组成。益智多糖含量为12.91%,RSD=4.72%(n=5),平均加样回收率为99.1%,RSD为4.57%(n=5)。结论 该法简便,快捷,可用于益智多糖的含量测定。
益智;多糖;单糖;含量测定
多糖(polysaccharide)是由醛糖和酮糖通过糖苷键连在一起的聚合物,广泛分布于自然界中,是一类重要的活性物质。近年来,由于植物多糖具有免疫调节、抗肿瘤、抗衰老、降血糖等生物活性,不良反应小等优点[1-3],多糖的研究呈现增多的趋势。植物中多糖含量测定常用的方法有:比色法如咔唑-硫酸法[4]、苯酚-硫酸法[5]、蒽酮-硫酸法[6]、3,5-二硝基水杨酸比色法[7]、斐林滴定法[8];高效液相色谱法(HPLC)[9];气相色谱法(GC)[10];薄层扫描法(TLCS)[11]法;高效毛细管电泳法(HPCE)[12]等。HPLC和HPCE需要特殊的仪器设备,GC需要衍生化。因此最简便、常用的是苯酚硫酸法和蒽酮硫酸法,其原理是多糖在硫酸作用下水解成单糖分子,并迅速脱水生成糖醛衍生物,再与苯酚或蒽酮缩合成有色化合物,在适当的波长下和一定浓度范围内,吸收值和糖浓度呈线性关系,从而可间接测定多糖含量。
益智(Alpinia oxyphylla Miq.)为我国传统的药食两用资源,其味辛,性温,具有暖肾、固精、缩尿、温脾止泻摄唾的功效[13]。益智中主要含有挥发油、黄酮和糖类等活性成分,但有关其多糖的研究报道相对较少。汪金玉等[14]以果糖为对照品,紫外分光光度法测定了海南6个地区益智种子和果壳中低聚糖的含量,益智壳中的低聚糖含量(1.28%~2.48%)高于果仁(0.50%~1.14%)。吴德玲等[15-16]用苯酚-硫酸显色法,比较了海南、广东、广西等不同来源益智药材果实及种子、果壳中多糖的含量,结果表明不同来源的益智中果实中多糖含量差异不大(8.03%~8.62%);益智种仁中多糖含量(8.25%)高于果壳(4.66%)。植物中多糖的测定是以某一种单糖(如:葡萄糖、半乳糖等)为对照品,苯酚(或蒽酮)-硫酸比色法测定[17],该方法对于匀多糖比较合适。但植物多糖大多都是杂多糖,如果用某一种单糖作标曲,则会造成较大的误差,益智多糖含量测定也存在这些问题。有关益智多糖的单糖组成、多糖对单糖之间换算因子的研究作者还未见报道。本实验通过提纯、精制多糖,确定了益智多糖的单糖组成,以精制的多糖测得益智多糖对葡萄糖的换算因子,用于校正益智中多糖含量的测定,为益智质量控制和综合利用提供了科学依据。
1 材料与仪器
1.1 材料与试剂
益智来自海南省五指山市,样品由中国医学科学院药用植物研究所海南分所冯锦东研究员鉴定为益智(Alpinia oxyphylla Miq.)果实;单糖:D-葡萄糖(Glu,批号:20110721),L-鼠李糖(Rha,批号:20101215),D-半乳糖(Gal,批号:20110627),D-甘露糖(Man,批号:20100506),L-阿拉伯糖(Ara,批号:20120613),D-木糖(Xyl,批号:20090814)均购自Solarbio公司,纯度均>99.0%;乙腈为色谱纯,其余试剂均为分析纯,水为Milli-Q超纯水。
1.2 仪器与设备
Waters 1525高效液相色谱仪(美国Waters公司,带紫外检测器);UV-2450紫外可见分光光度计(日本岛津);KQ-500DE型超声波清洗器(昆山市超声仪器有限公司);数显恒温水浴锅HH-6(国华电器有限公司);台式高速离心机141(Thermo electron corporation);XS105DU十万分之一电子天平(上海托利多有限公司);AL104-1C万分之一电子天平(上海托利多有限公司);Milli-Q Academic A10超纯水系统(美国Millipore公司);FD-2A真空冷冻干燥机(北京博医康实验仪器有限公司)。
2 方法与结果
2.1 益智精制多糖的制备
称取已干燥的益智粉末100 g,加入石油醚(60~90 )500℃ mL,加热回流1 h,提取2次,4 000 r·min-1离心10 min,弃去上清液,挥干石油醚,加入80%乙醇500 mL,回流提取2次,每次2 h,过滤,药渣挥尽乙醇后,沸水提取2次(料水比为1∶20),每次提取2 h,离心(5 000 r·min-1,10 min),合并上清液,浓缩至100 mL,加入无水乙醇使醇含量达到80%,4 ℃冰箱过夜,过滤,真空冷冻干燥,得粗多糖。
粗多糖以纯水复溶,与等体积Sevage试剂[三氯甲烷-正丁醇(4∶1)]混合,振荡,离心,收集上清液,上清液重复上述过程数次,用考马斯亮蓝法确认无蛋白。浓缩液加入体积分数为30%的H2O2原液适量,用0.5 mol·L-1的NaOH调节pH至8~9,45 ℃水浴4 h,将多糖脱色液至于透析袋中。先用流水透析1 d,再用纯水透析2 d,透析后过滤浓缩,加乙醇使醇含量至80%,4 ℃冰箱过夜,过滤,滤渣依次用无水乙醇,丙酮,乙醚洗涤3次,真空冷冻干燥,得精制多糖。
益智精致多糖的13C-NMR图谱(溶剂为D2O)见图1。化学位移98~110的信号为糖的端基碳信号,65~85的为糖氧环的C2~C4信号,60左右为C5或C6信号,18~20的为甲基五碳糖的C6信号,除上述糖信号外,未见其他信号,由此可判断精致的益智多糖中基本不含其他杂质[18-19]。
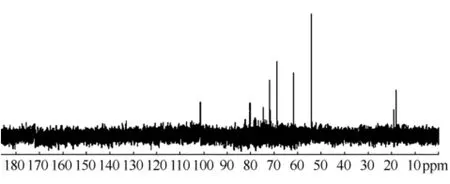
图1 益智精致多糖13C-NMR图Fig 113C-NMR spectrum of refined polysaccharides in Alpinia oxyphylla Miq
2.2 单糖组成分析
2.2.1 对照品溶液的制备 取各单糖对照品用超纯水配成2 mmol·L-1的混合水溶液,同时每单糖也配制为相同浓度的对照品溶液。
2.2.2 PMP衍生化法测定精制多糖的单糖组成 按文献方法[20],称取10 mg益智精制多糖置于具塞试管中,加2 mol·L-1H2SO4溶液2.0 mL,封管后于110 ℃水解6 h,得水解样品溶液。用4 mol·L-1NaOH水溶液中和至pH值为7.0,并以纯化水稀释到5.0 mL,离心,取上清液待衍生化。将单糖对照品、混合单糖对照品溶液及益智多糖水解样品液各取200 μL分置于1.5 mL离心管中,然后向离心管中依次加入0.5 mol·L-11-苯基-3-甲基-5-吡唑啉酮(PMP)甲醇溶液100 μL和0.3 mol·L-1氢氧化钠溶液100 μL,混匀后置于70 ℃水浴中加热反应30 min,取出室温放置10 min;再加入0.3 mol·L-1盐酸溶液100 μL中和,混匀后用等体积乙酸异戊脂萃取,振摇,离心10 min,小心弃去有机层,再用乙酸异戊脂萃取1次,再加等体积的氯仿,振摇,离心10 min,弃去氯仿相得到上层。将水相定容至1.0 mL,过0.45 μm微孔虑膜后,供HPLC进样分析。
2.2.3 色谱条件 色谱柱为Waters Sunfire C18(150 mm×4.6 mm,5 μm);流动相:乙腈-0.1 mol·L-1KH2PO4(用NaOH调节pH至6.8)(16∶84),等度洗脱;流速:0.8 mL·min-1;柱温:35 ℃,检测波长:250 nm,进样量:20 μL。
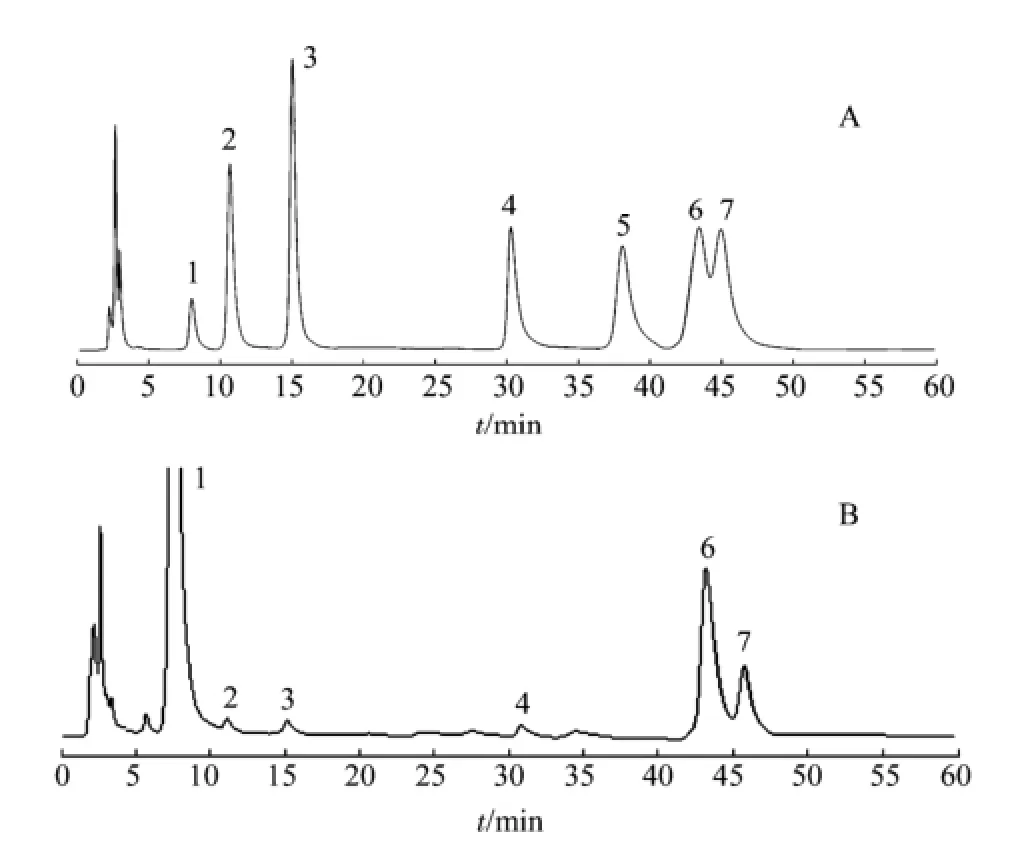
图2 单糖混合对照品衍生化(A)和益智多糖(B)的色谱图1-PMP;2-D-甘露糖;3-L-鼠李糖;4-D-葡萄糖;5-D-木糖;6-D-半乳糖;7-L-阿拉伯糖Fig 2 HPLC chromatograms of PMP derivatization of monosaccharides reference substances(A) and polysaccharide(B) 1-PMP; 2-Man; 3-Rha; 4-Glu; 5-Xyl; 6-Gal; 7-Ara
2.2.4 单糖组成分析 益智精制多糖经降解、PMP衍生化后,进液相色谱分析,在混合标准单糖同样的反应和测定条件下,根据标准单糖的保留时间确定益智多糖由Glu,Rha,Gal,Man,Ara 5种单糖组成。
2.3 益智多糖含量测定
2.3.1 样品溶液的制备 称取益智粉0.5 g(n=5),加入25 mL石油醚加热回流提取2次,每次1 h,挥干溶剂;滤渣用80%乙醇25 mL加热回流提取2次,每次2 h,挥干乙醇;加25 mL蒸馏水,沸水浴中回流2 h,重复3次,抽滤,合并滤液,定容到100 mL量瓶;吸取该溶液1.0 mL,加无水乙醇4.0 mL,4 ℃冰箱放置过夜,析出沉淀,6 000 r·min-1离心10 min,吸出上清液,多糖沉淀以少量的80%乙醇洗涤,挥干乙醇;将多糖沉淀用蒸馏水溶解,定容到500 mL量瓶中,得样品溶液。
2.3.2 对照品溶液的制备 取葡萄糖适量,105 ℃下烘至恒重,精密称取10.25 mg,纯水定容到100 mL量瓶中,为对照品储备液。
2.3.3 最大吸收波长的确定 分别取样品溶液、对照品溶液和纯水各1 mL置于具塞试管中,分别加入1 mL 5%重蒸苯酚和5 mL的浓硫酸混匀,静止20 min后放入沸水浴中反应10 min,迅速取出置冰浴中冷却至室温,在400~600 nm内扫描确定最大吸收波长,对照品和样品溶液在484 nm处有最大的吸收峰。
2.3.4 标准曲线的绘制 精密吸取对照品储备液1.0,2.0,4.0,8.0,16.0,32.0 mL定容至50 mL的量瓶中,配成系列标准溶液。精密吸取系列标准溶液1 mL,以下操作同“2.3.3”,在484 nm处测定吸光度,绘制标准曲线,得回归方程为:Y=103.46X+0.243 8(Y为每管中葡萄糖的含量,X为吸光度),r=0.999 9,葡萄糖浓度在2.05~65.60 μg·mL-1内线性关系良好。
2.3.5 换算因子的测定 精密称取益智精制多糖10.0 mg以水定容于250 mL的量瓶中,混匀,量取1 mL于具塞试管中,照“2.3.3”项下方法测定吸光度,计算多糖溶液中葡萄糖的浓度,按f=W/C·D计算换算因子,其中W为多糖质量(mg),C为多糖中葡萄糖浓度,D为稀释倍数。测得换算因子f=2.58(n=3),RSD=1.17%。
2.3.6 仪器精密度、重复性和稳定性实验 取同一浓度的葡萄糖溶液在上述反应条件下显色,测定吸光度(n=5),记录吸光度,考察仪器精密度;另取样品5份,精密称重,分别按“2.3.1”项下的方法制备溶液,显色测定吸光度,考察重复性;取“2.3.1”项下的样品溶液,显色,分别在0,2,4,8 h检测吸光度(n=3),计算吸光度的RSD(%),考察其溶液稳定性;结果吸光度的RSD均<5%,表明仪器精密度、方法重复性较好,样品溶液在8 h内稳定。
2.3.7 加样回收实验 精密称取5份益智粉末0.25 g,加入精制多糖35 mg,按照“2.3.1”项下制备溶液,按“2.3.3”项下显色并在484 nm下测定吸收值,计算回收率为99.1%,RSD为4.57%。
2.3.8 益智多糖含量测定 精密吸取样品溶液(n=5)1 mL于具塞试管中,按照苯酚-硫酸法测定吸光度,外标法计算样品液中葡萄糖的浓度,按照下面公式计算益智中多糖的含量。样品中含量(%)=(CDf/WR)×100%。式中:C为样品液中葡萄糖的浓度,D为稀释倍数,f为换算因子,W为样品质量,R为回收率,结果益智多糖含量为12.91%,RSD=4.72%。
3 讨论
本研究将益智多糖精制、纯化,确定了多糖对葡萄糖的换算因子,为以后益智多糖含量测定提供了科学依据。有文献[14-16]研究益智仁中多糖含量低于本实验结果,可能与没有利用换算因子消除单纯以葡萄糖为标准计算多糖带来的误差和取材的部位有关。本研究在制备精制多糖除蛋白时,利用Sevage法并结合考马斯亮蓝法确认,醇沉、流水透析等方法并结合测定益智精制多糖13C-NMR谱,确认了其基本不含其他杂质。该方法为益智多糖含量测定、质量控制等研究提供了基础。
REFERENCES
[1] SCHEPETKIN I A, QUINN M T. Botanical polysaccharides: Macrophage immunomodulation and therapeutic potential [J]. Int Immunopharmacol, 2006, 6(3): 317-333.
[2] TAO Y W, TIAN G Y. Studies on the physicochemical properties, structure and antitumor activity of polysaccharide YhPS-1 from the root of Cordalis yanhusuo Wang [J]. Chin J Chem, 2006, 24(2): 235-239.
[3] GE Y, DUAN Y F, FANG G Z, et al. Study on biological activities of Physalis alkekengi var. francheti polysaccharide [J]. J Sci Food Agric, 2009, 89 (9): 1593-1598.
[4] HUANG R S. Advances in studies on analytical methods of polysaccharides in medical plants [J]. China Pharm(中国药师), 2005, 8(1): 68-70.
[5] ZHAO X S, ZHAO Y K, SHI F H, et al. Effects of different processing methods on the content of polysaccharide in the root of Platycodon grandiflorum [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2010, 27(11): 983-986.
[6] ZHANG Z F, JIN J, SHI L G. The analysis method of polysaccharides in Ramulus mori [J]. China J Mater Med(中国中药杂志), 2008, 33(4): 462-464.
[7] YANG H, ZHANG Y W, ZHANG L. Determination of polysaccharides in epimedium with DNS Method [J]. Tianjin Chem Ind(天津化工), 2012, 26(1): 60-62.
[8] YU C, DING G Q, YU S, et al. The method research of lentinan determination [J]. China Public Health(中国公共卫生), 2000, 16 (3): 245-246.
[9] CASTERLINE J L, OLES C J,YUOH K U. Measurement of sugars and starches in foods by a modification of the AOAC total dietary fiber method [J]. J AOAC Int, 1999, 82(3): 759-765.
[10] TU J H, CHEN W G, WANG L, et al. Monosaccharide composition analysis and compare the content of polysaccharides in different harvest yime from Trichosanthis Radix [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2011, 28(7): 666-668.
[11] DENG G D, YU J P, ZHENG B S. Determination of monosaccharides hydrolyzed from tea polysaccharides by dual-wavelength thin-layer scanning technique [J]. J Southwest Agricul Univ: Nat Sci(西南农业大学学报:自然科学版), 2004, 26(6): 703-705.
[12] MA Q, HE Y Z, XIAO X Z, et al. Separation of saccharides in tobacco by capillary zone electrophoresis [J]. Chin J Chromatogr(色谱), 2002, 20(3): 230-232.
[13] Ch.P(2010)VolⅠ(中国药典2010版.一部) [S]. 2010: 273-274.
[14] WANG J Y, CHEN K, LIN L, et al. Determination of oligosaccharides in the different parts of Alpinia oxyphylla [J]. Res Pract Chin Med(现代中药研究与实践), 2009, 23 (1): 40-42.
[15] WU D L, JIN C S, MA K,et al. Quantitative determination of the polysaccharide content in Fructus Alpinia Oxyphylla [J]. Anhui Med Pharm J(安徽医药), 2007, 11(3): 218-219.
[16] WU D L, JIN C S, KOU W Q, et al. Comparative study of components in different parts of Alpinia oxyphylla [J]. Chin J Exp Tradit Med Form(中国实验方剂杂志), 2007, 13(4): 1-3.
[17] YANG Y Q, JIANG Q H, DING P T. Advances in studies on analytical methods of polysaccharides in plant [J]. Chin Tradit Herb Drugs(中草药), 2011, 42 (6): 1239-1242.
[18] SUN L, QIAO S Y, ZHAO Y M. Studies on content determination of polysaccharides in Periploca forrestii [J]. China J Mater Med(中国中药杂志), 2009, 34(10): 1241-1244.
[19] LV Y L, WANG D, LI X R, et al. Determination of polysaccharides content in Aconitum carmichaeli [J]. Chin J Pharm Anal(药物分析杂志), 2011, 31(5): 835-838.
[20] DAI J, ZHU S, TANG J. Analysis of monosaccharide compositions in polysaccharides from D. salina by pre-column derivatization high performance liquid chromatography [J]. J Instrum Anal(分析测试学报), 2007, 26(2): 206-210.
Determination of Polysaccharides Content in Alpinia Oxyphylla
ZHAO Xiangsheng1, DONG Na2, FENG Jindong1, YANG Meihua1,3
(1.Hainan Branch Institute of Medicinal Plant Development, Chinese Academy of Medicinal Sciences, Wanning 571533, China; 2.Life Science and Technology Department, Henan Institute of Science and Technology, Xinxiang 453003, China; 3.Institute of Medicinal Plant Development, Chinese Academy of Medical Sciences, Beijing 100193, China)
OBJECTIVE To establish a method for content determination of polysaccharides in Alpinia oxyphylla. METHODS The crude polysaccharides were extracted by hot water and precipitated with ethanol. The purified polysaccharide was obtained by removing protein and colors with Sevage and H2O2, repectively, then run water dialysis and frozen-drying. The monosaccharide composition was determined by HPLC after precolum-derivatization with 1-phenyl-3-methyl-5-pyrazolone (PMP). The conversion coefficient of Alpinia oxyphylla polysaccharides to glucose was obtained by refined polysaccharides, and then the content of crude polysaccharides in Alpinia oxyphylla was determined by sulfuric acid-phenol method. RESULTS The monosaccharide compositions in polysaccharides from Alpinia oxyphylla were Glu, Rha, Gal, Man, and Ara. The content of polysaccharides was 12.91%(RSD=4.72%, n=5), and the average recovery was 99.1% with RSD of 4.57%(n=5). CONCLUSION The method is sample, and can be used for determination of the content of polysaccharides from Alpinia oxyphylla.
Alpinia oxyphylla; polysaccharide; monosaccharide; content determination
R917.101
B
1007-7693(2013)10-1070-05
2012-12-27
中央公益性基金项目(2011HNB04);海南省中药现代化专项项目(2010ZY011)
赵祥升,男,助理研究员 Tel: (0898)62553667 E-mail: xiangsheng437@163.com
