大鼠牙髓干细胞、外胚间充质干细胞的细胞表型的实验研究
2013-03-06王亦菁张晓东
王亦菁 张晓东 于 华 金 岩
大鼠牙髓干细胞、外胚间充质干细胞的细胞表型的实验研究
王亦菁 张晓东 于 华 金 岩
目的检测组织特异性分化标记在大鼠牙髓干细胞(DPSC)、外胚间充质干细胞(EMSC)及骨髓间充质干细胞(BMSC)中的表达,探讨三者细胞表型的异同。方法通过免疫组化检测大鼠DPSC、EMSC、BMSC三种细胞的表型;RT-PCR检测DPSC、EMSC、BMSC的DSPP mRNA表达。结果免疫组化结果显示,三种细胞对于不同细胞的表面标志有不同程度的表达;RT-PCR显示,DSPP的mRNA在大鼠DPSC、EMSC中不表达,在BMSC中弱表达。结论DPSC与EMSC的细胞表型具有一定的相关性和延续性。
牙髓干细胞外胚间充质干细胞骨髓间充质干细胞细胞表型
外胚间充质干细胞(Ecto-mesenchymal stem cells,EMSC)来源于神经嵴干细胞(Cranial neural crest stem cells,CNCSC),周泽渊等[1]的研究表明,二者的基因表达谱具有延续演变性。来源于外胚间充质的牙髓组织中包含的牙髓干细胞(Dental pulp stem cells,DPSC)与EMSC之间的基因和蛋白表达模式的异同,是理解牙齿发生过程的中枢环节,对于揭示干细胞的迁移,阐明干细胞的来源具有重要意义。目前由于缺乏对前成牙本质细胞群特异性标志的认识,无法对DPSC进行准确定位。本实验通过免疫组化和RT-PCR检测一些组织特异性分化标记(HNK-1是EMSC特异的标记分子之一)在大鼠DPSC、EMSC、BMSC中的表达,分析三种细胞表型的异同,为研究DPSC、EMSC的关系,揭示DPSC的来源,寻找DPSC的特异性标记提供线索。
目前,普遍通过干细胞的表面标志来区分和鉴定各种干细胞,主要是利用荧光素或酶的化学特性与细胞表面受体独特的结构相结合的方法来鉴别干细胞群。不同组织的干细胞具有自身的特性及特异的表面标志,DPSC、EMSC的表型分析将有助于了解二者在发育演变过程中的相关性,为揭示DPSC的来源提供依据。
1 材料和方法
1.1 实验材料
高速低温离心机(SIGMA-1K15)、Peltier Thermal Cycler PTC-100 PCR仪(MJ Research),数码凝胶成像和分析系统(Biolmaging systems GDS-800),核酸及蛋白定量仪(Biophotometer),ZDY2A电泳仪(南京)。
ExTaq DNA聚合酶、DL2000 DNA marker、10× DNA上样缓冲液(Takara,日本);Trizol、superscriptTM II反转录酶(Invitrogen,美国);PolyAT-tractR System(Promega,美国);引物合成(上海生工);LSAB加强型免疫组化试剂盒(DAKO,美国);DAB显色系统(武汉博士德公司)。
抗基质蛋白-1单克隆抗体(STRO-1,R&D,美国)、抗波形丝蛋白多克隆抗体(VIM,DAKO,美国)、抗成纤维细胞生长因子多克隆抗体(FGF,DAKO,美国)、抗第Ⅷ因子多克隆抗体(DAKO,美国)、抗α-平滑肌肌动蛋白单抗(α-SMA,Sigma,美国)、抗S-100多克隆抗体(DAKO,美国)、抗胶质纤维酸性蛋白多克隆抗体(GFAP,DAKO,美国)、抗Nestin单抗(DAKO,美国)、抗LNGFR/P75多抗(Santz Cruz,美国)、抗EMA单克隆抗体(DAKO,美国)、抗LA多克隆抗体(DAKO,美国)、抗CD14单克隆抗体(DAKO,美国)、抗牙本质涎蛋白多克隆抗体(DSP,Santz Cruz,美国)、抗牙本质基质蛋白多克隆抗体(DMP,Santz Cruz,美国);抗骨涎蛋白(BSP)、抗骨基质蛋白(BMP)、抗骨桥素(OPN)、抗Ⅰ型胶原、抗Ⅲ型胶原、抗Ⅱ型胶原多克隆抗体(L.Fisher馈赠)。
1.2 方法
1.2.1 细胞培养
将DPSC、EMSC、BMSC原代培养,细胞悬液以1×104个/孔的细胞密度接种于6孔板,常规培养,镜下观察培养板中细胞克隆情况,用于实验。
1.2.2 DPSC、EMSC、BMSC细胞表型免疫组化鉴定
将三种细胞各取2株克隆,接种于预先消毒处理过的小盖玻片(8 mm×8 mm)上,37℃孵育24 h,0.1 mol/L PBS洗涤3次,4%多聚甲醛固定30 min,经梯度乙醇至水。按照LSAB加强型免疫组化试剂盒说明书进行细胞的免疫组化染色。
1.2.3 RT-PCR检测DPSC、EMSC、BMSC的DSPP mRNA表达
提取DPSC、EMSC、BMSC总RNA;
引物合成:按照Genbank登陆的基因DSPPm-RNA序列及引物设计原则,设计如下:片段长度为464 bp。①5'-AGACACGGGTTCTGGTGATGGT-3';②5'-CCCTTGCTTTGGGCTATTCCTT-3'。
RT-PCR反应体系:10×PCRbuffer5μL,25 pmol/μL引物1μL,cDNA模板2μL,10 mmol/L dNTP 1μL,ExTaq DNA聚合酶0.5μL,加水至50μL。反应条件:94℃预变性2 min,94℃变性45 sec,56℃退火45 sec,72℃延伸60 sec,共35个循环,72℃延伸10 min。取PCR产物1%琼脂糖凝胶电泳检测RTPCR产物。
2 结果
2.1 细胞表型免疫组化鉴定结果
DAB显色,阳性结果为程度不等的棕黄色,分别记为++、+、±和-。阴性对照的胞浆和胞膜均无特异性染色(表1)。
2.2 RT-PCR结果
DSPP的mRNA在大鼠DPSC、EMSC中未检测到,在BMSC中有弱的表达(图1)。
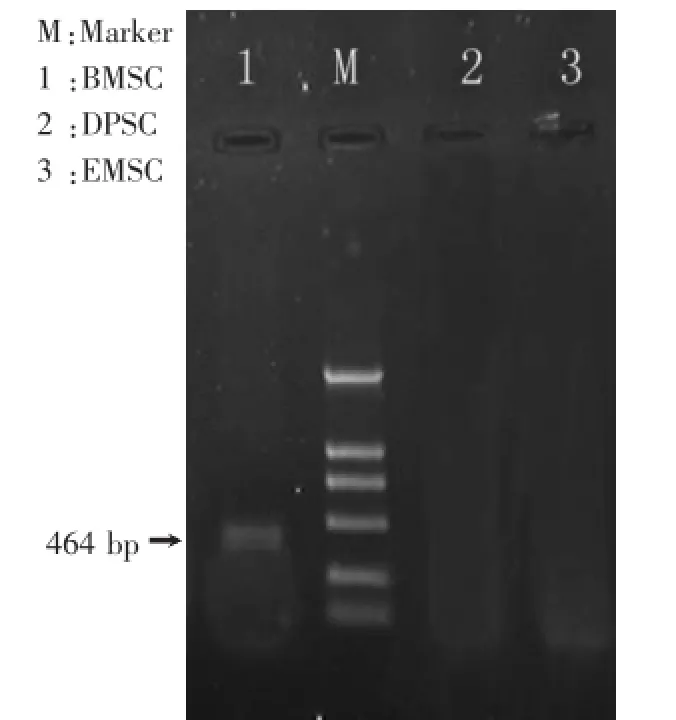
图1 RT-PCR检测DSPP mRNA在DPSC、EMSC、BMSC中的表达Fig.1 The mRNA expression of DSPP in rat DPSC,EMSC and BMSC
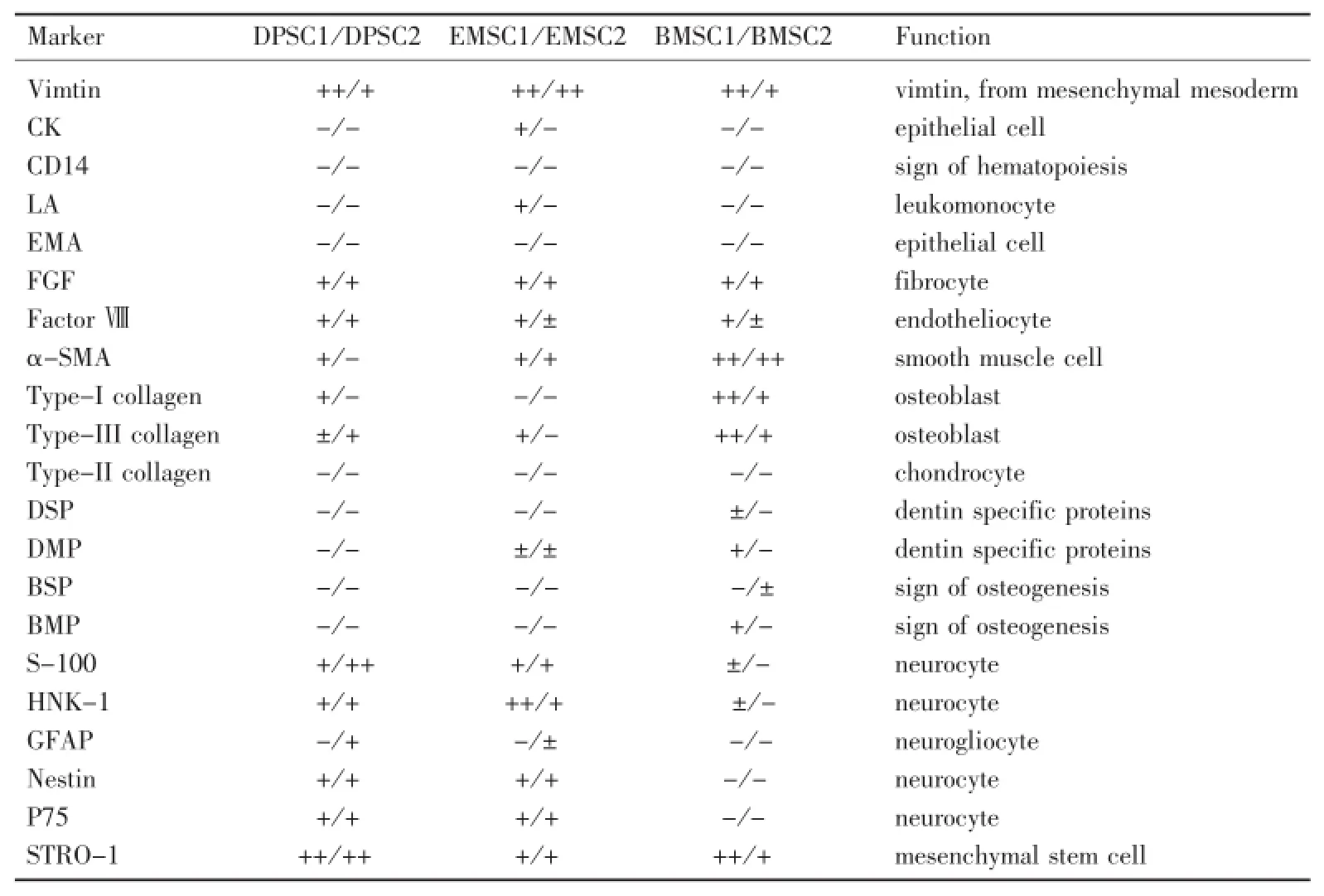
表1 大鼠DPSC、BMSC、EMSC细胞表型的免疫组化结果Table 1 The phenotype of rat DPSC,BMSC and EMSC detected by immunohistochemistry
3 讨论
免疫组化结果显示,随机选取的DPSC克隆株细胞表型呈现多样性。干细胞具有自身的特性,表达与其来源相关的某些特异性标志[2],而成纤维细胞广泛存在于各组织中,并有一定的组织特异性。本组免疫组织化学染色显示,DPSC强表达间充质干细胞的标志STRO-1,表达成纤维细胞的标志波形丝蛋白,成纤维细胞生长因子,还表达内皮细胞相关标志(如第Ⅷ因子),平滑肌的标志(如α-平滑肌肌动蛋白),弱表达骨标志(如Ⅰ型胶原、Ⅲ型胶原、骨桥素等)。DPSC不表达软骨标志Ⅱ型胶原,上皮细胞的标志EMA,淋巴细胞的标志LA,造血细胞的标志CD14。此结果提示,大鼠DPSC同BMSC一样,同表达间充质来源的组织细胞的特征标志。本组结果与Gronthos等[3]对于人来源的DPSC表型研究的报道相似。李盛琳等[4]也发现体外培养的人DPSC表达骨钙素、骨涎蛋白、骨连结蛋白和Ⅰ型胶原。另组实验也观察到大鼠DPSC的表达谱与人来源的DPSC表达谱相似[5],表达的强弱有部分差异,可能是种属间的差异,也可能是操作误差造成的,需进一步实验证实。
由于对DPSC的确切来源不甚清楚,因而无法对其进行定位、分离、鉴定。Shi等[6]通过cDNA微阵列分析,比较了人来源DPSC和BMSC的表型差异,发现二者有超过4 000个基因的表达水平是一致的,包括细胞外基质成分、细胞黏附分子、成骨特异性调节的转录因子、骨相关的标志分子、调节牙本质和骨形成的生长和分化因子等。对于表达不同的基因,通过RT-PCR、Northern blot等分子生物学方法得以确认,结果显示18型α-1胶原、胰岛素样生长因子2型(IGF-2)、络氨酸激酶、NAD(P)-氧化还原酶、细胞周期依赖性蛋白激酶-6(CDK6)在DPSC中高表达,而胰岛素样生长因子连接蛋白-7(IGFBP-7)和Ⅰ型α-2胶原在BMSC中高表达。因为成牙本质细胞的分化与成骨细胞的分化,牙本质和骨的成分均有许多相似之处,本组实验以BMSC为参照,追踪研究DPSC的来源,将其与EMSC的特异性细胞表型进行初步分析检测,结果表明二者的细胞表型具有一定的相关性。已有研究表明EMSC免疫组化抗NSE(+)、NF(+)、Nestin(+)、S-100(+)、GFAP(-),说明该细胞表达Nestin、NSE、NF等神经特异标志,不表达GFAP神经胶质细胞的标志;抗Vimentin(+)说明该细胞也表达中胚层的特异性标志。因此认为该细胞具有两个胚层的特点,是一种具有外胚层特征的间充质干细胞[1]。本组结果显示,DPSC和EMSC都表达神经谱系的标志S-100,而BMSC基本不表达。S-100是神经嵴来源的间充质前体细胞的标志,S-100可以区分口腔颅面部的外胚间充质和来源于中胚层的间充质,其免疫活性的分布可以对外胚间充质的范围有初步的了解。而神经前体细胞的标志抗HNK-1的着色则较为特别,EMSC细胞均有着色,但着色程度有差别,大部分细胞着色较深,少部分细胞着色较浅,其在DPSC中的表达也较为普遍,但是大部分阳性着色较浅,少部分着色深。HNK-1为迁移中神经嵴细胞的特异性抗体,在其他的中胚层细胞和内、外胚层的细胞中几乎不表达,因而用抗HNK-1单抗可以将来源于颅神经嵴的EMSC和其他细胞分开,是已确认的迁移的神经嵴细胞的标志[7]。本组结果表明,牙髓组织中存在的DPSC表达EMSC相对特异性的表面标志,提示其极有可能是EMSC在机体发育成熟后残留于牙髓组织中的细胞成分,但在细胞迁移的过程中细胞的表型有部分变化,表达的量有所差异,可能是部分细胞发生分化造成的。在胚胎发育过程中,成牙本质细胞来源于外胚层间充质,成骨细胞来源于中胚层间充质的中轴和外层骨[8]。本研究中,BMSC也弱表达许多神经谱系的标志,与外胚间充质细胞相似,但BMSC还表达一些成熟的成骨细胞标志,如BMP、BSP等[9],而EMSC、DPSC却不表达,提示它们代表着不同的间充质干细胞。
本实验通过RT-PCR检测了牙本质特异性蛋白分子DSPP在三种细胞中的表达。结果显示,大鼠来源的细胞中,BMSC中DSPP有弱表达。已有研究表明,两种基质蛋白DSP、DPP只表达于牙本质中,二者由单独的基因DSPP编码[10-12]。体外实验表明,DSPP抗体只在成熟的牙本质层细胞中表达。动物模型研究RT-PCR结果显示,鼠切牙来源的牙乳头细胞不表达DSPP的mRNA,相反新鲜分离的成牙本质细胞-牙髓组织中检测到DSPP的高表达[13]。而本组DPSC、EMSC属于未分化的干细胞群,因此不表达成熟的牙本质特异性蛋白。免疫组化结果表明,大鼠来源的EMSC弱表达DMP。EMSC对于DMP的弱表达可能是由于其中含有一部分已分化的细胞,但在mRNA水平未检测到。对于大鼠BMSC低表达DSPP的mRNA,有研究报道DSPP表达于骨组织[14],尽管是低水平表达,仍提示DSPP有可能是一种骨性标志,还需进一步的分析鉴定。
不同胚胎干细胞因来源(胚泡的内细胞群)而定义,而成体干细胞(ASC)非常稀少,起源不很清楚,因此没有确定的特征含义。目前鉴定ASC是依赖于细胞表面标志,观察它们在试管和培养皿中的分化模式。因此ASC的来源是干细胞研究的主要内容之一,明确ASC是否是胚胎干细胞的“残余”还是由其他路径产生、它与周围环境的关系如何等等,将有助于了解人体内共有多少种干细胞,它们分别存在于哪些组织器官,它们的组织学表型和生物学功能是如何的。Suzuki等[15]从小鼠胚胎肝脏分离出能够在体外克隆水平扩增,不仅能产生肝脏和胆管上皮,而且形成胰脏和胃肠道上皮的细胞。表明ASC的前体细胞可能在胚胎发育早期就已存在,依赖于周围环境而分化为不同于来源组织的细胞。在口腔颌面部发育中,颅神经嵴干细胞(CNCSC)广泛迁移至胚胎面突外胚间充质的过程中,一部分细胞可以继续保留干细胞的特性,因此在外胚间充质中也有保留下来的多能干细胞。DPSC这种来源于牙髓组织的ASC是否就是牙髓组织存在的残余EMSC,对于二者表型的深入分析研究,包括大范围的基因芯片检测、细胞的标记追踪研究、干细胞的克隆分析等将对于揭示DPSC的来源及其定位鉴定具有重要意义。
[1]周泽渊,金岩,史俊南,等.大鼠外胚间充质干细胞的形态学研究[J].牙体牙髓牙周病学杂志,2004,14(5):179-181.
[2]Verfaillie CM,Pera MF,Lansdorp PM.Stem cells:hype and reality [J].Hematology Am Soc Hematol Educ Program,2002:369-391.
[3]Gronthos S,Brahim J,Li W,et al.Stem cell properties of human dental pulp stem cells[J].J Dent Res,2002,81(8):531-532.
[4]李盛琳,王衣祥,施松涛,等.牙髓干细胞体内外矿化能力及生物学特性的研究[C].第三届中国国际暨第六届全国口腔颌面外科学术会议论文汇编.北京:[出版者不详],2002:405-406.
[5]王亦菁,金岩,史俊南,等.人牙髓干细胞的培养及其细胞表型分析的研究[J].临床口腔医学杂志,2005,21(1):23-25.
[6]Shi S,Robey PG,Gronthos S.Comparison of human pulp and marrow stromal stem cells by cDNA microarray analysis[J].Bone, 2001,29(6):532-539.
[7]Shimoda Y,Tajima Y,Nagase T,et al.Cloning and expression of a novel galactoside beta1,3-glucuronyltransferase involved in the biosynthesis of HNK-1 epitope[J].J Biol Chem,1999,274(24):17115-17122.
[8]Brenton S,Nathalie B,Teresa OS,et al.Mesenchymal stem cells [J].Arch Med Res,2003,34(6):565-571.
[9]Pittenger MF,Mackay AM,Beck SC,et al.Multilineage potential of adult human mesenchymal stem cells[J].Science,1999,284 (5411):143-147
[10]Ritchie H,Hou H,Veis A,etal.Cloning and sequence determination of rat dentin sialoprotein,a novel dentin protein[J].J Biol Chem, 1994,269(5):3698-3702.
[11]Gorter de Vries I,Quartier E,Van Steirteghem A,et al.Characterization and immunocytochemical localization of dentine phosphoprotein in rat and bovine teeth[J].Arch Oral Biol,1986, 31(1):57-66.
[12]MacDougall M,Simmons D,Luan X,et al.Dentin phosphoprotein and dentin sialoprotein are cleavage products expressed from a single transcript coded by a gene on human chromosome Dentin phosphoprotein DNA sequence determination[J].J Biol Chem, 1997,272(2):835-842.
[13]Dey R,Son H,Cho H,et al.Isolation and partial sequencing of potentially odontoblast-specific/enriched rat cDNA clones obtained by suppression subtractive hybridization[J].Arch Oral Biol, 2001,46(3):249-260.
[14]Qin C,Brunn JC,Cadena E.The expression of dentin sialophosphoprotein gene in bone[J].J Dent Res,2002,81(6):392-394.
[15]Suzuki A,Nakauchi H,Taniguchi H.Prospective isolation of multipotent pancreatic progenitors using flow-cytometric cell sorting[J].Diabetes,2004,53(8):2143-2152.
Phenotype of Rat Dental Pulp Stem Cell and Ectomesenchymal Stem Cell
WANG Yijing1,ZHANG Xiaodong1,YU Hua1,JIN Yan2.1 Department of Stomatology,The General Hospital of Shenyang Military Region,Shenyang 110840,China;2 School of Stomatology,Fourth Military Medical Hospital,Xi'an 710032,China.Corresponding author:WANG Yijing(E-mail: kpaba@sina.com.cn).
ObjectiveTo investigate the expression of special differentiation marker in dental pulp stem cell(DPSC), ectomesenchymal stem cell(EMSC)and bone mesenchymal stem cell(BMSC),to compare the difference of the phenotype among the three kinds of cell.MethodsThe phenotype of rat DPSC,EMSC and BMSC was described by immunohistochemistry.The mRNA expression of DSPP in rat DPSC,EMSC and BMSC was detected by RT-PCR.ResultsImmunohistochemistry showed different degree of expression of cell surface markers in the three kinds of cells.The DSPP mRNA was not detected in rat DPSC and EMSC,but little detected in BMSC by RT-PCR.ConclusionThe special cell phenotypes of rat DPSCs and EMSC were in possession of certain relevance and continuity.
Dental pulp stem cell;Ectomesenchymal stem cell;Bone mesenchymal stem cell;Cell phenotype
Q813.1+1
A
1673-0364(2013)06-0315-04
2013年9月6日;
2013年10月21日)
10.3969/j.issn.1673-0364.2013.06.004
110840辽宁省沈阳市沈阳军区总医院口腔内科(王亦菁,张晓东,于华);710032陕西省西安市第四军医大学口腔医学院(金岩)。
王亦菁(E-mail:kpaba@sina.com.cn)。
