经腹腔暴露2,5 -己二酮致大鼠脊髓组织细胞凋亡的研究
2013-03-02邱泽文朴丰源
董 伟,邱泽文,刘 爽,朴丰源
(1.大连医科大学 劳动卫生与环境学教研室,辽宁 大连116044;2. 大连医科大学 实验动物中心,辽宁 大连116044)
正己烷在工业上广泛用于粘胶配制、制鞋、油漆、家具制造及电器制造业等。正己烷虽属低毒类有机溶剂,但因其高挥发性和高脂溶性,且具有蓄积和神经系统毒性作用,也是一种高危险毒物[1]。当人们长期低浓度接触正己烷,可导致以感觉运动型多发性周围神经病为主要临床特征的慢性中毒[2]。代谢动力学研究表明,2,5 -己二酮(2,5 -HD)是正己烷的活性代谢产物,它介导了正己烷引起的神经损伤[3]。然而,其毒作用机制并不十分清楚。细胞凋亡也称为程序性细胞死亡,是一种由基因控制的细胞主动死亡过程。在一定程度上,细胞凋亡对生物体维持自身稳定具有重要作用,而细胞凋亡调控失常常参与多种疾病的发生与发展。早在1996年,Ogawa 等[4]用低浓度的2,5 -HD 对小鼠的背根神经节细胞进行培养,出现了明显的凋亡现象。Boekelheide 等[5]发现2,5 -HD 可诱导精子细胞凋亡。这些文献提示,正己烷具有诱导组织细胞凋亡作用。但有关正己烷暴露诱导实验动物脊髓组织细胞凋亡的研究,尚报道较少。
本研究拟通过腹腔给大鼠暴露2,5 -HD 5 周,制作正己烷致周围神经损伤动物模型。用神经行为学评价方法、TUNEL -Hoechst 双染技术和Western Blot 检测技术,观察染毒大鼠脊髓组织细胞凋亡及凋亡调控蛋白Bcl-2、Bax 的表达变化,探讨其毒作用机制。
1 材料和方法
1.1 试 剂
2,5-HD,购于美国sigma 公司,纯度≥99%。氯仿(福晨化学试剂厂,中国);异丙醇(科密欧化学试剂公司,中国);乙醇(新兴试剂厂,中国);RIPA 强裂解液(碧云天,中国);PMSF(碧云天,中国);BCA蛋白浓度测定试剂盒(碧云天,中国);兔抗大鼠Bcl-2抗体(赛信通,美国);兔抗大鼠Bax 抗体(赛信通,美国);小鼠抗大鼠β-actin 抗体(中杉金桥,中国);辣根过氧化物酶标记山羊抗兔IgG(中杉金桥,中国);辣根过氧化物酶标记山羊抗小鼠IgG(中杉金桥,中国);超敏ECL 化学发光试剂盒(碧云天,中国);其他试剂均为分析纯级。
1.2 仪 器
T100TMThermal Cycler(伯乐,美国);PowerPacTM通用电泳仪电源和Mini -PROTEAN®Tetra 电泳槽(伯乐,美国);ChemiDocTMXRS + System(伯乐,美国);荧光显微镜(奥林巴斯,日本)。
1.3 动物分组与染毒
健康成年雄性SD 大鼠40 只,体重200 g 左右,购自大连医科大学实验动物中心。将40 只SD 大鼠按体重随机分为4 组,对照组,低剂量组,中剂量组和高剂量组每组10 只。将2,5 -HD 溶于0.9%生理盐水,经腹腔注射染毒。低剂量组,中剂量组和高剂量组染毒量分别为100 mg/kg,200 mg/kg,400 mg/kg,注射量为0.3 mL/100g,对照组以相同剂量的生理盐水进行腹腔注射。每天1 次,每周5 d,共染毒5 周。
1.4 一般情况与神经行为观察
每周观察大鼠的中毒症状,并对大鼠进行神经行为学评价。将大鼠置于一开旷的地面上,每只动物观察3 min。按照文献[6],对大鼠步态进行评分,其评分标准为:(1)正常、未受影响的步态,步态评分为1 分;(2)轻度异常步态(如脚尖着地、后肢内收),步态评分为2 分;(3)中度步态异常(明显的以膝关节下降和拖尾为特征的运动异常)步态评分为3 分;(4)严重步态异常(如后肢拖拉和完全无法站立)等,步态评分为4 分。
1.5 蛋白提取及Western Blot
将0.1 g 脊髓组织置于1.5 mL Eppendorf 管中,加入预冷的RIPA 强裂解液500 μL,使用组织匀浆器匀浆。静置10 min,然后以12 000 r/min 转速、4 ℃离心20 min,将上清转移至新Eppendorf 管,分装并加入适量的蛋白上样缓冲液于-80 ℃保存;使用BCA 比色法测定蛋白浓度。将等质量的总蛋白依次进行SDS -PAGE 分离1 h,转膜2 h。转膜结束后,取下PVDF 膜,放入5% 脱脂奶粉封闭液中,室温封闭1.5 h。然后将PVDF 膜置于5%脱脂奶粉稀释的兔抗大鼠Bax 抗体(一抗,1∶1 000),兔抗大鼠Bcl-2 抗体(一抗,1∶1 000)及小鼠抗大鼠β- actin(一抗,1∶500)中,4℃过夜。TBST 洗膜3次,每次5 min。再将膜置于5%脱脂奶粉稀释的辣根过氧化物酶标记山羊抗兔IgG (二抗,1∶5 000)及辣根过氧化物酶标记山羊抗小鼠IgG(二抗,1∶5 000),37 ℃孵育2 h,TBST 洗膜3 次,每次5 min。使用超敏ECL,在美国Bio -rad 公司Chemi-DocTMXRS +凝胶成像系统对PVDF 膜进行扫描分析,计算公式为:某样品Bcl -2 或Bax 蛋白的相对表达水平=样品Bcl-2 或Bax 的IOD 值/样品βactin 的IOD 值。
1.6 TUNEL-Hoechst 染色
对照组和染毒组大鼠各4 只,将大鼠用戊巴比妥纳(200 mg/kg)麻醉,经4% 多聚甲醛溶液(pH7.4)灌流2 h。将大鼠置于冰上,取出脊髓,放入4%多聚甲醛溶液中固定。将固定好的组织进行石蜡包埋,切片机进行切片,每片5 μm 厚,贴片待用。TUNEL 染色采用In Situ Cell Death Detection Kit (罗氏,德国)试剂盒,主要步骤:将切好的切片进行脱蜡浸水,将切片浸入到新鲜配制的孵育液中(0.1% Triton X-100,0.1% sodium citrate),25 ℃,8 min。将50 μL TUNEL 反应混合液滴加到样本上,37 ℃,60 min;之后用Hoechst 33342 (1 mg/mL)染色8 min。最后,用防猝灭封片剂封片,4 ℃,暗室,放置12 h,然后于荧光显微镜下进行检测,并拍照。在400 倍光镜下,随机选择5 个视野并计数500 个细胞,并记录阳性细胞数。计算细胞凋亡指数(AI),AI=(凋亡细胞数/500)×100%。
1.7 统计学方法
所有实验数据采用均数± 标准差表示,用SPSS13.0 统计学软件进行One - Way ANVOA 分析,两两比较采用LSD 检验,P <0.05 被认为差异有统计学意义。
2 结 果
2.1 大鼠的一般状况及步态评分
对照组大鼠站立姿势及行走步态正常,无异常改变(图1A)。2,5 -HD 染毒组大鼠逐渐出现被毛污秽、无光泽、明显消瘦、活动减少、肌张力下降等中毒症状,后期出现步态不稳、脚掌呈外“八”字形鸭步等症状,并随染毒时程进行性加重,直至完全瘫痪(图1B)。到第5 周染毒结束时,3 个染毒组的步态评分值分别为1.80 ±0.42、2.80 ±0.42 和3.94 ±0.24,明显高于对照组(P <0.01)。尤其400 mg/kg 2,5 - HD 染毒组,9 只大鼠出现重度异常(4分),1 只大鼠出现中度异常(3 分),其步态评分值为各组中最高的。具体见表1。

图1 2,5 -HD 染毒5 周后大鼠的状态Fig 1 The status of rats for 5 weeks after 2,5 -HD exposure by intraperitoneal injection

表1 2,5 -HD 对大鼠步态评分的影响Tab 1 The effect of 2,5 -HD on the gait score of the rats
2.2 TUNEL-Hoechst 染色观察大鼠脊髓组织细胞凋亡
TUNEL-Hoechst 凋亡染色观察结果显示,对照组在视野下,几乎见不到凋亡阳性细胞(图2A)。在100 mg/kg 和200 mg/kg 染毒组大鼠脊髓切片中,发现一些呈绿色荧光的凋亡阳性细胞(图2B,C),而在400 mg/kg 染毒组大鼠脊髓切片中,可见较多的凋亡阳性细胞(图2D)。各染毒组大鼠脊髓细胞的凋亡指数分别为100 mg/kg 染毒组5.00 ±1.20;200 mg/kg 染毒组12.00 ±1.31;400 mg/kg 染毒组21.00 ±1.36,均明显高于对照组,P <0.01,且随着染毒剂量的增高而增多(图3)。

图2 各组大鼠脊髓组织细胞TUNEL-Hoechst 染色出现凋亡结果Fig 2 Observation of spinal cord cell in rats exposed to 2,5 -HD by TUNEL-Hoechst staining

图3 四组的凋亡指数分析Fig 3 Analysis of apoptotic index in the 4 groups
2.3 2,5 -HD 对脊髓组织Bcl-2 和Bax 蛋白表达影响
Western Blot 检测结果显示,2,5 -HD 染毒组大鼠脊髓组织中Bcl -2 蛋白表达明显低于对照组(P <0.01),并随染毒剂量的增加而降低(图4)。而2,5 -HD 染毒组大鼠脊髓组织中Bax 蛋白表达明显高于对照组(P <0.01),并随染毒剂量的增加而增加(图5)。染毒大鼠脊髓组织Bax/Bcl -2 蛋白表达比值明显高于对照组(P <0.01)(图6)。
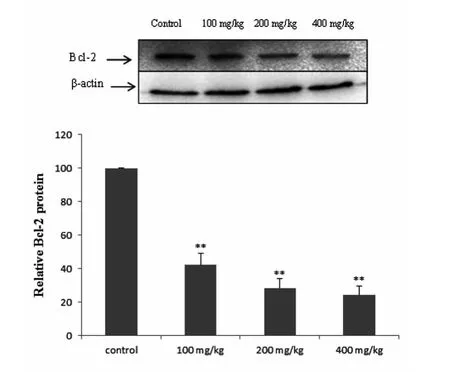
图4 各组大鼠脊髓组织中Bcl-2 蛋白表达Fig 4 Expression of Bcl-2 protein in spinal cord of rats in the 4 groups

图5 各组大鼠脊髓组织中Bax 蛋白表达Fig 5 Expression of Bax protein in spinal cord of rats in the 4 groups
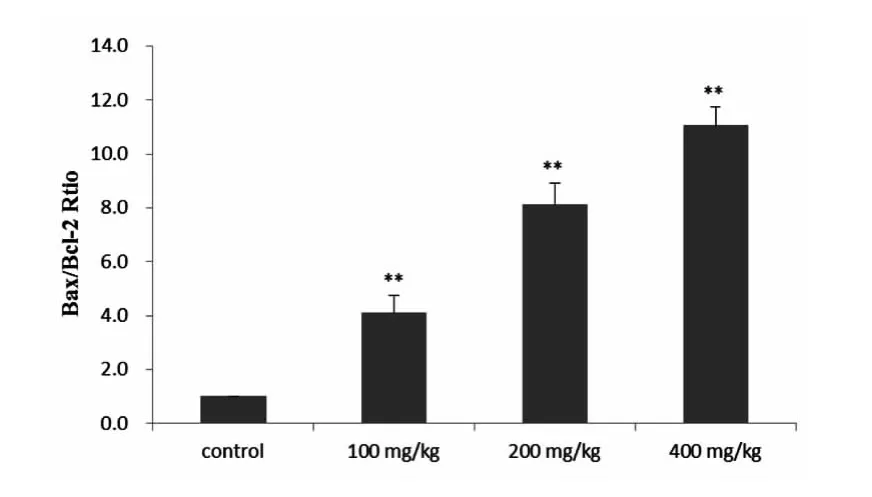
图6 各组大鼠脊髓组织中Bax/Bcl-2 比值Fig 6 The ratio of Bax/Bcl -2 in spinal cord of rats in the 4 groups
3 讨 论
正己烷作为有机溶剂,广泛应用于机械清洗、工业粘胶配制、制造、制球、印刷、家具制造及电器制造等传统领域和电子、微电子等新兴高科技产业领域。美国、加拿大、巴西、南非及中国的台湾、香港等地,相继有职业性正己烷中毒报道[7-8]。特别在中国,几乎每年都有群体性慢性正己烷中毒发生,已成为中国严重职业病之一。
正己烷慢性毒性主要表现为周围神经病,引起神经毒性作用主要是由其代谢产物——2,5 -己二酮(2,5 - hexanedione)所致。本实验结果表明,2,5 -HD 染毒组大鼠出现步态不稳、脚掌呈外“八”字形鸭步等症状,并随染毒时程进行性加重,直至完全瘫痪。到第5 周染毒结束时,各染毒组的步态评分值明显高于对照组。尤其在400 mg/kg 2,5 -HD染毒组,10 只大鼠中有9 只出现神经行为重度异常,其步态评分值为各组中最高。提示本实验设计剂量染毒2,5 -HD 可诱导大鼠周围神经损伤。凋亡是多种多神经毒物导致神经损伤的重要机制之一,如铅、铝等均可诱导神经细胞发生凋亡[9-10]。本实验TUNEL -Hoechst 双染结果显示,染毒组大鼠脊髓组织切片可见绿色荧光凋亡阳性细胞,其凋亡指数(AI)高于对照组,且随着染毒剂量的增高而增多。Western Blot 检测结果显示,2,5 -HD 染毒大鼠脊髓组织Bax 蛋白表达水平明显高于对照组,而染毒大鼠脊髓组织Bcl -2 蛋白表达量明显低于对照组。染毒大鼠脊髓组织Bax/Bcl -2 蛋白表达比值显著高于对照组。Boekelheide 等[5]发现,2,5 -HD 可诱导精子细胞凋亡。Ogawa 等[4]也报道,低浓度2,5 -HD 暴露可引起小鼠背根神经节细胞出现明显的凋亡现象。上述文献结果进一步支持本研究的发现。本研究结果表明,经腹腔暴露2,5 -HD 可诱导大鼠脊髓组织细胞凋亡,上调Bax 蛋白表达和下调Bcl -2 蛋白表达。2,5 -HD 诱导大鼠脊髓组织细胞凋亡可能与Bax/Bcl-2 通路紊乱有关。
[1] 夏元洵. 化学物质毒性全书[M]. 上海:上海科学技术文献出版社,1991:223.
[2] Kutlu G,Gomceli YB,Sonmez T,et al. Peripheral neuropathy and visual evoked potential changes in workers exposed to n-hexane[J]. Clin Neurosci,2009,16(10):1296 -1299.
[3] Lehning EJ,Jortner BS,Fox JH,et al. γ-diketoneperipheral neuropathy. Ⅰ. Quality morphometric analyses of axonal atrophy and swelling[J]. Toxicol APPI Pharmracol,2000,165(2):127 -140.
[4] Ogawa Y,Shimizu H,Kim SU. 2,5 - Hexanedione induced apoptosis in cultured mouse DRG neurons[J]. Int Arch Occup Environ Health,1996,68:495 -497.
[5] Boekelheide K,Fleming SL,Johnson KJ,et al. Role of Sertoli cells in injury-associated testicular germcell apoptosis[J]. Proc Soc Exp Biol Med,2000,225(2):105 -115.
[6] Lopachin RM,Ross JF,Reid ML,et al. Neurological Evaluation of Toxic Axonopathies in Rats:Acrylamide and 2,5 - Hexanedione [J]. Neuro Toxicol,2002,23(1):95 -110.
[7] Suarez-Fernandez MB,Soldado AB,Sanz-Medel A,et al.Aluminum - induced degeneration of astroeytes occurs via apoptosis and results in neuronal death [J]. Brain Res,1999,835(2):125 -136.
[8] 安兰敏,杨军,徐兵.铅对大鼠脑细胞凋亡的诱发作用及对P53 基因表达影响的研究[J]. 癌变·畸变·突变,2003,15(10):209 -211.
[9] Huang CC. Polyneuropathy induced by n-hexane intoxication in Taiwan[J]. Acta Neurol Taiwan,2008,17(1):3 -10.
[10] Misirli H,Domac FM,Somay G,et al. N - hexane induced polyneuropathy:a clinical and electrophysiological follow up[J]. Electromyogr Clin Neurophysiol,2008,48(2):103 -108.
