咸鱼中戊糖片球菌产亚硝酸盐还原酶的条件优化
2013-02-21吴燕燕王雅楠李来好杨贤庆马海霞
吴燕燕,王雅楠,2,李来好,杨贤庆,戚 勃,黄 卉,马海霞
(1.中国水产科学研究院南海水产研究所,农业部水产品加工重点实验室,广东广州510300;2.上海海洋大学食品学院,上海201306)
咸鱼是传统腌制品的代表,具有悠久的加工和食用历史。大部分腌制品含有的亚硝酸盐主要是在加工过程中添加,用以呈现良好色泽,防腐和增强风味[1-3]。咸鱼中的亚硝酸盐是在腌制加工过程产生的亚硝酸盐,能进一步转化成亚硝胺化合物[4]。亚硝胺化合物具有强烈的致癌性,可腐蚀食管诱发食管癌[5]、肝癌、胃癌等多种癌症[6-7]。亚硝酸盐还原酶(Nitrite Reductase,NiRs)是一种胞内酶,可还原亚硝酸盐生成氨,一般存在于细菌细胞中[8]。目前学者们已经在分子结构上对这种酶进行了研究,国外学者根据酶辅基结构的不同找到了两种NiRs,血红素cd1型NiRs和Cu型NiRs[9-10],并且对这两种结构进行了序列分析和基因克隆[11-13]。国内学者在肉制品中已提取出NiRs,并对其发酵性质进行了研究[14]。在巨大芽孢杆菌中也发现了这种酶,研究了测定酶活的条件[15-16]。刘法佳等[17-18]从咸鱼中通过筛选分离,优选出具有降解亚硝酸盐作用的戊糖片球菌。本文在此基础上,发现戊糖片球菌含有亚硝酸盐还原酶,对其产酶条件即接种量、pH、培养温度和培养时间进行优化,获得戊糖片球菌产NiRs的最适条件。实验设计为进一步提取NiRs和进行酶学性质研究,以及此种酶在腌制食品中的应用提供理论依据。
1 材料与方法
1.1 实验材料
戊 糖 片 球 菌(Pediococcus pentosaceus,P.pentosaceus) 本实验室从咸鱼鱼肉中分离得到并经过生理生化鉴定和GenBank的16S rDNA测序对比鉴定[17-18];溶菌酶、MRS肉汤培养基 广州市齐云生物技术有限公司;亚铁氰化钾、亚硝酸钠、硼砂 均为分析纯,购自天津市福晨化学试剂厂;葡萄糖、乙酸锌、氯化钠、七水合硫酸镁、二水合氯化钙、一水合硫酸锰 均为分析纯,购自广州化学试剂厂;牛肉浸膏、细菌学蛋白胨 购自广东环凯微生物科技有限公司;盐酸萘乙二胺、对氨基苯磺酸 均为分析纯,购自上海晶纯试剂有限公司;发酵培养基 葡萄糖15g/L,牛肉膏1.5g/L,细菌蛋白胨1.5g/L,K2HPO41.35g/L,KH2PO40.7g/L,NaCl 1.0g/L,NaNO20.138g/L,MgSO4·7H2O 0.2g/L,MnSO4·H2O 0.01g/L,CaCl2·2H2O 0.02g/L,pH为6.5。
1.2 实验方法
1.2.1 亚硝酸盐的测定[19]根据国标GB 5009.33-2010中亚硝酸盐的测定方法制作标准曲线。取50m L容量瓶若干,分别放入0.00、0.20、0.40、0.60、0.80、1.00、1.50、2.00、2.50m L已配制好的亚硝酸钠标准使用液,其质量相当于0.0、1.0、2.0、3.0、4.0、5.0、7.5、10.0、12.5μg亚硝酸钠。按照国标中的方法处理后,用普通玻璃比色皿测定吸光值。绘制亚硝酸盐标准曲线图。
1.2.2 亚硝酸盐还原酶活性的测定 将菌体发酵液从培养箱中取出,在5000r/min离心15min去除发酵液,将沉淀物用缓冲液洗涤悬浮,按照每0.1g/100m L菌悬液添加溶菌酶。置于35℃摇床培养箱160r/min破除细胞壁2h,加入磷酸盐缓冲液,超声波35kHz提取30min,每5min振荡一次。加入亚硝酸钠标准液混匀,使其初始浓度为1μg/m L,放入培养箱中1h。取100m L锥形瓶,准确吸取5.0m L样品放入瓶中,沉淀样品中的蛋白质,处理方法见国标[19]。取10m L上清液于离心管中,放入4℃冷冻离心机中10000r/m in离心5m in,每管吸取2.00m L上清液,置于50m L容量瓶中,加水40m L左右摇匀,每瓶中滴加2m L对氨基苯磺酸溶液混匀,避光静置3m in,再加入1m L盐酸萘乙二胺溶液,混匀定容,避光静置15m in,用普通玻璃比色皿,在波长538nm处测定吸光值。每组做三个平行,以等量的蒸馏水代替样品做空白对照。所得数据,根据标准曲线方程求出亚硝酸钠的含量[4,19]。
酶活性单位的定义:每一分钟降解还原1μg亚硝酸盐所需要的亚硝酸盐还原酶量,定义为一个活力单位[20]。
1.2.3 接种量的优化 从斜面培养基挑取保藏的菌种,接入液体种子培养基,35℃下活化两代。将新鲜培养的种子液以2%、3%、4%、5%、6%接种量分别接入发酵培养基中。条件控制为35℃,pH6,培养时间48h。每组三个平行,蒸馏水为空白对照。取1m L用平板菌落计数法检测活菌数。
1.2.4 pH优化 菌种自斜面培养基接种入液体种子培养基活化两代。将新鲜培养的种子液接入发酵培养基中,用无菌1mol/L的盐酸和1mol/L的NaOH调节发酵培养基的初始pH,分别为5.5、6、6.5、7、7.5。其他条件控制为接种量5%,35℃,培养时间48h[21]。培养过程中每隔2h调整发酵液的pH为初始值。每组三个平行,蒸馏水为空白对照。取1m L用平板菌落计数法检测活菌数。
1.2.5 温度优化 将活化两代的新鲜培养的种子液接入发酵培养基中,调节发酵液培养温度分别为27、30、32、35、37、40℃。其他条件控制为接种量5%,pH 6,培养时间48h。每组三个平行,蒸馏水为空白对照。取1m L用平板菌落计数法检测活菌数。
1.2.6 时间优化 菌种活化两代后,将新鲜种子液接入发酵培养基中,控制发酵液培养时间分别为24、36、48、60、72h。其他条件控制为接种量5%,pH 6,培养温度35℃。每组三个平行,蒸馏水为空白对照。取1m L用平板菌落计数法检测活菌数。
1.2.7 产酶条件优化正交实验 在单因素实验基础上,采用L9(34)正交实验法,对戊糖片球菌产NiRs的四个产酶条件接种量、pH、培养温度和时间进行优化。每组三个平行,蒸馏水为空白对照。
1.2.8 数据处理 用Excel表格统计并处理数据,SPSS软件对数据相关性和方差进行分析,再用Origin 7.5软件绘制曲线图。
2 结果与讨论
2.1 亚硝酸盐标准曲线
根据测量数据,以质量浓度(μg/m L)为横坐标,吸光度为纵坐标绘制亚硝酸盐的标准曲线,如图1所示,曲线方程为y=0.823x+0.004,R2=0.999。

图1 亚硝酸盐质量浓度的标准曲线Fig.1 Standard curve of nitrite concentration
2.2 接种量对产酶结果的影响
设置不同梯度的接种量培养戊糖片球菌,结果如图2所示。戊糖片球菌产NiRs的酶活性呈现正态分布,接种量较小时,戊糖片球菌的对数生长期时间较长,则活菌数较少,菌种产酶量较小。随着接种量的增大,活菌数不断增加,酶活性也逐渐增加,当接种量为5%时,菌种产酶的酶活性达到最大值,此时的酶活性为72.272U/m L,当接种量较大时,菌种对数生长期缩短,培养基中营养不足,造成菌种数量减少,产酶量减少,酶活性有了下降的趋势。所以接种量对于戊糖片球菌产亚硝酸盐还原酶具有一定的影响,并且最适合的接种量为5%左右。

图2 不同接种量对产酶酶活的影响Fig.2 Effectof disparate inoculate quantity on enzyme activity
2.3 pH对产酶结果的影响
戊糖片球菌降解亚硝酸盐的过程分为两个阶段,弱酸环境下主要靠产酶降解亚硝酸盐,强酸环境下主要靠产酸降解亚硝酸盐。而戊糖片球菌在中性环境下活菌数最高[22]。因此产酶的pH梯度设置为弱酸性到中性的5.5~7.5。结果如图3所示。随着pH的变化,戊糖片球菌产NiRs的酶活变化呈正态分布。数据显示,在弱酸环境下,随着pH的增大,活菌数量增加,酶活性有着上涨趋势,在pH为6的时候,NiRs的酶活达到最大值73.677U/m L。当pH>6时,活菌数开始缓慢降低,并且酶活性有明显的降低,说明pH的增加抑制了菌种的产酶量。因此发酵培养基的pH对于戊糖片球菌产NiRs的酶活有一定影响,最适的产酶pH为6左右。

图3 不同pH对产酶酶活的影响Fig.3 Effect of disparate pH on enzyme activity
2.4 培养温度对产酶结果的影响
温度对于菌种生长和酶活性的影响较大,根据乳酸菌的温度生长条件,设置因素梯度为27~40℃。将接种的发酵培养基放入不同温度的培养箱中,NiRs酶活测定结果如图4所示。戊糖片球菌产NiRs的酶活呈正态分布变化,开始时随着温度增加,戊糖片球菌活菌数增加,酶活性逐渐增大,到30℃时达到最大值79.526U/m L,超过30℃后,酶活性受到抑制,并且呈下降趋势,这是由于温度的升高导致细菌生长缓慢,活菌数降低,NiRs活性受到抑制。这说明菌种的培养温度对产酶的酶活性影响明显。因此,戊糖片球菌产NiRs的最适培养温度应该为30℃左右。

图4 不同培养温度对产酶酶活的影响Fig.4 Effectof different culture temperatures on enzyme activity
2.5 培养时间对产酶结果的影响
发酵培养的时间如图5所示。随着时间的增加,戊糖片球菌产NiRs的酶活呈现递增的趋势,对数期和稳定期有足够的时间积累NiRs。超过48h之后酶活性的变化趋于平稳,在60h时测得酶活最大值为78.129U/m L。由于乳酸菌降解亚硝酸盐的过程分为两个阶段,第一阶段是酶降解,第二阶段是酸降解,随着时间的延长,培养基的pH会逐渐减小。虽然在60h测得最大值,但超过48h后酶活性变化不大,所以后期可能由于酸降解了亚硝酸盐而引起测量误差增大。由图5可知,最适合的培养时间应该在60h左右。
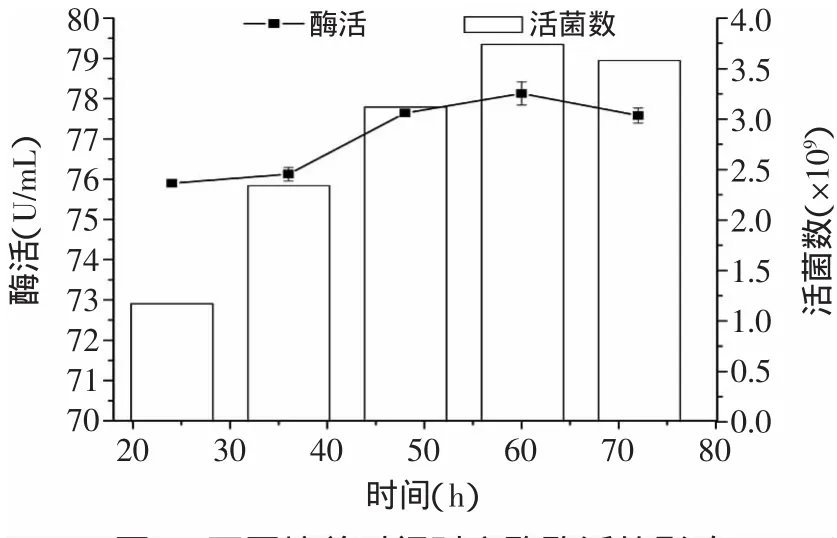
图5 不同培养时间对产酶酶活的影响Fig.5 Effect of different culture time on enzyme activity
2.6 正交实验结果分析
在单因素实验的基础上,应用正交实验法对戊糖片球菌产NiRs的产酶条件进行优化。采用L9(34)正交实验表。实验结果见表1。方差分析见表2。
由表1和表2可知,四个因素对产酶的影响大小排序是A>D>B>C,接种量的F值最高,在0.01显著水平下极显著。这说明接种量对戊糖片球菌产NiRs酶活力的影响最大,是主要影响因素。pH和培养时间的F值小于接种量的F值,但在0.01显著水平下也是极显著。说明pH和培养时间对产酶酶活的影响次之,但也有较大的影响。培养温度的F值小于0.05显著水平F0.05(2,9),无显著性差异,因此培养时间对产酶酶活的影响最小。对比表1中四个因素的k值,可以得出,戊糖片球菌产NiRs的最佳条件为A1B2C3D1,即接种量4%,pH为6,培养温度为35℃,培养时间为48h。根据正交实验获得的最佳条件,进行验证实验,结果表明在此条件下培养戊糖片球菌,得到的NiRs酶活性达到88.153U/m L,比优化前测量的酶活性增加了66%。

表1 正交实验结果Table1 Design and results of orthogonal test

表2 正交实验方差分析表Table2 Variance analysis of orthogonal test
3 结论
该研究表明,从咸鱼中分离到的戊糖片球菌含有亚硝酸盐还原酶,该酶能降解亚硝酸盐,从而防止咸鱼产品产生亚硝基化合物,对控制咸鱼等腌制鱼类的亚硝酸盐和亚硝基化合物产生具有非常重要的作用。通过单因素实验和正交实验,对分离到的戊糖片球菌产亚硝酸盐还原酶的条件进行优化。结果接种量是主要影响因素,其最佳的产酶条件是:接种量4%,pH为6,培养温度为35℃,培养时间为48h。优化后酶活性提高了66%。根据本实验得到的产酶最适条件,为下一步高效提取亚硝酸盐还原酶应用于鱼类腌制加工中,以期用生物法改进鱼类腌制技术,生产安全的鱼类腌制品奠定基础[23]。
[1]徐涛.腌制水产品中亚硝胺含量控制研究[D].舟山:浙江海洋学院,2010.
[2]刘法佳,吴燕燕,李来好,等.降低腌制食品中亚硝酸盐含量的研究进展[J].广东农业科学,2011,38(1):165-167,173.
[3]刘力源.降解亚硝酸盐菌株的筛选及生物学特性的研究[D].雅安:四川农业大学,2009.
[4]杨贤庆,樊丽琴,陈胜军,等.咸鱼干腌过程中亚硝酸盐和硝酸盐的含量变化及其相关性分析[J].食品与发酵工业,2009,35(10):55-58.
[5]Nasseri-Moghaddam S,Nokhbeh-Zaeem H,Saniee P,et al.Oral nitrate reductase activity and erosive gastro-esophageal reflux disease:A nitrate hypothesis for GERD pathogenesis[J].Digestive Diseases and Sciences,2012,57(2):413-418.
[6]管世敏.降解亚硝酸盐乳酸菌的分离筛选及其在泡菜发酵中的应用研究[D].上海:上海师范大学,2009.
[7]吴燕燕,刘法佳,李来好,等.GC-MS检测咸鱼中N-亚硝胺的条件优化[J].南方水产科学,2012,8(4):16-22.
[8]Vigara J,García-Sánchez M I,Garbayo I,et al.Purification and characterization of ferredoxin-nitrite reductase from the eukaryotic microalga Monoraphidium braunii[J].Plant Physiology and Biochemistry,2002,40(5):401-405.
[9]Leferink N G H,Pudney C R,Brenner S,et al.Gating mechanisms for biological electron transfer:Integrating structure with biophysics reveals the nature of redox control in cytochrome P450 reductase and copper-dependent nitrite reductase[J].FEBS Letters,2012,586(5):578-584.
[10]CutruzzolàF,Brown K,Wilson E K,et al.The nitrite reductase from Pseudomonas aeruginosa:essential role of two active-site histidines in the catalytic and structural properties[J].Proceedings of the National Academy of Sciences,2001,98(5):2232.
[11]徐健,张德纯.Cd1-型亚硝酸盐还原酶脱氮工程菌的构建与表达[J].中国微生态学杂志,2008,20(5):463-465,468.
[12]陈燕红,程萍,喻国辉,等.沼泽红假单胞菌Rhodopseudomonas palustris2-8的亚硝酸盐还原酶基因克隆和序列分析[J].微生物学通报,2011,38(5):647-653.
[13]YoungblutM,Judd ET,Srajer V,etal.Laue crystal structure of Shewanella oneidensis cytochrome c nitrite reductase from a high-yield expression system[J].Journal of Biological Inorganic Chemistry,2012,17(1):647-662.
[14]郑怀忠.产亚硝酸还原酶菌株发酵特性及酶在肉制品中的应用[D].厦门:集美大学,2009.
[15]罗岩,孙君社,张京声,等.巨大芽孢杆菌产亚硝酸还原酶活性测定条件优化[J].中国酿造,2011(6):27-31.
[16]张莹,孙君社,张京声,等.溶氧对巨大芽孢杆菌发酵亚硝酸还原酶的影响[J].中国酿造,2011(6):43-47.
[17]刘法佳,吴燕燕,李来好,等.降解咸鱼中亚硝酸盐的乳酸菌降解特性研究[J].广东农业科学,2012,39(1):94-97.
[18]吴燕燕,刘法佳,李来好,等.改良离子色谱法测定咸鱼中亚硝酸盐的研究[J].南方水产科学,2011,7(6):1-6.
[19]中华人民共和国卫生部.GB 5009.33-2010食品中亚硝酸盐与硝酸盐的测定[S].北京:中华人民共和国卫生部,2010.
[20]龚钢明,吕玉涛,管世敏,等.乳酸菌亚硝酸盐还原酶制备及酶学性质[J].中国酿造,2011(1):58-60.
[21]隋志文.天津冬菜中亚硝酸盐降解菌的筛选与应用[D].天津:天津科技大学,2008.
[22]关秀艳,胡梦坤,曹阳.植物乳杆菌生长条件的优化[J].农业科技与装备,2011(1):9-11.
[23]张婷,吴燕燕,李来好,等.腌制鱼类品质研究的现状与发展趋势[J].食品科学,2011,32(1):149-155.
