褐色喜热裂孢菌Thermobifida fusca产麦芽糖α-淀粉酶基因的克隆表达及酶学性质研究
2013-02-21王治宾刘振东韦宇拓
薛 蓓,王治宾,刘振东,韦宇拓
(1.西藏农牧学院食品科学学院,西藏林芝860000;2.成都蓉生药业有限责任公司,四川成都610041;3.广西大学微生物及植物遗传工程教育部重点实验室,广西南宁530003)
淀粉酶是一类重要的工业用酶,目前淀粉酶的主要工业用途是用于生产葡萄糖和麦芽糖[1]。大多数的α-淀粉酶催化水解淀粉产生大量糊精和葡萄糖,但也有报道,有些α-淀粉酶水解淀粉主要产物是麦芽糖[2]。麦芽糖因具有甜度低、吸潮性低、防止淀粉老化等优良性质而广泛应用于食品、生物医药等工业领域。产麦芽糖的α-淀粉酶具有转化效率高、反应速度快、耐温性高及液化能力强等特点,从而非常适合于淀粉的转化工业化生产,因而寻找高产麦芽糖的α-淀粉酶成为淀粉酶工业领域中一个研究热点。
T.fusca的α-淀粉酶能够水解淀粉产生一定的麦芽糖[3],本研究以T.fusca基因组DNA为模板,克隆其产麦芽糖淀粉酶的基因片段(tfa),与表达载体pSE380连接后,转化入大肠杆菌JM 109中得到重组菌。重组菌在IPTG诱导下进行表达。然后对该酶进行了分离纯化以及酶学性质研究,以期为今后的进一步应用打下基础。
1 材料与方法
1.1 材料与仪器
菌株Thermobifida fusca编号为DSMZ 43792 购自德国菌种保藏中心;表达载体pSE380、大肠杆菌JM 109、BL21 广西大学酶工程与发酵研究所保存;Prime starDNA聚合酶、DL2000 DNA Marker、λHind III DNA Marker、DnaseI 大连宝生物(TaKaRa)生物工程有限公司;小量PCR产物试剂盒 Omega Bio Tek公司;W 2003 DNA Marker广西大学酶工程与发酵研究所自行构建;其他试剂 均为进口或国产分析纯。
冷冻离心机日立CR22F日立工机株式会社;PCR仪Biometra UNOII Thermoblock 德国Biometra公司;核酸电泳仪Amersham Biosciences 美国安玛西亚公司;高效液相色谱分析仪Agilent 1100 series美国安捷伦公司;超声波细胞破碎机JY92-2D 宁波新芝生物科技股份有限公司。
1.2 实验方法
1.2.1 引物设计 根据NCBI公布的tfa基因(Genbank ID:CP000088.1)设计三条扩增引物分别扩增含信号肽和去除信号肽的T.fuscaα-淀粉酶基因。为便于基因与载体的连接,在上下游分别加入Nco I和Eco R I的酶切位点(带下划线),同时为方便后期的过镍柱纯化目的蛋白,设计引物时在表达的目的蛋白基因前端加上6个组氨酸尾巴序列,并委托鼎安生物公司合成。

其中,引物Sense1和Antisense扩增的是含信号肽的T.fuscaα-淀粉酶基因,而引物Sense2和Antisense扩增的是去除信号肽的T.fuscaα-淀粉酶基因。
1.2.2 tfa基因的扩增 以T.fusca基因组DNA为模板,扩增tfa和sptfa。反应体系为25μL,2步PCR反应:98℃ 10s,68℃ 2m in,共30个循环;最后72℃延伸10m in。取3μL PCR产物进行琼脂糖凝胶电泳检测,DNA测序委托上海鼎安生物公司进行。
1.2.3 tfa表达载体的构建及目的蛋白的表达及纯化
将纯化的tfa用Nco I和Eco R I进行双酶切连接到同样双酶切的表达载体pSE380上,经酶切和测序验证得到重组表达质粒pSE380-tfa(去除信号肽)和pSE380-sptfa(含自身信号肽),去除信号肽JM 109/ pSE380-tfa。把重组表达质粒转化到大肠杆菌BL21感受态细胞中进行表达。将转化子在37℃摇床中培养,当OD600达到0.8左右时,加入IPTG使其终浓度达到1mmol/L在37℃继续培养10h。培养好的发酵液在4000r/m in转速下离心7m in,用磷酸缓冲液(pH 7.0)重悬菌体,然后在冰浴条件下超声波破胞(350W破胞,工作8s,间歇10s,30个循环),破胞后收集上清,使用金属镍亲和层析法进行纯化,利用SDS-PAGE凝胶电泳来检测纯化效果[4]。
1.2.4 酶活的测定 淀粉酶活力测定参照Bernfeld法[5]:取450μL 5%(w/v)可溶性淀粉加入1.5m LEppendorf管中,加入50μL适当稀释的酶液,而空白对照管中加入50μL已失活的酶液,60℃反应5m in后,加入500μL DNS以终止酶反应,沸水浴5m in,迅速于流动水中冷却后,在520nm处测OD值。酶活力单位定义为在最适温度及最适pH条件下,按上述反应,每m in生成1μmol还原糖所需的酶量为一个酶活单位(1U)。
1.2.5 重组酶含量测定 按照《蛋白质技术手册》中的Bradford测定方法来计算蛋白质浓度[6]。
2 结果与分析
2.1 T.fuscaα-淀粉酶基因的克隆
提取T.fusca的总DNA[7]。以DNA为模板用设计的引物PCR扩增含信号肽和去除信号肽的T.fuscaα-淀粉酶基因,电泳结果表明:含信号肽的PCR产物为1.8kbp左右,去除信号肽后为1.7kbp左右,与预期的结果相符(见图1)。
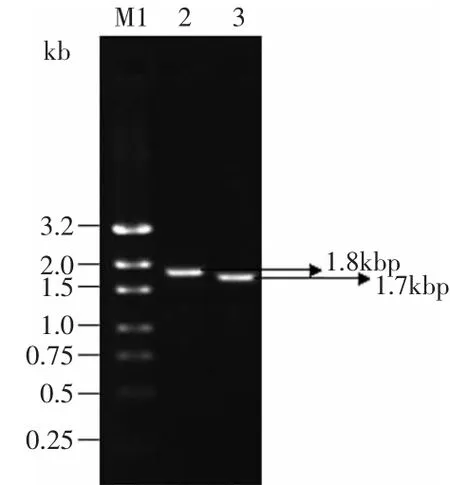
图1 T.fusca总DNA和PCR产物Fig.1 Total DNA of T.fusca,PCR products and restriction endonuclease analysis of recombinant plasmid pSE380-tfa
2.2 T.fuscaα-淀粉酶在大肠杆菌中的表达
2.2.1 T.fuscaα-淀粉酶基因的SDS-PAGE电泳 按照1.2.3所述方法对菌株JM 109/pSE380-tfa进行诱导表达后,离心收集菌体,超声波破碎细胞,取上清进行SDS-PAGE电泳分析:在大约64ku处有明显的特异性条带(图2泳道3),与预期大小相符,而对照菌株JM 109/pSE380(图2泳道2)在64ku处没有明显的特异性条带,由此可以判断重组质粒pSE380-tfa在大肠杆菌JM 109能够成功地表达,利用组氨酸标签对上清初酶液进行镍柱亲和层析一步法纯化,SDS-PAGE分析如图2泳道4、5所示,纯化后获得了清晰的目的条带,纯度可以用于下一步各项酶学特性的研究。
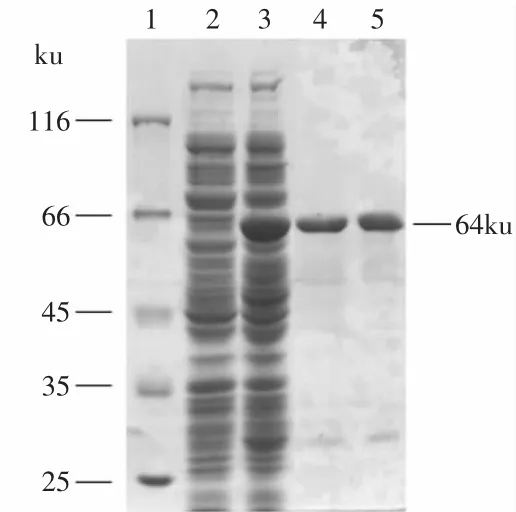
图2 重组质粒pSE380-tfa表达产物SDS-聚丙烯酰胺凝胶电泳Fig.2 SDS-PAGE of the expression of recombinant plasmid pSE380-tfa
2.2.2 大肠杆菌中酶活性的定位 T.fuscaα-淀粉酶基因的全长是1818bp(含基因前面自身信号肽),用SMART服务器分析该酶的结构功能域,分析得出:由DNA推测的α-淀粉酶前体蛋白由605个氨基酸组成,T.fuscaα-淀粉酶基因序列前面1~33aa残基为信号肽结构域,34~605aa残基为T.fuscaα-淀粉酶功能结构域。前体α-淀粉酶的N-端信号肽序列,具有信号肽序列所拥有的典型特点:有一个富含疏水氨基酸的中央核心序列,靠近C-端有极性氨基酸,N-端有正电荷氨基酸,同时具有能被信号肽酶识别的A la-X-Ala盒剪切位点。
将含淀粉酶自身信号肽的菌株JM 109/pSE380-sptfa,去除信号肽JM 109/pSE380-tfa以及对照菌株JM 109/pSE380同时点到LB锥虫蓝淀粉筛选平板上,37℃过夜培养20h后,于自然生长情况下直接观察其产生的水解圈,发现有自身信号肽的转化子pSE380-sptfa在筛选板上产生的水解圈更大更明显,去除信号肽的转化子pSE380-tfa菌落周围的水解圈非常小,而对照菌即转化空质粒pSE380的转化子菌落周围没有水解圈(见图3)。

图3 含信号肽和不含信号肽菌株的锥虫蓝染色平板培养比较Fig.3 Comparison between the trypan blue plate culture of strain with signal peptide and without
在相同条件下培养,将含淀粉酶自身信号肽的菌株JM 109/pSE380-sptfa,去除信号肽JM 109/pSE380-tfa以及对照菌株JM 109/pSE380同时进行20℃低温诱导表达20h,用Vivaflow200超滤器将培养基上清液浓缩40倍,再于4℃将上一步得到的浓缩液用排阻极限为30000的MILLIPORE过滤器继续超滤浓缩40倍后得到胞外酶液;将收集的菌体悬浮于0.05mol/L(pH 7.0)的磷酸钠缓冲液中,然后进行超声波破胞后得到胞内酶液,在同样条件下测定胞外酶活与胞内酶活,结果如表1所示。从表1可以看出含有信号肽的转化子pSE380-sptfa培养基上清有酶活,但在胞内残留的酶活也较高;而不含信号肽的转化子pSE380-tfa培养基上清只检测很低的酶活,这说明T.fuscaα-淀粉酶基因自身的信号肽具有一定的分泌能力[8]。
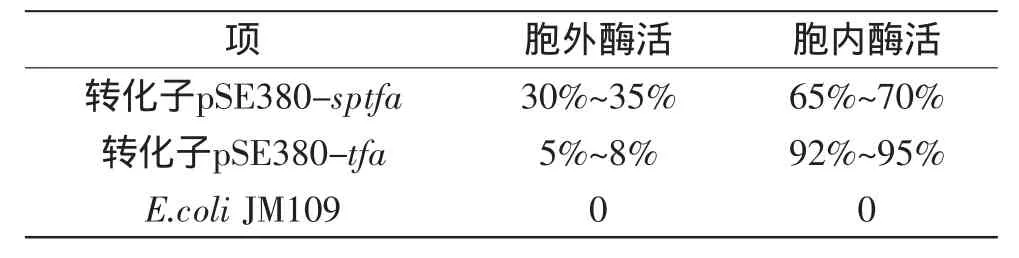
表1 重组大肠杆菌菌株的酶活分布Table1 Distribution of alpha-amylase activity of recombinant strain E.coli JM109
2.3 T.fuscaα-淀粉酶基因(tfa)酶学性质的研究
2.3.1 T.fuscaα-淀粉酶的底物特异性 将纯化后的T.fusca淀粉酶纯酶与α-环糊精、β-环糊精反应,然后进行酶活测定以及HPLC分析,结果表明该酶对α-环糊精、β-环糊精不起作用,说明该酶作用方式是内切的(endolytic)[9-10],该酶为内切型淀粉酶。
2.3.2 酶的最适pH和pH稳定性 将酶加入到用不同pH的磷酸钠缓冲体系配制的1%(w/v)可溶性淀粉中,60℃时测定酶活性,获得pH-活力曲线(见图4),从图中可知酶的最适反应pH为7.0。将酶在不同的pH下处理30m in后,然后与1%(w/v)可溶性淀粉在最适条件(pH 7.0,温度60℃)测其剩余酶活,以未处理的原酶液活力为100%,测定该酶的pH稳定性(见图4),结果显示该酶在pH6.0~8.0时,相对酶活均在80%以上,说明该酶具有较好的pH稳定性。
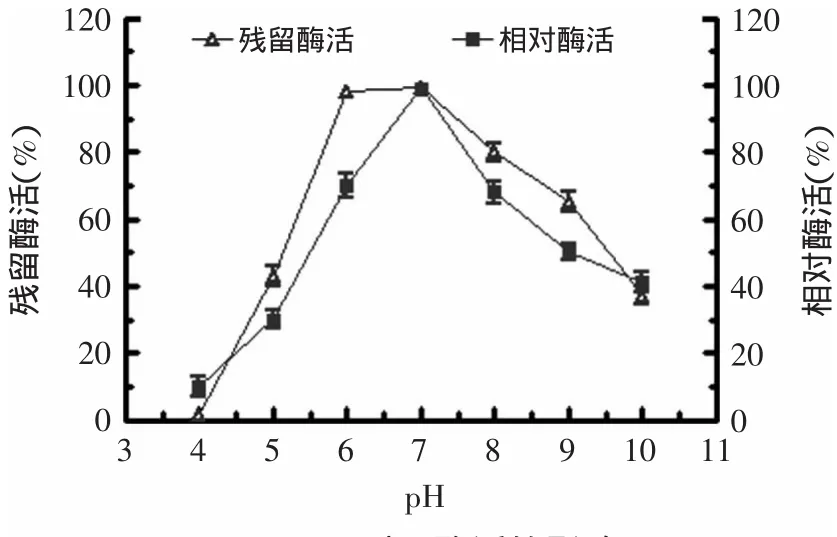
图4 pH对tfa酶活的影响Fig.4 Effectof pH on the enzyme activity of tfa
2.3.3 酶的最适温度和温度稳定性 将酶与1%(w/v)可溶性淀粉(磷酸钠缓冲液,pH 7.0)在不同温度下(30~80℃)测定酶活性以确定该酶的最适反应温度(见图5),从图中可知酶的最适温度60℃。将酶液在不同温度下(30~80℃)保温30min后,再在最适条件(pH 7.0,温度60℃)测其残余酶活力,获得温度稳定性曲线(见图5)。从稳定性曲线图上可看出,该酶在不超过60℃时稳定,当温度高于65℃酶的失活速度加快。可见该酶具备一定的嗜热特性。
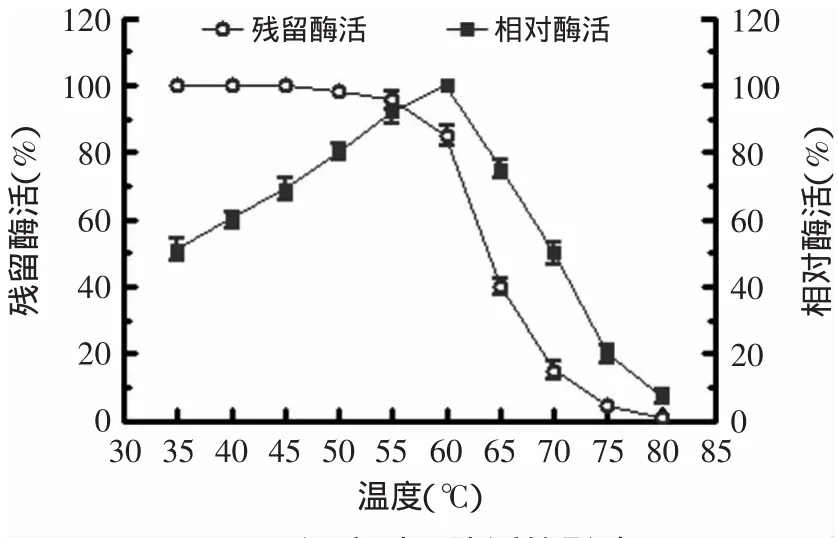
图5 温度对tfa酶活的影响Fig.5 Effect of temperature on the enzyme activity of tfa
2.3.4 EDTA和Ca2+对本实验T.fuscaα-淀粉酶的影响 将不同浓度的EDTA加入到酶与底物的反应体系中,结果表明EDTA对本实验T.fuscaα-淀粉酶有抑制作用(图6)。α-淀粉酶一般需要Ca2+的活化,同时Ca2+还能使酶稳定,但是有些细菌和根霉菌的α-淀粉酶,其稳定性不需要Ca2+。由图7可以发现外加2mmol/L Ca2+对T.fuscaα-淀粉酶的稳定性作用不是很明显。
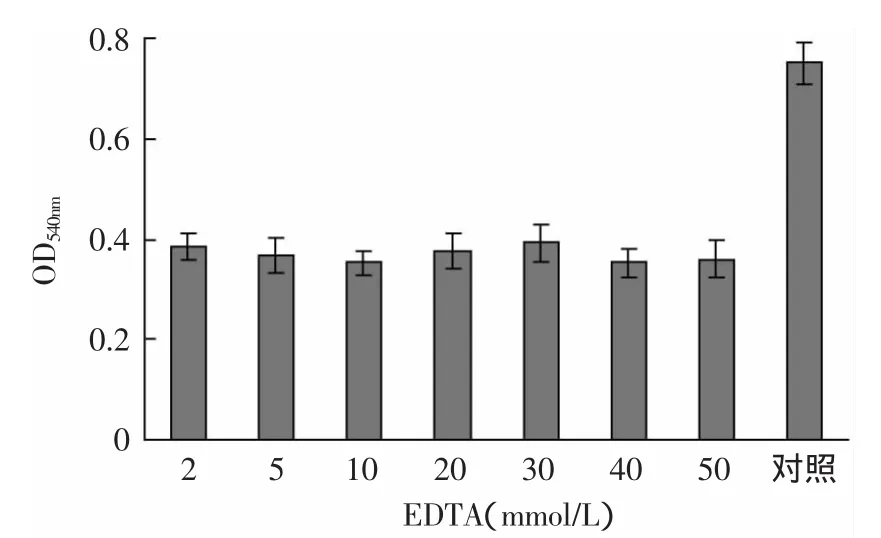
图6 EDTA对tfa酶活的影响Fig.6 Effectof EDTA on the enzyme activity of tfa
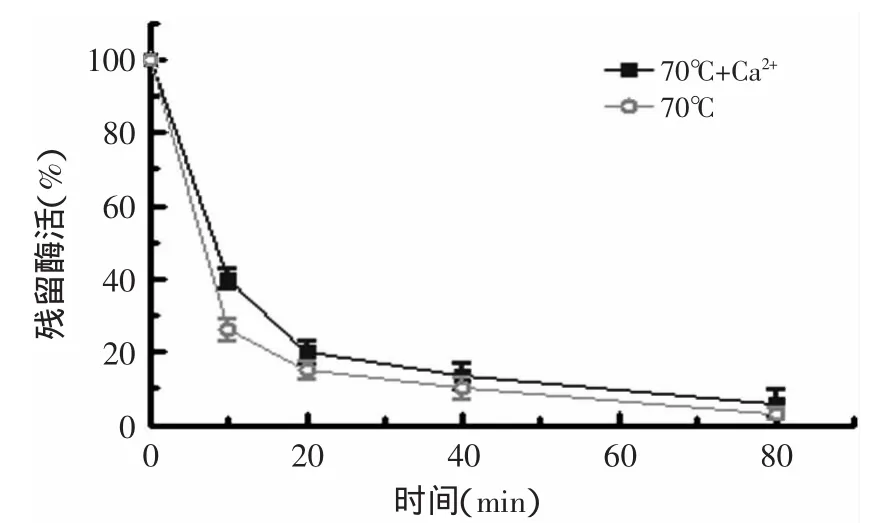
图7 Ca2+对tfa酶活的影响Fig.7 Effectof Ca2+on the enzyme activity of tfa
2.3.5 金属离子对酶活的影响 在酶活测定反应体系中,在最适pH 7.0、最适温度60℃条件下,分别用配制的含有2mmol/L金属氯化物(Na+、Mg2+、K+、Ca2+、Zn2+、Cu2+、Hg2+等)的缓冲液代替反应体系中的缓冲液。加有金属离子的酶液在50℃中保温30m in后,定量测出剩余酶活,求出相对酶活,结果见表2。

表2 金属离子和化学试剂对tfa酶活的影响Table2 The effect ofmetal ions and chemicals on the enzyme activity of tfa
由表2可以看出,外加2mmol/L的Ba2+、Cu2+、Co2+对 T.fuscaα-淀粉酶的活性有激活作用;加2mmol/L的Mn2+、Mg2+、Li+、巯基乙醇、碘醋酸盐对T.fuscaα-淀粉酶活性影响不大;加2mmol/L的Fe3+、EDTA对T.fusca α-淀粉酶活性有一定的抑制作用,相对活力分别只有原来的84%和90%;重金属离子Hg2+、Ag+对T.fusca α-淀粉酶活性有很强的抑制作用,加2mmol/L的Hg2+处理后α-淀粉酶活性只有原来的16%,而加Ag+处理后α-淀粉酶活性只有原来的50%;Zn2+对T.fuscaα-淀粉酶活性失活作用最大,加2mmol/L的Zn2+α-淀粉酶活性只有6.5%。
2.3.6 T.fuscaα-淀粉酶动力学常数Km值及最大反应速度Vmax的确定 以可溶性淀粉为底物,在不同底物浓度下测定酶活,根据测定结果求出该酶对底物的米氏常数Km值及对应的最大反应速率Vmax相关动力学参数,结果如图8所示,得出本研究麦芽糖淀粉酶的Km值为1.305mg/m L,Vmax值为338.0U/mg蛋白质。

图8 tfa的动力学常数Km值Fig.8 The Km of tfa
2.3.7 T.fuscaα-淀粉酶水解特性的研究 在1m L含有1.5%(w/v)可溶性淀粉底物的磷酸钠缓冲液(pH 7.0)中加入100μL纯酶,在50℃水浴10h后,产物进行HPLC分析(见表3,标样图未示)。从表3可以看出该酶能将可溶性淀粉转化为葡萄糖、麦芽糖和麦芽三糖的混合物。

表3 麦芽糖α-淀粉酶水解可溶性淀粉产物的浓度比Table3 The concentration of reaction products by maltose-producingα-amylase hydrolysis soluble starch
3 讨论
目前能水解淀粉得到高麦芽糖水解物的α-淀粉酶基因的报道并不是很多,AmmarYB[11]、Collins BS等[12]报道了两种可水解淀粉产生超高麦芽糖浆的新型的麦芽糖α-淀粉酶,但是其反应温度低、淀粉浓度低及反应时间过长给生产上耗能、纯化及设备的占有带来了巨大的生产成本压力。本研究中菌株T.fuscaα-淀粉酶能将可溶性淀粉转化为葡萄糖、麦芽糖和麦芽三糖(分别占总产物的16.4%、33.2%和50.4%)的混合物,尽管麦芽糖产量不如AmmarYB和Collins BS等报道的淀粉酶,但该酶具有耐热性高、pH稳定范围广等优点,因此具有一定的应用前景。在本研究中也发现T.fuscaα-淀粉酶对淀粉的水解,随着反应时间的延长麦芽三糖的含量在逐渐减少,而麦芽糖、葡萄糖的含量都有所增加(数据未列出),可见需要对T.fuscaα-淀粉酶进行进一步的研究或者进行分子改造。
大肠杆菌表达其他外源蛋白时可以是有活性的可溶性表达,也可能形成不能正确折叠以至于表达后没有活性的包涵体颗粒,其中包涵体形成后存在于细胞质中,其形成的原因有很多可能因素,如使用了不合适的表达载体,基因自身中带较多不能被大肠杆菌很好识别的稀有密码子以及诱导表达条件等,同时对包涵体复性也是相当复杂且困难的过程;可溶性表达的蛋白位于细胞质和周质空间中,有的还可以分泌到细胞外培养基中。同时大肠杆菌是革兰氏阴性菌,与革兰氏阳性菌不同,它具有细胞壁和外膜,这就使得要在大肠杆菌中实现外源蛋白分泌表达变得非常困难,但是也有关于在外源基因自身信号肽的引导下,大肠杆菌将外源蛋白分泌到胞外的报[13-14]。尽管如此,在大部分情况下,大肠杆菌很难识别外源基因自身前端的信号肽序列并应用于其分泌基因产物,所以外源基因的表达产物一般存在于周质空间[15-16]。
本研究以表达型质粒pSE380为载体,将带有完整自身信号肽的T.fuscaα-淀粉酶基因克隆到大肠杆菌JM 109中,得到了一株能分泌表达产物的菌株JM 109/pSE380-sptfa,通过测定胞外和胞内淀粉酶活性发现:淀粉酶有相当一部分(约30%左右)被分泌到细胞外培养基上清中,并且表达出活性,用Vivaflow200超滤器将培养基上清液浓缩40倍,再于4℃将上一步得到的浓缩液用排阻极限为30000的M ILLIPORE过滤器继续超滤浓缩40倍后得到胞外酶液,将其胞外酶液进行SDS-PAGE电泳分析检测到了目的蛋白,对菌株JM 109/pSE380-sptfa进行细胞壁裂解实验(即用溶菌酶处理阳性克隆菌JM 109/pSE380-sptfa及对照菌JM109/pSE380)也发现菌株JM 109/pSE380-sptfa的细胞变得更脆弱易于破碎,推测可能是因为大肠杆菌大量表达外源DNA产物时会损伤自身的细胞壁,导致了T.fusca的α-淀粉酶能分泌到培养基上清中[17-18]。
4 结论
本研究分别构建了含T.fuscaα-淀粉酶基因片段(tfa)的重组质粒pSE380-tfa和pSE380-sptfa,将菌株JM 109/pSE380-tfa进行低温诱导后获得高效表达,利用金属镍亲和层析对菌株JM 109/pSE380-tfa表达的α-淀粉酶进行纯化,SDS-PAGE显示纯化蛋白的分子量约为64ku,Km值为1.305mg/m L,最适反应温度为60℃,最适pH为7.0,HPLC分析表明该麦芽糖淀粉酶能将可溶性淀粉转化为葡萄糖、麦芽糖和麦芽三糖的混合物。
[1]Marc JEC,Veen Bartvan der,Maarel Van der,etal.Properties and Applicationsof Starch-Converting Enzymesof theα-Amylase Family[J].Biotechnology,2002,94:137-155.
[2]Wako K,Takahashi C,Hashimoto S,et al.Studies on Maltotriose-and Maltose-Forming Amylases from Streptomyces [J].Starch Sci,1978,25:155-161.
[3]Busch J E,Stutzenberger FJ.Amylolytic Activity of Thermobifida Fusca[J].Microbiol Biotechnol,1997,13:637-642.
[4]Sambrcok J.Molecular Cloning-A Laboratory Manual(third edition)[M].New York:Cold Spring Harbor Laboratory Press,2001.
[5]谢建华,师永生,杜丽琴,等.一株产酸性α-淀粉酶菌株的筛选、纯化及酶学性质[J].应用与环境生物学报,2011,17(1):95-99.
[6]汪家政.蛋白质技术手册[M].北京:科学出版社,2000:42-46.
[7]邓子新,唐纪良.链霉菌遗传操作实验手册[M].长沙:湖南科学技术出版社,1988.
[8]纪永刚,杨丽珠,陈启民,等.信号肽C-端和成熟蛋白N-端氨基酸序列的变化对α-淀粉酶分泌作用的影响[J].遗传学报,1994,21(3):227-234.
[9]Kobayashi T,Kanai H,Hayashi T,et al.Haloalkaliphilic Maltotriose-Formingα-Amylase Form the Archaebacterium Natronococcus sp.Strain Ah-36[J].Bacteriol,1992,174:3439-3444.
[10]刘创,林伟.环糊精的结构、性质及应用[J].日用化学工业,1997,5:55-57.
[11]Ammar Y B,Matsubara T,LizukaM,etal.New action pattern of a maltose-forming alpha-amylase from Streptomyces sp.and its possible application in bakery[J].JBiochen Mol Biol,2002,35(6):568-575.
[12]Collins BS,Kelly CT,Fogarty WM,et al.The high maltose-producing α-amylase of the thermophilic actinomycetes,Thermomonospora curvata[J].Appl Microbiol Biotechnol,1993,39:31-35.
[13]廖昱泓,涂桂洪,赵德刚.西方许旺酵母α-淀粉酶基因的克隆及其在大肠杆菌中的分泌表达[J].生物技术,2006,16(2):21-23.
[14]牛丹丹,徐敏,马俊双.地衣芽孢杆菌α-淀粉酶基因的克隆和及其启动子功能鉴定[J].微生物学报,2006,46(4):576-580.
[15]You L,Arnold F H.Directed Evolution of Subtilisin E inBacillus Subtilis to Enhace Total Activity in Aqueous Dimethylformamide[J].Protein Eng,1996,9:77-83.
[16]郑斌,詹希美.信号肽序列及其在蛋白质表达中的应用[J].生物技术通讯,2005,16(3):296-298.
[17]李金霞,蔡恒,路福平.地衣芽孢杆菌耐高温α-淀粉酶基因在大肠杆菌中的克隆、表达及其产物的分泌[J].食品与发酵工业,2004,30(3):70-73.
[18]朱卫民,吴宁一.枯草芽孢杆菌α-淀粉酶基因在大肠杆菌中的表达及其产物的分泌[J].微生物学报,1992,32(4):296-298.
