加热对转基因和非转基因大豆胰蛋白酶抑制剂活性以及蛋白质溶解度的影响
2013-02-20刘晓庆朱晓鸣金俊琰杨云霞解绶启
■ 刘晓庆 朱晓鸣 韩 冬,3 金俊琰 杨云霞 解绶启
(1.安徽大学资源与环境工程学院,安徽合肥 230601;2.中国科学院水生生物研究所淡水生态与生物技术国家重点实验室,湖北武汉 430072;3.淡水水产健康养殖湖北省协同创新中心,湖北武汉 430070)
随着世界渔业的发展,用于水产饲料的鱼粉供应严重不足。在养殖成本上,饲料通常占70%左右,而蛋白源占饲料成本的比例超过60%,因此,使用廉价的植物蛋白源替代鱼粉将有利于降低养殖成本[1]。大豆蛋白质含量高、氨基酸组成平衡、市场供给稳定,被认为是水产动物的优质饲料原料[2]。大豆原产于我国,主产地东北是世界上最适宜种植大豆的地区之一,被称为大豆种植的黄金地带,国产大豆多为非转基因大豆。在农业生物技术领域,转基因作物研究与开发在全球范围内取得举世瞩目进展[3],进口转基因大豆因其出油率比国产大豆高5%左右,能带来更多经济效益并逐渐进入中国大豆市场。1996年至2004年,跨国公司对中国的大豆出口占中国大豆进口的90%[4]。然而转基因大豆和非转基因大豆的胰蛋白酶抑制剂钝化方法的对比研究至今未见报道。
但是豆类植物的种子均广泛存在多种类型的抗营养因子,如胰蛋白酶抑制剂、植物凝集素和植酸等,限制了大豆的应用[5]。大豆胰蛋白酶抑制剂(trypsin inhibitor,TI)或称抗胰蛋白酶因子(anti⁃trypsin),是一种广泛存在于自然界的多肽类或蛋白质。它对植物本身具有保护作用,可防止大豆籽粒自身发生分解代谢,使种子处于休眠状态,能调节大豆蛋白质的合成与分解,并具有抗虫作用,因而是大豆必需成分。然而其对动物胰蛋白酶的抑制作用而使其成为大豆中主要抗营养因子,从而降低了大豆蛋白的营养价值[6]。Westfall等研究发现,胰蛋白酶抑制剂是导致豆类蛋白质利用率下降的最根本原因[7]。饲料中的大豆胰蛋白酶抑制剂会导致鱼类氮的内源性亏损,从而对鱼类产生消极影响。因此,大豆胰蛋白酶抑制剂的钝化对提高饲料的营养价值和食用安全性具有重大的意义。
众多学者对大豆胰蛋白酶抑制因子的钝化方法进行过广泛研究,加热(蒸汽烘烤大豆粉)是目前最常用的降低胰蛋白酶抑制剂活性的方法[8]。胰蛋白酶抑制剂活性的降低程度与加热温度、加热时间、颗粒大小以及水分情况相关。实际生产中,这些因素均要小心控制,以免大豆加热不足或加热过熟[9]。
本试验采用干热法处理转基因和非转基因大豆粉,测定不同热处理温度和时间对大豆胰蛋白酶抑制剂的钝化效果以及对大豆蛋白质溶解度的影响,以探讨大豆粉适宜的热处理温度和时间,为大豆的加工处理和水产配合饲料中大豆的广泛应用提供理论依据。
1 材料和方法
1.1 试验原料
转基因大豆来自阿根廷,水分含量8.36%;非转基因大豆购自湖北农业科学院油料作物研究所,中油35号,水分含量8.66%。
1.2 大豆处理
非转基因和转基因大豆经粉碎机粉碎后过80目筛,用四分法取样。每种大豆粉分别取9份样品,其中一份作为未处理大豆,其余8份放入鼓风干燥箱中进行热处理,加热温度分别为60、80、100、120℃,加热时间分别为1 h和2 h。每种大豆粉共9个处理,每个处理3个平行,加热完毕后放入干燥器中冷却备用。
1.3 胰蛋白酶抑制剂测试方法
1.3.1 用于胰蛋白酶抑制剂测定的样品制备
称取(1.000±0.001)g大豆粉样品放入烧杯,加入0.01 mol/l NaOH溶液50 ml,将烧杯置于磁力搅拌器上,搅拌20 min后调节pH值到9.5,放入4℃冰箱中过夜。从冰箱取出后加4℃蒸馏水至100 ml,静置15 min后开始试验。
1.3.2 胰蛋白酶溶液的配制
准确称取牛胰蛋白酶6.3 mg,溶于50 ml 0.001 mol/l HCl,现配现用。
1.3.3 牛胰蛋白酶底物N-α-苯甲酰-DL-精氨酰-4-硝基苯胺盐酸盐(BAPNA)配制
称取60 mg BAPNA,加入2 ml二甲基亚砜,5 min后BAPNA完全溶解,加37℃的Tris缓冲液定容到200 ml,37℃保存在棕色试剂瓶中,现配现用。
1.3.4 胰蛋白酶抑制剂活性(TIA)的测定及计算方法
1.3.4.1 TIA测试方法
TIA的测定原理参照AACC 71-10法[10],即胰蛋白酶作用于反应底物BAPNA,释放出黄色的对硝基苯胺,在410 nm波长有最大吸收峰;当有胰蛋白酶抑制剂存在时,可以抑制这一反应,使最大吸收峰值下降,其下降程度与TIA呈正比。
试验操作包括4个组,即试剂对照组、样品对照组、非抑制组、样品组。样品对照组和样品组分别取制备好的大豆样品50、100、200 μl加入试管,试剂对照组及非抑制组不加入大豆样品,所有试管再依次加入50 μl已温育到37℃的胰蛋白酶液,再分别加入950、900、850、750 μl的反应缓冲液Tris,随即样品对照组及试剂对照组分别各加入500 μl 30%冰醋酸溶液摇匀,所有试管37℃水浴20 min,结束后按顺序依次加入2.5 ml BAPNA摇匀,非抑制组和样品组在加入BAPNA后计时20 min,依次加入500 μl 30%醋酸,摇匀。当反应停止后,3 500 r/min离心10 min,在410 nm下使用多功能酶标仪测定OD值。
1.3.4.2 TIA及相对抑制率值的计算
以未添加胰蛋白酶抑制剂样品组数据为0刻度,将数据做回归曲线,TIA值计算公式:
TIA(mg/g)=回归曲线系数(OD/ml)×胰蛋白酶质量(mg)×添加的NaOH体积(ml)/[胰蛋白酶抑制剂样品质量(g)×非抑制组OD值];
相对抑制率(%)=(热处理后大豆测定TIA/相应未处理大豆测定TIA)×100。
每个样品测定3次作为平行。
1.3.5 蛋白质溶解度测试方法及结果计算
1.3.5.1 蛋白质溶解度(PS)测定[11]
称取1.5 g粉碎过筛处理后的大豆粉,放入烧杯中,加入75 ml 0.2%的KOH溶液,在磁力搅拌器中搅拌20 min。将搅拌好的液体转入离心管中,以2 700 r/min转速离心10 min。离心停止以后,吸取上清液15 ml,放入消化管中,用凯氏定氮法测定其中蛋白质含量,此含量相当于0.3 g试样中溶解在0.2%KOH里的蛋白质的量。
1.3.5.2 蛋白质溶解度(PS)的结果计算
蛋白质溶解度(%)=15 ml上清液中粗蛋白质的质量/0.3 g样品中粗蛋白含量×100。
每个样品测定3次作为平行。
2 试验结果
2.1 加热对大豆胰蛋白酶抑制剂活性的影响
胰蛋白酶抑制剂在大豆中的各部位均有分布,但主要存在于大豆的种子中。大豆种子中胰蛋白酶抑制剂的含量可达总蛋白的6%~8%[12]。经过60~120℃不同加热处理后大豆中胰蛋白酶抑制剂的活性变化如图1~图3及表1、表2所示。

图1 1 h不同加热温度对胰蛋白酶抑制剂活性的影响
图1表明,同一处理条件下,非转基因大豆的胰蛋白酶抑制剂活性(TIA)均较转基因大豆的低,未处理组非转基因大豆的胰蛋白酶抑制剂活性比转基因大豆的低9.91%。干热处理可以降低转基因及非转基因大豆的TIA值(P<0.05)。转基因大豆在60℃和80℃的加热温度下加热1 h,胰蛋白酶抑制剂活性(TIA)降低的不是很快(如图3所示,相对抑制率分别为7.99%和11.1%),与未处理组无显著性差异(P>0.05)。由图1可知,当温度升至100℃,甚至120℃时,其活性迅速下降,与未处理组存在统计学差异(P<0.05)。经过1 h加热,转基因大豆的TIA总体仍维持在较高水平,120℃热处理组的TIA为未处理组的56.43%。非转基因大豆经各处理温度1 h加热后,大豆胰蛋白酶抑制剂活性亦迅速降低(P<0.05)。除60℃组与未处理组无统计学差异外(P>0.05),其它各组与未处理组相比差异显著(P<0.05)。非转基因大豆经120℃、1 h加热后,TIA已降至未处理时的28.80%。

图2 2 h不同加热温度对胰蛋白酶抑制剂活性的影响

图3 不同热处理对胰蛋白酶抑制剂相对抑制率的影响

表1 不同加热温度和时间对转基因大豆胰蛋白酶抑制剂活性影响的方差分析
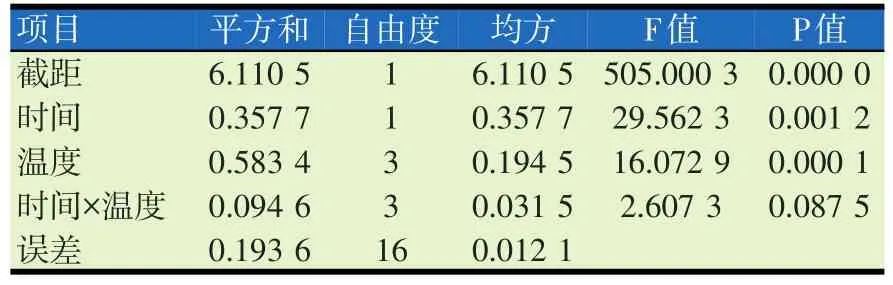
表2 不同加热温度和时间对非转基因大豆胰蛋白酶抑制剂活性影响的方差分析
如图2所示,加热时间延长至2 h时,60℃处理即可使转基因大豆TIA迅速降低至较低水平,胰蛋白酶抑制剂的相对抑制率达到42.19%。之后,随着温度的上升,大豆胰蛋白酶抑制剂活性继续降低,但降低幅度有所减小。除80℃和100℃热处理组间无统计学差异外(P>0.05),其它各组间均存在显著性差异(P<0.05)。与转基因大豆相似,非转基因大豆经过60℃、2 h加热,TIA亦迅速降低至较低水平。之后,随着温度的升高,大豆TIA下降幅度均较小,60、80、100℃热处理组间均无统计学差异(P>0.05)。120℃、2 h可有效抑制大豆TIA,在该条件下转基因和非转基因大豆的胰蛋白酶抑制剂活性的相对抑制率分别为73.64%和78.79%。
如图3所示,胰蛋白酶抑制因子的相对抑制率随着加热时间和温度的变化而变化。由表1、2可知,不同加热温度和时间对转基因大豆和非转基因大豆胰蛋白酶抑制剂活性的影响无交互作用。转基因大豆及非转基因大豆经过120℃、2 h的热处理后相对抑制率均达到70%以上,非转基因大豆的相对抑制率几乎每种处理下都高于转基因大豆。
2.2 加热对大豆蛋白质溶解度的影响
经过不同温度(60~120℃)、不同加热时间(1、2 h)处理后大豆中蛋白质溶解度的变化如图4及表3、表4所示。随着加热温度的升高,转基因和非转基因大豆的蛋白质溶解度均发生波动,且呈现出无规则的变化趋势。试验结果显示,各组大豆的蛋白质溶解度均在69.85%至78.06%之间。由表3、4可知,不同加热温度和时间对转基因大豆和非转基因大豆蛋白质溶解度的影响有交互作用。

图4 不同热处理对蛋白质溶解度的影响
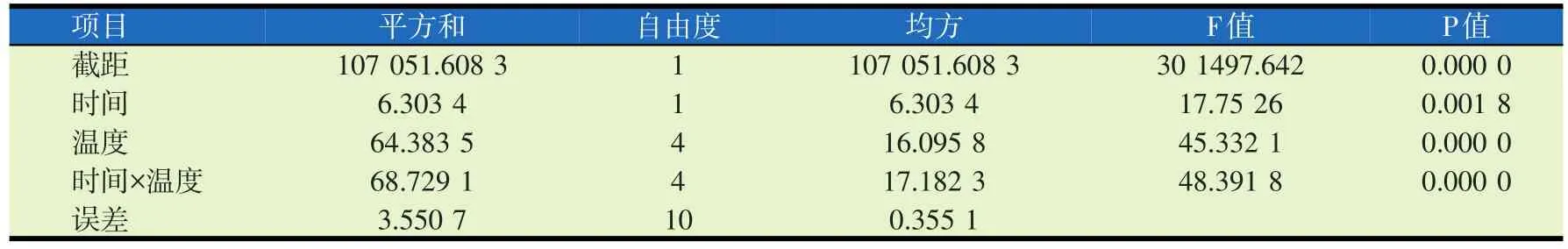
表3 不同加热温度和时间对转基因大豆蛋白质溶解度影响的方差分析

表4 不同加热温度和时间对非转基因大豆蛋白质溶解度影响的方差分析
3 讨论
3.1 大豆胰蛋白酶抑制剂及其钝化方法探讨
国内外大豆胰蛋白酶抑制剂的研究有较长历史[13],目前国外研究较多地集中在胰蛋白酶抑制剂的结构及其与靶酶的作用机理、胰蛋白酶抑制剂的基因表达等方面。国内近年对饲料中胰蛋白酶抑制剂的去除方法及其效果开展了一些研究,对生产实践起到了指导作用[14]。大豆胰蛋白酶抑制剂等抗营养因子的钝化方法有物理方法、化学方法和生物学方法。化学处理方法的原理为化学物质与抗营养因子中的二硫键结合,使其分子结构改变而失去活性,但是具有药品残留的问题。理论上讲,生物学方法是降解大豆抗营养因子最彻底的手段,但是酶制剂的耐受性、稳定性以及影响酶制剂作用的外在因素等问题有待进一步深入研究[15]。物理方法是最常用的方法,利用胰蛋白酶抑制剂的热敏感性对抑制剂进行钝化处理。在未来的研究中我们需注重不同钝化方法的交叉结合工艺创新,做到在不影响大豆及其制品营养成分流失的前提下,最大限度去除抗营养因子。
3.2 转基因和非转基因大豆的对比研究
大豆、菜籽和玉米都是鱼粉的优质替代蛋白源,目前国际市场上提供的这些原料大部分都是转基因产品[16]。水产饲料中使用转基因作物对养殖鱼类的安全和质量的影响需要进行研究和评价。Sanden等(2004)[16]指出,水产饲料使用转基因大豆的影响主要出于两方面的考虑:①养殖鱼类的安全,是否影响鱼类的生理、生化指标,尤其是生长;②食品安全,转基因片段转移并残留于鱼体。Hammond等(1996)[17]和 Padgette等(1995)[18]使用转基因大豆和非转基因大豆对鲶进行养殖试验,发现鲶的增重和鱼体成分等参数均无显著差异。Sanden等(2004)[16]研究也发现,大西洋鲑摄食转基因大豆的饲料后,生长状态与摄食非转基因大豆饲料的对照组一致,且转基因片段不残留于鱼体组织。这些研究均符合转基因食品营养评价原则上应遵循“实质等同”的判断标准,即转基因食品的营养价值应与亲本食品没有差别。就本试验检测的产品而言,各处理组转基因大豆的胰蛋白酶抑制剂活性均高于非转基因;并且大豆经过高温加热处理之后胰蛋白酶抑制剂活性可被有效灭活。
3.3 加热对胰蛋白酶抑制剂的影响
大豆胰蛋白酶抑制剂是大豆中主要的抗营养因子,目前被发现的有7~10种,其中两种研究的较为详细,即 Kunitz(KTI)和 Bowman-Birk(BBI)[19]。Kunitz型抑制因子有一个活性中心,可等量结合肠道胰蛋白酶,被称为单头抑制;Bowman-Birk型抑制因子有两个活性中心,可分别结合胰蛋白酶和糜蛋白酶,被称为双头抑制。由于结构上的差异,KTI对抗酸、抗热的能力比BBI要弱。加热会使大豆胰蛋白酶抑制剂失活,但是热处理效果受到大豆品种、含水量、颗粒大小及加热温度、压力和时间的影响。Gujska等(1991)[20]报道,加热温度在130~140℃之间,不论热处理过程压力多大、颗粒形状大小如何,均可以有效地钝化超过85%的胰蛋白酶抑制剂。本试验中,转基因大豆和非转基因大豆的胰蛋白酶抑制剂活性均随着加热温度的升高和加热时间的延长而降低。这与梁玉梅等(2006)[21]和 Anderson(1992)[22]的研究结果一致。加热时间为1 h时,非转基因大豆胰蛋白酶抑制剂活性降低的幅度大于转基因大豆,即非转基因大豆胰蛋白酶抑制剂活性对于热处理更为敏感,这可能与转基因和非转基因大豆中不同类型胰蛋白酶抑制剂的含量不同有关,有待进一步研究。
对大豆热处理适宜程度一般是以抗营养因子的活性来判断的。Honig等(1987)[23]、Liener(1994)[9]、林建斌等(1999)[24]的研究认为,大豆胰蛋白酶抑制剂活性只要失活75%~85%,大豆蛋白质的营养效价最高。本试验中,转基因大豆和非转基因大豆通过120℃、2 h的热处理都达到了胰蛋白酶抑制剂活性失活73.64%~78.79%的程度,因此120℃、2 h可以作为本试验中最优处理条件。
3.4 加热对蛋白质溶解度的影响
加热程度对大豆的营养品质影响较大。加热不足,胰蛋白酶抑制剂破坏不充分,降低蛋白质的消化率;加热过度,虽然胰蛋白酶抑制剂已失活,但会使蛋白质发生变性,溶解度降低,特别是引起赖氨酸、精氨酸和胱氨酸的破坏或消化率降低[25]。目前,国内外并无以蛋白质溶解度评价大豆的生熟度的统一标准。杨秀文等(1995)[26]用肉鸡做试验,以蛋白质溶解度为判断指标,认为PS>85%时为过生,70%≤PS≤85%时为加热正常,PS<70%时为加热过熟;梁邢文(1995)[27]认为,蛋白质溶解度在60%~80%之间为加热适度;曹志华等(2004)[28]研究认为,大豆加热过生时,PS>87%,而过熟则PS<41%。从本试验的结果可看出,各组大豆的蛋白质溶解度均在69.85%至78.06%之间,属于正常加热。但是随着加热温度的升高,大豆蛋白质溶解度发生无规则波动。因此,推测蛋白质溶解度不是评判大豆生熟度的最适指标。
4 结论
水产饲料中鱼粉的需求量和价格的不断上升以及产量的日趋下降,寻找优质的替代蛋白源已成为水产养殖业可持续发展的关键问题。大豆作为优质鱼粉替代物被广泛地加以研究,然而胰蛋白酶抑制剂的存在限制了其应用。因此,对大豆胰蛋白酶抑制剂的钝化研究十分必要。本试验结果表明,转基因大豆含有较高的胰蛋白酶抑制剂;随着加热温度的提高和加热时间的延长,转基因和非转基因大豆的胰蛋白酶抑制剂的活性逐渐降低;加热处理与大豆蛋白质溶解度的相关性差。
