海洋来源生物活性肽的酶解工艺及其研究
2013-02-20陈忆凤曹婷婷邹思思
■陈忆凤 曹婷婷 张 丽 邹思思
(1.江苏天福莱集团有限公司,江苏连云港 222062;2.淮海工学院,江苏连云港 222005)
传统代谢模型认为蛋白质必须水解成氨基酸后才能被吸收利用,饲料中氨基酸比例符合理想蛋白质模型就能获得最大的营养效果。但是现代研究认为,蛋白质在动物消化酶作用下的水解终产物大部分是由2个或3个氨基酸残基组成的小肽,它们以完整形式被吸收进入循环系统而被组织利用[1]。小肽一般是指二肽或三肽,小肽饲料就是通过化学或生物方法将本来不适合动物利用的蛋白原料分解,制成含有大量小肽的饲料产品[1]。肽营养作用的新认识是蛋白质在酶解过程中可以产生一些具有特殊生理功能的生物活性肽。这些生物活性肽在调节胃肠道运动、调节免疫系统、抗高血压、抗菌、抗血栓、抗病毒、抗癌、清除自由基和促进矿物元素吸收等方面发挥着重要作用[2]。
小肽饲料的营养价值在于小肽的吸收优势和其自身的质量。小肽作为蛋白质的主要消化产物,在氨基酸消化、吸收以及动物营养代谢中起着重要的作用。小肽饲料是一种功能营养性添加剂,也称为小肽营养素。小肽能完整地通过肠黏膜细胞进入体循环,小肽的吸收具有转运速度快、耗能低、载体不易饱和等优点,且各种肽之间转运无竞争性与抑制性[1]。小肽的营养作用已被越来越多的人们所重视,小肽在饲料工业中的应用对提高水产动物的生长速度、提高机体免疫力、改善饲料的适口性,促进水产动物的摄食量,提高饲料转化率,降低饲料成本,减少资源浪费等方面具有十分重要的作用[3]。
海洋捕捞小杂鱼[4]包括虾唬鱼、拔头鱼、鹤针鱼、海龙鱼、鳀鱼等,其胰液中含有降解主要营养物质的各种酶类,具有小杂鱼消化食物最主要、消化力最强的酶系,其活性高低与动物的消化机能直接相关。小杂鱼的内源酶包括蛋白酶、淀粉酶、糖化酶和脂肪酶等,鱼体蛋白酶包括胰蛋白酶、胃蛋白酶和少量肠道蛋白酶,而其中的胰蛋白酶又为小杂鱼体内存在的主要酶。
近年来,国内外内源酶的研究主要集中在对植源性小肽[5-6]和医学方面的研究,也有少量动物源性小肽的研究,但是由于研究对象均为单独个体,大规模生产中原料来源不充足甚至困难,所以都无法在实践上实现产业化的目标,且没有统一、规范的简便方法来测定小肽含量。利用海洋低值鱼内源酶自体酶解得到小肽的研究几乎没有,且尚无大规模生产的报道。胰蛋白酶是内源蛋白酶酶解制备小肽的主要酶系,本研究通过研究海洋低值鱼内源酶最佳酶解条件,寻求低成本、高效益的小肽生产工艺条件,同时得到氨基酸生产的工艺条件。
1 试验材料与方法
1.1 材料与方法(凯氏定氮法[7])
1.1.1 设备与试剂
设备包括:蛋白质消化炉(上海纤检仪器有限公司)、蛋白质蒸馏仪(上海纤检仪器有限公司)、恒温干燥箱(吴江诺阳电热设备厂)、电子分析天平(常熟市双杰测试仪器厂)。
试剂包括:硫酸(99%)、硫酸铜(固体粉末)、硫酸钾(固体粉末)、氢氧化钠(40%)、硼酸(2%)、混合指示剂[(溴甲酚绿的0.1%乙醇溶液的体积)∶(甲基红0.2%乙醇溶液的体积)=3∶1]、盐酸标准溶液(0.02 mol/l)。
①福林酚试剂的制备:同常规方法。实际使用溶液:1份福林试剂与2份水混合,摇匀。
② Britton-Robinson广泛缓冲液的配制:取2.71 ml正磷酸,2.36 ml冰乙酸,2.47 g硼酸,加蒸馏水定容至1 000 ml。取100 ml该溶液与0.2 mol/l的NaOH溶液混合,所得溶液的pH值和所需NaOH溶液的体积如表1所示。
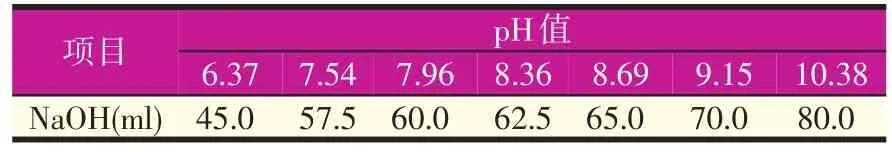
表1 B-R缓冲液的配制
③1%酪素溶液的配制:同常规方法,此溶液在冰箱内贮存,有效期为3 d。
④ 100 μg/ml L-酪氨酸标准溶液的配制:同常规方法。
1.1.2 试验方法
1.1.2.1 试样的消化
试样为液体时,用移液管吸取试样15 ml放入消化瓶中,加入6.4 g催化剂,与试样混合均匀,再加入12 ml硫酸,将凯氏烧瓶置于电炉上加热,呈透明的蓝绿色,然后再继续加热,至少2 h。
试样为固体时,称取试样0.5~1 g,准确至0.000 2 g,放入凯氏烧瓶中,加入6.4 g催化剂,与试样混合均匀,再加入12 ml硫酸,将凯氏烧瓶置于电炉上加热,呈透明的蓝绿色,然后再继续加热,至少2 h。
1.1.2.2 氨的蒸馏(常量蒸馏法)
将试样消煮液冷却,加入30 ml蒸馏水,摇匀,冷却。将蒸馏装置的冷凝管末端浸入装有25 ml硼酸吸收液和2滴指示剂的锥形瓶,使溶液混匀后再加热蒸馏,直至流出液体积接近150 ml。降下锥形瓶,使冷凝管末端离开液面,继续蒸馏1~2 min,并用蒸馏水冲洗冷凝管末端,洗液均需流入锥形瓶内,然后停止蒸馏。
1.1.2.3 滴定
吸收液立即用盐酸标准溶液滴定,溶液由蓝色变成灰红色为终点。
1.1.3 数据计算

式中:X——样品中蛋白质的质量分数(%);
V2——滴定试样时所需标准酸溶液体积(ml);
V1——滴定空白时所需标准溶液体积(ml);
C——盐酸标准溶液浓度(mol/l);
M——试样质量(g);
V——试样分解液总体积(ml);
V3——试样分解液蒸馏用体积(ml);
0.014——每毫克当量氮的克数;
6.25——氮换算成蛋白质的平均系数。
1.1.4 标准曲线的测定
① L-酪氨酸标准溶液的配制见表2。

表2 L-酪氨酸标准溶液的配制
②分别取上述溶液各1.00 ml,各加0.4 mol/l碳酸钠溶液5.00 ml,福林试剂使用溶液1.00 ml,置于(40±0.5)℃水浴中显色20 min,取出置于10 mm比色皿中,用分光光度计于波长680 nm,以不含酪氨酸的0管为空白,分别测定其吸光度(A680),以吸光度A为纵坐标,酪氨酸的浓度C为横坐标,绘制标准曲线(此线应通过零点)。
根据作图或回归方程,计算出当吸光度为1时的酪氨酸的量(μg),即为吸光度常数K的值,K值应在95~100范围内。
1.1.5 内源蛋白酶的酶活测定
①酶液的制备
小鱼20 g加入4倍预冷的蒸馏水➝匀浆➝静置15 min➝4 000 r/min离心20 min➝取上清液5 ml,用0.03 mol/l CaCl2溶液定容至25 ml➝静置15 min➝取1 ml,加入预冷的适宜pH值的广泛缓冲液定容至50 ml,为待测酶样液。
②吸光度测定
先将酪素溶液放入(40±0.5)℃恒温水浴中,预热5 min。用10 mm比色皿于680 nm波长测定吸光度。

式中:X——样品的酶活力(U/g或U/ml);
A——样品平行试验的平均吸光度;
K——吸光常数;
4——反应试剂的总体积(ml);
10——反应时间以10 min计;
n——稀释倍数。
1.2 氨态氮含量试验的材料和方法[8]
1.2.1 试剂和设备
试剂包括甲醛溶液(37%~40%)、0.05 mol/l氢氧化钠标准溶液。
设备包括酸度计(PHs-2F数字pH计)、磁力搅拌(CJJ-931磁力搅拌器)、HH数显恒温水浴锅、FS-1高速匀浆机、FA1604分析天平。
1.2.2 试验方法
准确吸取5.0 ml小杂鱼酶解混合物,置于100 ml容量瓶中,加水定容至100 ml,混匀。吸取20.00 ml上述样品稀释液于200 ml烧杯中,加水60 ml混匀,开动磁力搅拌器,用0.05 mol/l NaOH标准溶液滴定至酸度计指示pH值8.2,再加入10.00 ml甲醛溶液,然后继续滴定至酸度计指示pH值9.2,记录消耗标准溶液的体积(V1)。
取80 ml水,在同样条件下做试剂空白试验,记录消耗标准溶液的体积(V0)。
1.2.3 计算方法
X(%)=[(V1-V0)×C×0.014]/5×(V/100)×100。
式中:X——样品中氨基酸态氮的质量分数(%);
V——测定时吸取样品稀释液体积(ml);
C——氢氧化钠标准溶液浓度(mol/l)。
2 结果与分析
2.1 内源蛋白酶酶活的测定
2.1.1福林酚法测定内源酶酶活测定结果
试验测得的标准曲线的数据及酪氨酸标准曲线见表3及图1(吸光度常数K值为96.9)。
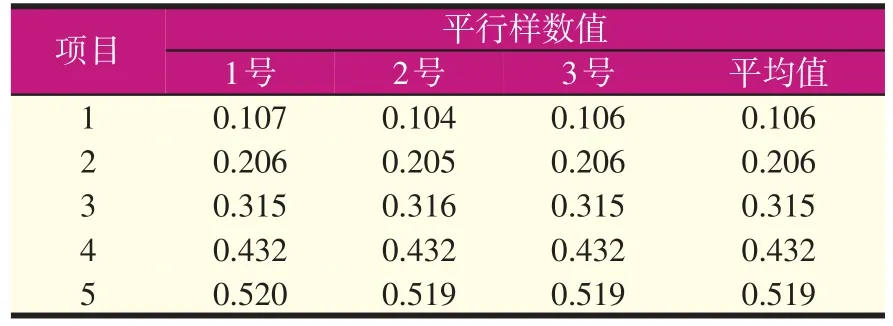
表3 标准曲线数据
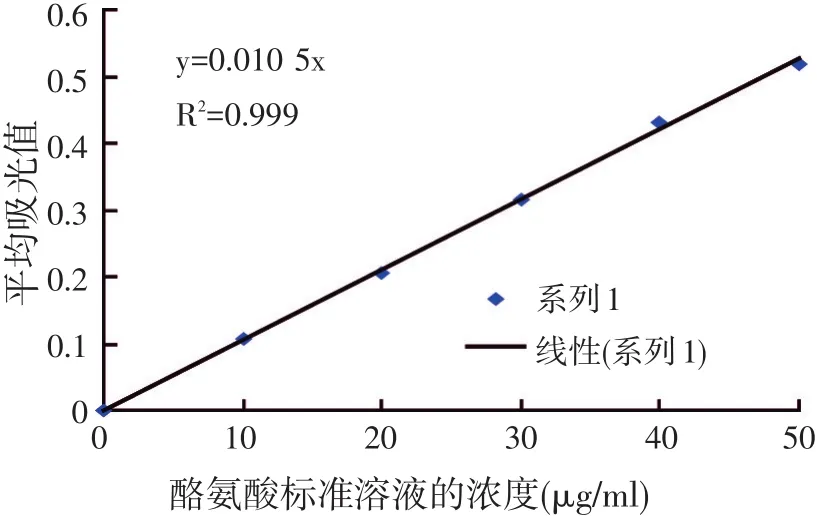
图1 L-酪氨酸标准曲线
2.1.2 氯化钙对内源酶酶活测定结果的影响
氯化钙中的钙离子是某些酶的激活剂,试验中添加氯化钙溶液对内源酶起到了一定的激活作用,结果见表4。
2.2 内源酶作用pH值和温度范围的初步确定
2.2.1 内源酶作用pH值的初步确定
在不同的pH值条件下,内源酶酶活的测定结果见图2。

图2 内源酶作用pH值的初步确定
由图2可知,当pH值在6.5~8.5范围内变化时,内源酶的酶活力比较高。
2.2.2 内源酶作用温度的初步确定
在不同的温度条件下,内源酶酶活的测定结果见图3。
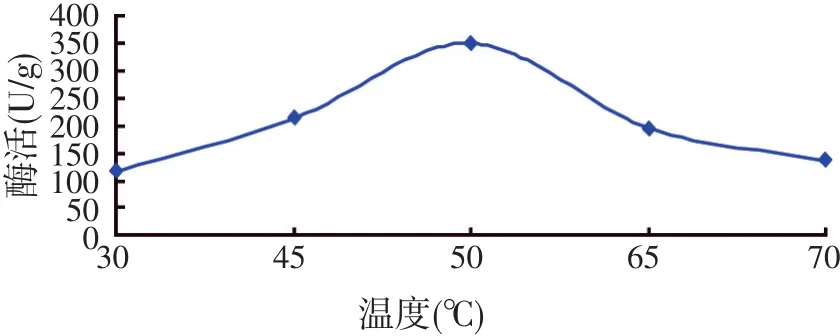
图3 内源酶作用温度的初步确定
由图3可知,当温度在45~65℃范围内变化时,内源酶的酶活力比较高。
2.3 单因素试验
海洋低值鱼酶解后将产生氨基酸、小肽、部分蛋白质。以TCA可溶性氮含量为指标,进行小肽产品单因素试验,确定小肽的最佳酶解条件,同时以氨态氮含量为指标,进行氨基酸产品单因素试验,确定氨基酸产品酶解条件,即单因素试验1:优化酶解得到小肽产品的条件。单因素试验2:优化酶解得到氨基酸产品的条件。
2.3.1 单因素试验1(优化酶解得到小肽产品的条件)
2.3.1.1 最适温度
试验条件:20 g小杂鱼+80 ml水、pH值为7.0、酶解时间3 h。在不同的温度下,进行小杂鱼内源蛋白酶酶解试验,测定TCA可溶性氮含量,测定结果见图4。
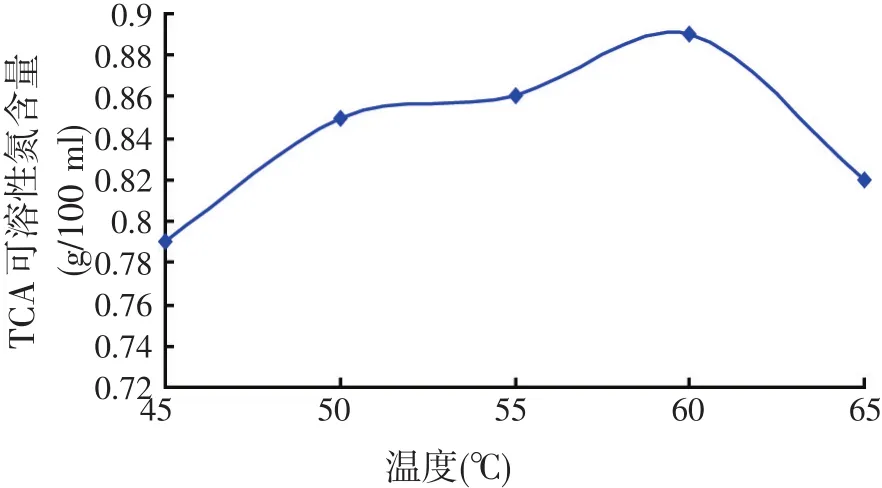
图4 不同温度条件下TCA可溶性氮含量
由图4可知,TCA可溶性氮含量在60℃时达到最高点,但随着温度的继续升高,其含量呈下降趋势。这是因为在一定的温度范围内,温度升高有利于加速酶的催化反应,而当温度超过最适温度时,有一部分内源酶会发生变性,酶活力反而下降。
2.3.1.2 最适pH值
试验条件:20 g小杂鱼+80 ml水、温度60℃、酶解时间3 h。在不同的pH值下,进行小杂鱼内源蛋白酶酶解试验,测定TCA可溶性氮含量,测定结果见图5。
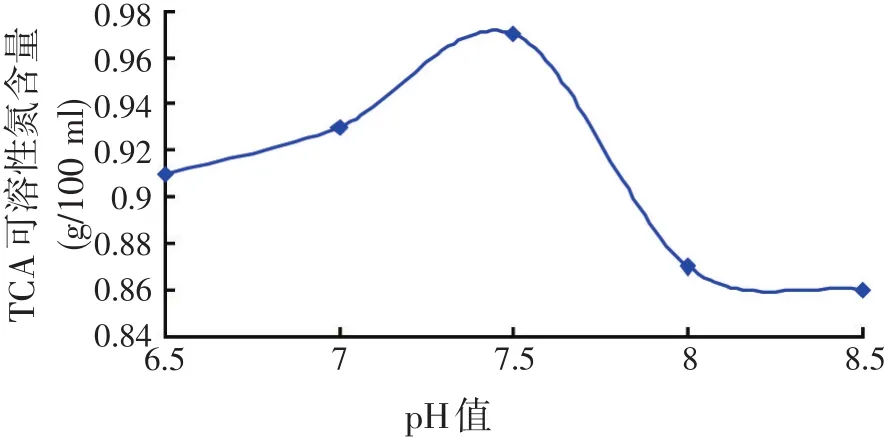
图5 不同pH值条件下TCA可溶性氮含量
由图5可知,在最适温度60℃下,随着pH值的增大,TCA可溶性氮含量升高,但到7.5后开始下降。这是因为pH值影响了底物的解离状态,或者使底物不能和酶结合,或者结合后不能生成产物,从而导致酶的活性降低,即蛋白质的水解度降低,TCA可溶性氮含量减少。根据数据和图表,可知TCA可溶性氮含量的最适pH值范围为7~7.5。
2.3.1.3 最适时间
试验条件:20 g小杂鱼+80 ml水、温度60℃、pH值为7.5。在不同的时间下,进行小杂鱼内源蛋白酶酶解试验,测定TCA可溶性氮含量,测定结果见图6。
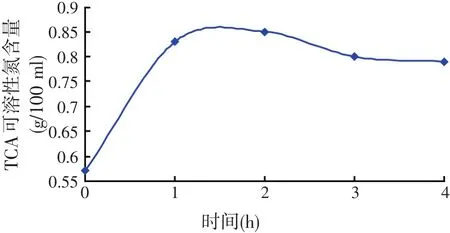
图6 不同时间条件下TCA可溶性氮含量
由图6可知,当酶解时间为2 h时,TCA可溶性氮的含量最高。随着反应时间的增加,水解液中可溶性氮的含量也在增加,它们会与未水解的小杂鱼鱼肉蛋白底物竞争结合酶,蛋白质的水解程度会降低,TCA可溶性氮的含量也相应减少。
2.3.1.4 最佳固液比
试验条件:温度60℃、pH值为7.5、酶解时间2 h。在不同的固液比下,进行小杂鱼内源蛋白酶酶解试验,测定TCA可溶性氮含量,测定结果见图7。

图7 不同底物浓度条件下TCA可溶性氮含量
由图7可知,在其它的最适条件下,当固液比为1∶3时,TCA可溶性氮含量达到最高。随着底物浓度变小,TCA可溶性氮含量有所下降。考虑到实际生产中加水量越多,生产成本相应越高,选取固液比为1∶3。此时,酶与底物反应时的比例也是比较适宜的,有利于酶促反应的进行,得到的小肽含量也就相应更多。
2.3.2 单因素试验2(优化酶解得到氨基酸产品的条件)
2.3.2.1 最适温度
试验条件:20 g小杂鱼+80 ml水、pH值为7.0、酶解时间3 h。在不同的温度下,进行小杂鱼内源蛋白酶酶解试验,测定氨态氮含量,测定结果见图8。

由图8可知,当温度为55℃时,氨态氮含量最高。随着温度的继续升高,氨态氮含量下降。
2.3.2.2 最适pH值
试验条件:20 g小杂鱼+80 ml水、温度55℃、酶解时间3 h。在不同的pH值下,进行小杂鱼内源蛋白酶酶解试验,测定氨态氮含量,测定结果见图9。
由图9可知,在最适温度为55℃时,氨态氮含量在pH值为7时达到最大,随后又下降。氨态氮含量的最适pH值范围为6.5~7.5。
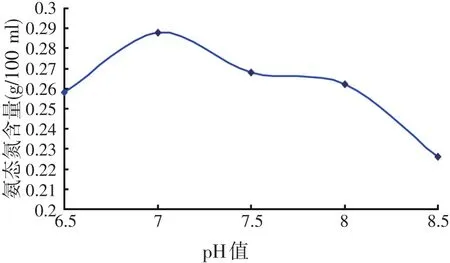
图9 不同pH值条件下氨态氮含量
2.3.2.3 最适时间
试验条件:20 g小杂鱼+80 ml水、温度55℃、pH值为7.0。在不同的时间下,进行小杂鱼内源蛋白酶酶解试验,测定氨态氮含量,测定结果见图10。
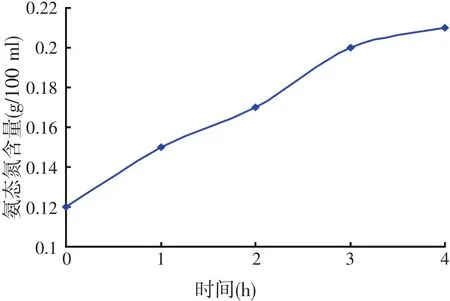
图10 不同时间条件下氨态氮含量
由图10可知,在时间为3 h时,氨态氮含量增大的趋势接近平稳。所测数据表明,酶解得到氨态氮含量的最适时间为3~4 h。
2.3.2.4 最适固液比
试验条件:温度55℃、pH值为7.0、酶解时间3 h。在不同的固液比下,进行小杂鱼内源蛋白酶酶解试验,测定氨态氮含量,测定结果见图11。

图11 不同底物浓度条件下氨态氮含量
由图11可知,当固液比为1∶3时,氨态氮含量达到最高。随着底物浓度变稀,其含量有下降趋势。考虑到实际生产中加水量越多,生产成本相应越高,选取固液比为1∶3是比较适合的。
2.4 正交试验
根据单因素试验结果,选取温度、时间、pH值、底物浓度为因素,各取3水平,以TCA可溶性氮含量和氨态氮含量为指标,分别进行正交试验[9]。
2.4.1 小肽产品正交试验
小肽产品因素水平设计见表5,小肽产品正交试验结果见表6。

表5 小肽产品因素水平设计
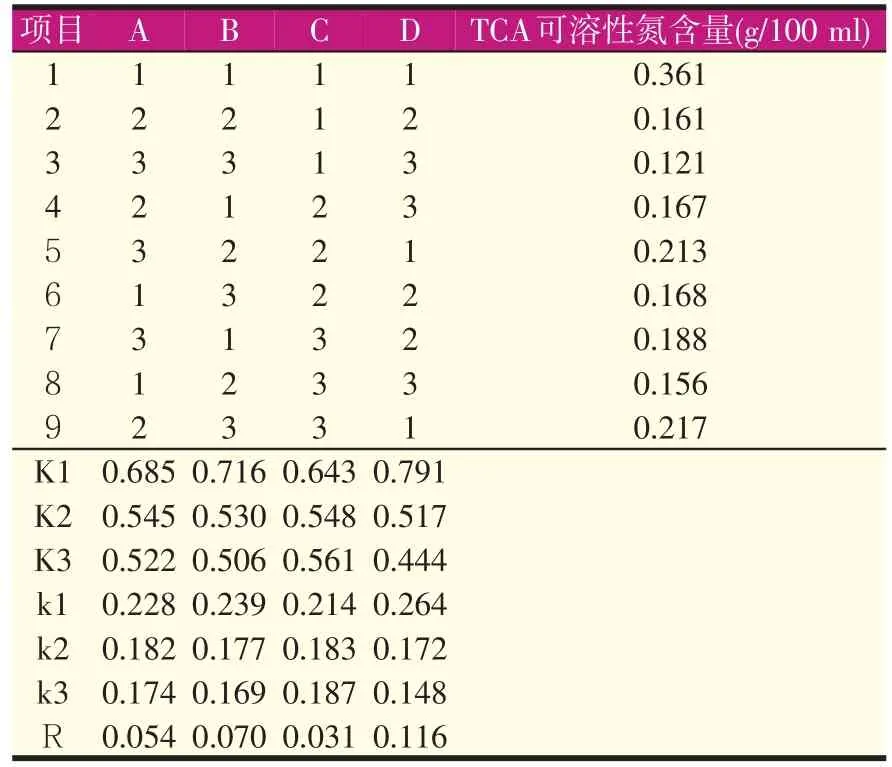
表6 小肽产品正交试验结果
由极差R值可知:D>B>A>C,即底物浓度为最重要影响因素,温度和pH值次之,时间为最小影响因素。从正交试验结果可知:最佳的酶解条件为A1B1C1D1,即pH值7、温度55 ℃、时间1 h、固液比1∶2,此组合所测定的可溶性氮含量数值也最高(0.361 g/100 ml)。
2.4.2 氨基酸产品正交试验
氨基酸产品因素水平设计见表7,氨基酸产品正交试验结果见表8。

表7 氨基酸产品因素水平设计
由极差R值可知:D>B>A>C,即底物浓度为最重要影响因素,温度和pH值次之,时间为最小影响因素。从正交试验结果可知:最佳的酶解条件为A1B2C3D1,即pH值6.5、温度55 ℃、时间3.5 h、固液比1∶2。
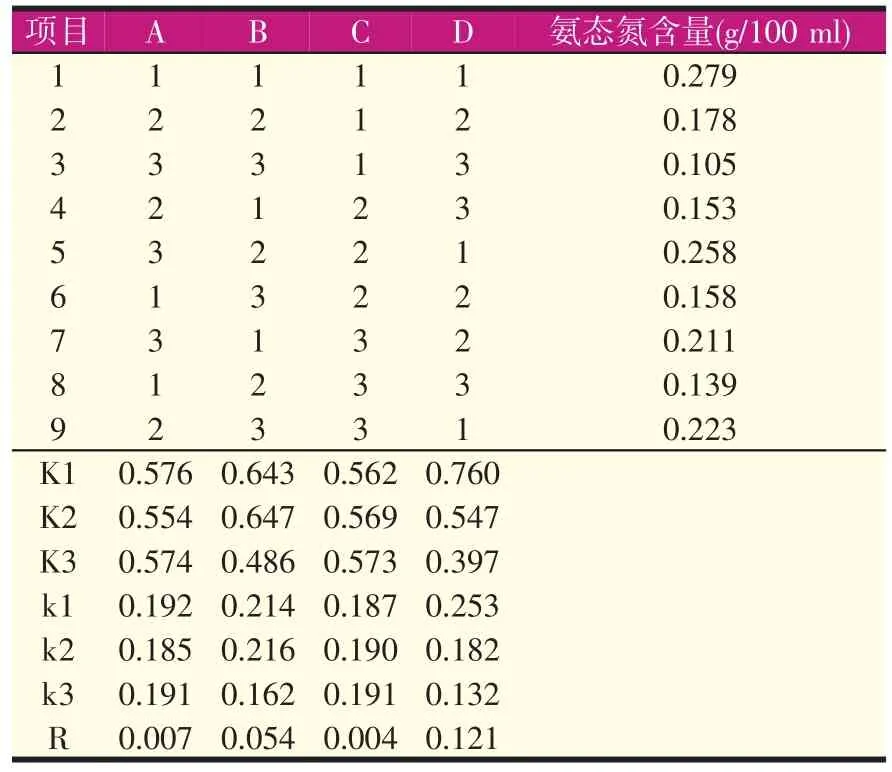
表8 氨基酸产品正交试验结果
3 结论
本试验对海洋捕捞小杂鱼内源蛋白酶酶活的测定进行了分析,并利用内源蛋白酶对小杂鱼酶解条件进行了研究。由试验可知:
①氯化钙中的钙离子是某些酶的激活剂,所以添加氯化钙溶液对内源酶起到了一定的激活作用,由试验结果可知,用0.03 mol/l的氯化钙溶液激活内源酶,效果最好。
②通过正交试验对海洋捕捞小杂鱼内源蛋白酶酶解工艺条件进行优化,确定了小肽和氨基酸产品最佳酶解工艺条件。
小肽产品的最佳酶解工艺条件:最佳酶解温度55℃、最佳酶解时间1 h、最佳pH值7.0、最佳固液比1∶2;氨基酸产品的最佳酶解工艺条件:最佳酶解温度55℃、最佳酶解时间3.5 h、最佳pH值6.5、最佳固液比1∶2。
与之前的独立的试验用海洋低值鱼的最佳工艺条件试验数据相比,胰蛋白酶酶解获得的小肽产品的最佳酶解时间是3~4 h,而本试验用内源酶来酶解时,获得的小肽产品的最佳酶解时间1 h,最佳反应时间大大缩短,两者的其它最佳酶解条件基本一致。从经济成本考虑,用胰蛋白酶来酶解,经济成本较高,而用小杂鱼自身的内源酶系来酶解,可以节约成本,而且酶解所需的温度和固液比也符合生产要求。
本研究结果完全符合本课题的最初要求,工艺过程简单,便于操作,提高饲料厂场地利用率,缩短小肽制备时间,并利于现代化管理与控制,提高劳动生产率,适合工业化大生产。
