红旱莲总黄酮对黄嘌呤氧化酶抑制作用及抗氧化研究
2013-02-19张国文胡明明
周 佳, 张国文, 胡明明
(南昌大学 食品科学与技术国家重点实验室,江西 南昌330047)
黄嘌呤氧化酶(Xanthine Oxidase,简称XOD)在核酸的分解代谢中起到重要的作用,其在催化黄嘌呤和次黄嘌呤氧化的过程中不仅会生成尿酸而且能够产生超氧阴离子和过氧化氢等过氧化物自由基。尿酸浓度过高会导致高尿酸血症并引起痛风发作[1],过氧化物自由基在体内积累导致的脂质过氧化和自由基损伤与许多疾病的发生和发展有密切关系,如衰老、肿瘤、心脑血管疾病[2-3]。因此黄嘌呤氧化酶抑制剂不仅能够预防及治疗痛风病症而且具有间接减少体内自由基的作用。
红旱莲为藤黄科、金丝桃属多年生草本植物,主要分布在我国东北地区及黄河、长江、珠江流域。全草入药,有平肝、止血、败毒和消肿的作用[4]。据研究报道,红旱莲中主要的活性成分为槲皮素、山奈酚、金丝桃苷等黄酮类和氧杂蒽酮类化合物[5],其提取物具有抗炎、镇痛、抗氧化、组胺释放抑制等作用[6]。近年来由于氧杂蒽酮类化合物在抗抑郁症方面的作用使红旱莲受到了广泛的关注,然而对于红旱莲中类黄酮的生物活性研究较少。作者通过对红旱莲总黄酮抑制黄嘌呤氧化酶及其抗氧化能力的研究,评价红旱莲总黄酮的相关生物活性,以期为合理开发利用红旱莲资源提供科学依据。
1 材料与方法
1.1 材料与仪器
红旱莲,购于河北安国中药材市场,产地湖南。50℃烘干后粉碎过60目筛。
总抗氧化能力(T-AOC)测定试剂盒:南京建成生物工程研究所产品;芦丁:中国药品生物制品检定所产品;黄嘌呤氧化酶(35.7 U/mL)、黄嘌呤:北京索莱宝科技有限公司产品;别嘌呤醇:Sigma公司产品;其他试剂均为分析纯。
UV-2450紫外-可见分光光度计:日本岛津公司产品;F-4500型荧光光度计:日本日立公司产品;HH-2数显恒温水浴锅:江苏荣华仪器制造产品;pHS-3C型酸度计:上海雷磁仪器厂产品。
1.2 方法
1.2.1 样品溶液的制备 提取液经NKA-9大孔树脂初步纯化。纯化后的红旱莲黄酮溶液在45℃条件下真空旋转蒸发为棕黄色膏状物后真空冷冻干燥。高效液相色谱分析得出纯化物主要含有斛皮素、山奈酚、金丝桃苷、芦丁、异斛皮素等黄酮类成分,总黄酮质量分数为44.7%。
1.2.2 XOD抑制作用 XOD催化黄嘌呤产生尿酸并在290 nm处有特征吸收峰,采用紫外分光光度计的动力学/时间软件每隔10 s测定一次吸光度,共测20次,在这段时间内吸光度随时间呈线性增加,斜率为反应速率(斜率越大,说明酶的活力越强)[2]。 移取 1.75 mL 磷酸盐缓冲溶液(pH 7.5)、0.05 mL样品溶液和0.03 mL黄嘌呤氧化酶溶液(终活力3 mU/mL)混合,30℃水浴5 min后加入0.17 mL底物溶液黄嘌呤(0.6 mmol/L)启动反应,测定290 nm波长处的吸光度变化并计算斜率R。以缓冲液代替底物溶液,与上述样品相同处理作为空白对照,记录吸光度的变化并计算斜率R0。不加抑制剂时酶的活性定义为100%相对活性,通过式(1)计算不同实验条件下的黄嘌呤氧化酶相对活性[7]。
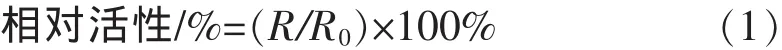
1.2.3 XOD抑制可逆性研究 在测定体系中,固定底物的最终浓度(0.05 mmol/L)不变,改变黄嘌呤氧化酶浓度(1~4 mu/mL),测定不同抑制剂浓度下(1~7 μg/mL),酶的活力对最大反应速率的影响。
1.2.4 XOD抑制动力学研究 在测定体系中,固定酶的终浓度(3 mU/mL),测定不同质量浓度抑制剂(0~10 μg/mL) 条件下, 黄嘌呤的浓度 (0.05~0.2 mmol/L)对反应速率的影响,通过Lineweaver-Burk双倒数方程作图,推断抑制类型。在Lineweaver-Burk双倒数图中求得不同质量浓度抑制剂下的Kmapp值,并以Kmapp值对相应抑制剂质量浓度作图,直线延长与横轴交点即为Ki。
1.2.5 羟基自由基清除能力 根据chung等的方法略作修改[8]。用pH 7.4的磷酸盐缓冲溶液配制不同质量浓度的红旱莲黄酮溶液并分别取2.4 mL于10 mL比色管中,加入0.8 mL 5 mmol/L的硫酸亚铁-EDTA溶液和0.4 mL 10 mmol/L的苯甲酸钠溶液,再加入0.4 mL 10 mmol/L的双氧水溶液。37℃恒温水浴反应2 h后,测定418 nm处溶液的荧光强度。按照式 (2)计算红旱莲总黄酮的羟基自由基清除率。
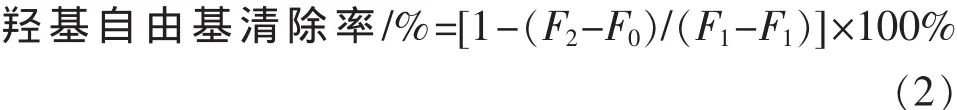
式中F1和F2分别为未加入和加入不同质量浓度红旱莲总黄酮后反应体系的荧光强度;F0为pH 7.4的磷酸盐缓冲溶液的荧光强度。
1.2.6 总还原能力测定 参考Vaquero等[9]的方法。用蒸馏水将红旱莲总黄酮配成不同质量浓度的溶液,取2.4 mL样品溶液、2.5 mL铁氰化钾溶液(1 g/dL)、2.5 mL 磷酸盐缓冲液(pH 6.6),混匀。 50 ℃恒温水浴20 min后,加入2.5 mL三氯乙酸溶液(10 g/dL),混合溶液。取5 mL经3 000 r/min离心10 min的混合溶液于10 mL比色管中,加入1 mL三氯化铁溶液(0.1 g/dL)并用二次蒸馏水定容至10 mL。混匀,静置10 min后,在700 nm波长处测定其吸光值。
1.2.7 总抗氧化能力测定 红旱莲总黄酮总抗氧化能力采用试剂盒进行测定。用二次蒸馏水将红旱莲总黄酮配成不同质量浓度的溶液,按照试剂盒给出步骤进行操作,测定520 nm处反应体系的吸光度。抗氧化实验均使用维生素C(VC)做阳性对照。试剂盒定义为每分钟每毫升样品溶液使反应体系的吸光度(A)值增加0.01为一个总抗氧化能力单位[10]。通过式(3)计算红旱莲黄酮的总抗氧化能力。

式中:AU、AC分别为测定管和对照管在波长520 nm处的吸光度值;Vt为反应溶液的总体积;V0为样品溶液的体积;N为样品溶液的稀释倍数。
2 结果与分析
2.1 XOD抑制作用研究
图1为不同质量浓度下红旱莲总黄酮对XOD的抑制作用。在2~40 μg/mL的质量浓度范围内,XOD的活性随着红旱莲总黄酮质量浓度的增加而逐渐下降,并呈现一定的浓度依赖关系。红旱莲总黄酮半数抑制质量浓度(IC50)为 11.73 μg/mL,阳性对照别嘌呤醇(AIIopurinol) IC50为 0.579 μg/mL。 红旱莲总黄酮显示出一定的XOD抑制作用。

图1 红旱莲总黄酮及对照对黄嘌呤氧化酶的抑制作用Fig.1 Inhibitory effects of HAF and AIIopurinol on xanthine oxidase
2.2 XOD抑制可逆性判断
如图2所示,不同质量浓度抑制剂条件下,XOD的反应速率对酶的浓度作图得到一系列通过原点但斜率不同的直线,且随着总黄酮质量浓度的增加直线的斜率不断降低。由此推断红旱莲总黄酮对黄嘌呤氧化酶的抑制作用属于可逆抑制作用[11]。
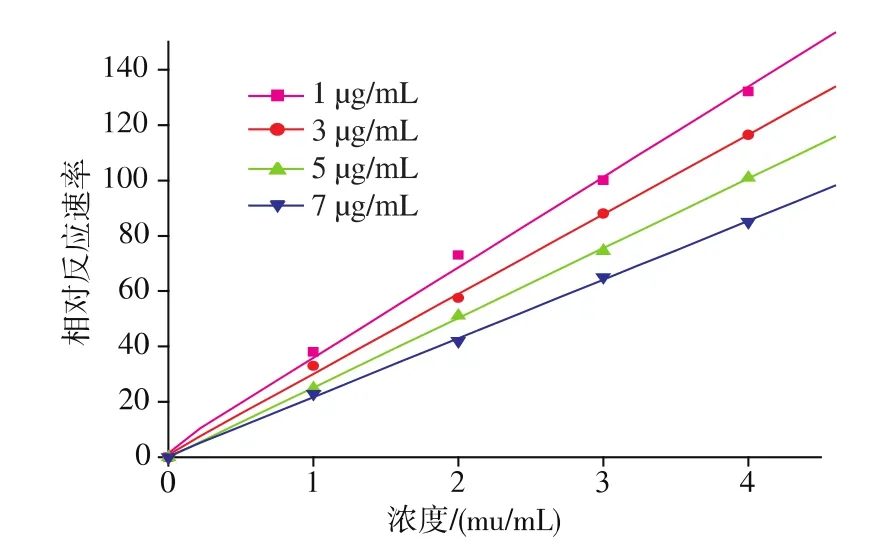
图2 红旱莲总黄酮的抑制可逆性研究Fig.2 Reversible research of HAF
2.3 XOD抑制动力学研究
可逆型抑制剂与酶的作用方式包括竞争性、非竞争性、反竞争性和线性混合性几种类型。通过Lineweaver-Burk双倒数方程作图,根据酶催化反应的动力学参数表观米氏常数(Kmapp)和最大反应速度(Vm)的变化来判断抑制类型。Lineweaver-Burk双倒数图为相交于纵坐标的一组直线(图3),表明随着反应体系红旱莲总黄酮质量浓度的增大,体系最大反应速率保持不变,而Kmapp值显著增大,符合竞争性抑制类型的特征[12]。因此,红旱莲总黄酮对XOD抑制作用的动力学特征为竞争性抑制类型,求得其抑制常数Ki=0.61 μg/mL。
2.4 红旱莲总黄酮羟基自由基清除能力
苯甲酸钠是一种弱荧光物质,当它与羟基自由基结合时荧光强度会明显增加,因此能够通过检测苯甲酸钠体系荧光强度的变化,评估羟基自由基的清除情况[8]。如图4所示,红旱莲总黄酮质量浓度与羟基自由基清除率呈正相关,当红旱莲总黄酮质量浓度从0.1 mg/mL上升为0.5 mg/mL时,羟基自由基的抑制率也由 (38.48±1.41)%增加至 (94.05±1.80)%。在相同质量浓度下红旱莲总黄酮的清除率高于阳性对照VC (P<0.01)。 其半抑制率 (IC50=0.135 μg/mL)低于 VC(IC50=0.192 μg/mL),表明红旱莲总黄酮对羟基自由基有很强的清除能力。
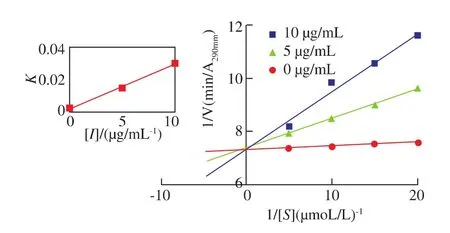
图3 红旱莲总黄酮抑制黄嘌呤氧化酶的Lineweaver-Burk曲线Fig.3 Lineweaver-Burk plots for inhibition of HAF on xanthine oxidase

图4 红旱莲总黄酮羟基自由基清除能力Fig.4 Hydroxyl radical scavenging effect of HAF
2.5 红旱莲黄酮总还原能力
在反应体系中,红旱莲黄酮能够还原Fe3+/铁氰酸盐化合物成亚铁状态。而Fe2+在溶液体系中呈普鲁士蓝色,能够在700 nm波长处进行检测,吸光值越大说明还原能力越强[13]。图5显示了不同质量浓度的红旱莲总黄酮的总还原能力。在0.2~1.0 mg/mL质量浓度范围内,红旱莲黄酮的总还原能力随着浓度的增大而逐渐增加,呈现良好的量效关系。当红旱莲质量浓度为0.8 mg/mL时,其总还原能力与0.4 mg/mL VC的总还原能力相当。
2.6 红旱莲黄酮总抗氧化能力
红旱莲总黄酮的总抗氧化能力如图6所示。在测定质量浓度范围内,随着红旱莲总黄酮质量浓度的增加,其抗氧化能力显著提高,当质量浓度达到2 mg/mL时总抗氧化能力达到113,虽不及同质量浓度下VC的总抗氧化能力,但仍显示出一定的抗氧化能力。

图5 红旱莲总黄酮总还原能力Fig.5 Total reductive ability of HAF
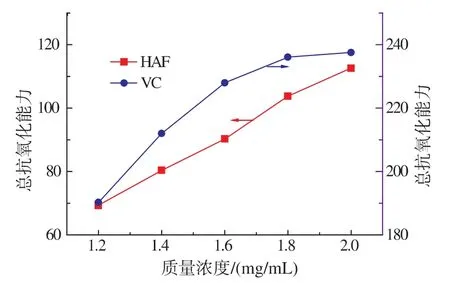
图6 红旱莲总黄酮总抗氧化能力Fig.6 Total antioxidant ability of HAF
3 结语
研究表明,在2~40 μg/mL质量浓度范围内,红旱莲总黄酮对黄嘌呤氧化酶(XOD)的抑制呈现剂量依赖关系,其IC50值为11.73 μg/mL,当红旱莲总黄酮质量浓度为40 μg/mL时,XOD的相对活性只有18.6±2.7%,其抑制类型是一种可逆的竞争性抑制剂,抑制常数为0.61 μg/mL。虽然临床上使用的XOD抑制剂别嘌呤醇对XOD活性有很强的抑制作用(本研究中作为阳性对照,测得其IC50值为0.579 μg/mL),但别嘌呤醇会诱发胃肠道反应、中毒性肝炎及血液中白细胞和血小板减少等副作用[2],导致其使用在一定程度上受到限制。此外,红旱莲总黄酮还显示出很强的羟基自由基清除能力(优于VC)及较好的总还原能力和总抗氧化能力。红旱莲是一种草本植物,毒副作用小,其主要有效成分类黄酮可作为潜在的预防高尿酸血症的药物和抗氧化剂进行深入研究。
[1]徐婷婷,承志凯,尹莲,等.土茯苓抑制黄嘌呤氧化酶活性的物质基础研究[J].中药材,2012,35(4):582-585.XU Ting-ting,CHENG Zhi-kai,YI Lian,et al.Material basic research of glabrous greenbrier rhizome inhibition xanthine oxidase[J].Journal of Chinese Medicinal Materials,2012,35(4):582-585.(in Chinese)
[2]郑小微,夏道宗,张英.梅花总黄酮对黄嘌呤氧化酶的抑制作用及其抗氧化性评价[J].食品工业科技,2011,23(11):168-173.ZHENG Xiao-wei,XIA Dao-zong,ZHANG Ying.Inbibition effect on xanthine oxidase and antioxidant activity of total flavonoids from Prunus mume flowr[J].Science and Technology of Food Industry,2011,23(11):168-173.(in Chinese)
[3]刘利军,李彦冰,张强,等.长柱金丝桃的研究进展[J].绥化学院学报,2006,26(3):155-156.LIU Li-jun,LI Yan-bing,ZHANG Qiang,et al.The advances in Hypericum ascyron L.[J].Journal of Suihua University,2006,26(3):155-156.(in Chinese)
[4]刘晓珍,聂少平,李文娟,等.黑灵芝中性提取物三萜含量测定及抗氧化作用研究[J].南昌大学学报:工科版,2011,33(4):332-337.LIU Xiao-zhen,NEI Shao-ping,LI Wen-juan,et al.Triterpenoids content and antioxidant activity of neutral components from ganoderma atrum[J].Joumal of Nanchang University:Engineering&Technology,2011,33(4):332-337.(in Chinese)
[5]Hashida W,Tanaka N,Takaishi Y.Prenylated xanthones from Hypericum ascyron[J].Journal of Natural Medicines,2007,61(4):371-374.
[6]KANG W Y,SONG Y L,LI Z.a-Glucosidase inhibitory and antioxidant properties and antidiabetic activity of Hypericum ascyron L[J].Medicinal Chemistry Research,2011,20(7)809-816.
[7]Arimboor R,Rangan M,Aravind S G,et al.Tetrahydroamentoflavone (THA) fromSemecarpus anacardiumas a potent inhibitor of xanthine oxidase[J].Journal of Ethnopharmacology,2011,133(3)1117-1120.
[8]ZHANG G W,HE L,HU M M.Optimized ultrasonic-assisted extraction of flavonoids from Prunella vulgaris L.And evaluation of antioxidant activities in vitro[J].Innovative Food Science and Emerging Technologies,2011,12 (1):18-25.
[9]黄俊丽,张慜.松茸、黑牛肝菌、双孢白蘑菇提取物体外抗氧化性试验研究[J].食品与生物技术学报,2011,30(1):342-347.HUANG Jun-li,ZHANG Min.Study on the antioxidant activities of tricholoma matsutake sing. ,boletusaereus and agaricus bisporus[J].Journal of FoodScienceandBiotechnology,2011,30(1):342-347.(in Chinese)
[10]李珂,卜尔红,杨秀华,等.骨蛋白酶解物的抗氧化作用[J].食品与生物技术学报,2009,28(6):773-776.LI Ke,BO Er-hong,YANG Xiou-hua,et al.Study on anti-oxidant enzymatic hydrolysis of bone protein[J].Journal of Food Science and Biotechnology,2009,28(6):773-776.(in Chinese)
[11]CHEN Q X,KUBO I.Kinetics of mushroom tyrosinase inhibition by quercetin[J].Journal of Agricultural and Food Chemistry,2002,50(14):4108-4112.
[12]LIN C M,CHEN C S,CHEN C T,et al.Molecular modeling of flavonoids that inhibits xanthine oxidase[J].Biochemical and Biophysical Research Communications,2002,294(1):167-172.
[13]Jayaprakasha G K,Singh R P,Sakariah K K.Antioxidant activity of grape seed(Vitis vinifera) extracts on peroxidation models in vitro[J].Food Chemistry,2001,73(3):285-290.
