蕨菜总蛋白质双向电泳技术体系的建立
2013-02-19黄劲松郁志芳
黄劲松, 姜 丽, 石 韵, 宦 晨, 郁志芳*
(1.南京农业大学 食品科技学院,江苏 南京210095;2.池州学院材料与化学工程系,安徽 池州247000)
蛋白质是生命体活动的体现者和执行者,蛋白质组学技术已成为探索果实蔬菜采后成熟衰老机理的重要手段,已被应用于草莓[1]、桃[2-3]、葡萄[4]、番茄[5]、柑橘[6]等果实成熟衰老的研究。目前,蛋白质组学在果实成熟衰老研究中的应用主要集中4个方面[7]:①成熟过程不同品种、不同成熟度果实的蛋白表达比较;②果实的抗病性研究;③采后处理对果实成熟调控机理的研究;④果实的冷害机理研究,这些研究结果为阐述果实成熟衰老过程中各个生理生化过程的分子机理提供了新的思路和理论依据。由于植物中蛋白质含量相对较低,且含有如色素、多糖、酚类物质、单宁和有机酸类等大量干扰性物质,给植物蛋白质组学研究增加了困难。近年来,随着蛋白质提取技术的改进,双向电泳技术已广泛地应用在桃[3],番茄[5],草莓[1]等果蔬上,但在蕨菜中的应用未见报道。
蕨菜又名蕨苔、龙头菜、拳头菜,属凤尾蕨科中可食用的多年生草本植物。蕨菜营养丰富、味道鲜美,其营养价值和药用价值高,蕨菜中不仅含有丰富的膳食纤维、维生素和矿物质等,而且现代医学研究认为蕨菜具有提高免疫力、治疗心脑血管疾病等药用保健功能[8]。由于新鲜蕨菜在贮藏及运销过程易出现营养流失,组织变硬和纤维化、变色、风味下降等品质劣变现象,从而缩短了产品的贮藏和货架寿命,常温下仅能维持3~5 d。研究蕨菜采后品质劣变的蛋白质组学,可从蛋白质分子水平上揭示蕨菜品质劣变机理具有重要意义,为生产实践中开发蕨菜的保鲜技术提供理论指导。
作者以皖南山野蕨菜为研究对象,通过比较不同蛋白质提取方法,不同上样量及不同pH范围IPG胶条对2-DE图谱的影响,以期探索出一种适合蕨菜的蛋白质组分析的方法,为进一步开展蕨菜差异蛋白质组学的研究作铺垫。
1 材料与方法
1.1 试验材料
1.1.1 材料 实验用蕨菜为3月下旬可食用的池州三台山产的蕨菜,选择新鲜、绿色、叶片未展开、呈拳状弯曲,无病虫害、无机械损伤蕨菜,采收后迅速用液氮冷冻,保存于-70℃冰箱备用。
1.1.2 试剂 乙二醇-双-(2-氨基乙醚)四乙酸(EGTA)、苯甲基磺酰氟(PMSF)、固化 pH 梯度干胶条 (IPG,)、两性电解质 (Bio-Lyte)、二硫苏糖醇(DTT)、碘代乙酰胺(IAA)、丙烯酰胺(Arc)、N,N’-甲叉双丙烯酰胺(Bis)、二甲氨基丙磺酸(CHAPS)、低熔点琼脂糖(LMP)、考马斯亮蓝G-250等:购自美国 Bio-Rad公司;三氯乙酸(TCA)、丙酮、尿素(Urea)、硫脲(Thiourea)、甘氨酸(Glycine)、β-巯基乙醇(β-Me)、十二烷基磺酸钠(SDS)、聚乙二醇辛基苯基醚 (Triton X-100)、三羟甲基氨基甲烷(Tris)、 矿物油、 过硫酸铵 (Aps)、 四甲基乙二胺(TEMED)、Tris-平衡酚、牛血清蛋白(BSA)等:均为国产分析纯。
1.1.3 仪器 高速冷冻离心机:GL-20G-Ⅱ 上海安亭科学仪器厂产品;微量高速冷冻离心机:FRESCO 17 Thermo电子公司产品;等电聚焦仪:Protean IEF System,美国Bio-Rad公司产品;垂直电泳仪:PROTEAN II XL Cell美国Bio-Rad公司产品;凝胶成像系统:Versdoc 3000,美国Bio-Rad公司产品。
1.2 蛋白质提取与质量分数测定
1.2.1 酚抽法 根据Bianco等[9]的方法并加以改进:称取5 g蕨菜茎部分,用液氮在研钵中研磨成粉。然后加入20 mL的匀浆缓冲液(匀浆液pH 8.0,其 中 含 有 65 mmol/L Tris,1.05 mol/L sucrose,10 mmol/L EGTA,1 mmol/L PMSF,1 mmol/L DTT 以及质量分数1%Triton X-100继续研磨。匀浆液以10 000 g离心30 min,在上清液中加入3倍体积的pH为7.8的Tris-平衡酚,充分涡旋摇荡,混匀,10 000 g,4℃下离心30 min,上层为酚相,中间白色物质为杂质,下层为水相。回收酚相,加入5倍体积预冷丙酮,充分混匀,-20℃下过夜培养,沉淀蛋白。沉淀分别用预冷的甲醇和丙酮冲洗2次,4℃下干燥后置于-20℃保存备用。
1.2.2 TCA/丙酮结合酚抽法 根据Wang等[10]方法并加以改进:称取5 g蕨菜,用液氮在研钵中研磨成粉。然后分别加入20 mL-20℃预冷的体积分数10%TCA/丙酮、0.1 mol/L乙酸铵-甲醇、体积分数80%丙酮清洗并沉淀,并于10 000 g离心30 min,去掉上清,收集沉淀,最后置于4℃下干燥。向干燥好沉淀中按先后顺序加入2倍体积pH为7.8 Tris-平衡酚及 SDS混合液(体积比为1∶1),充分振荡,混匀,10 000 g,4 ℃下离心 30 min,上层为酚相,中间白色物质为杂质,下层为水相。回收酚相,加入3倍体积预冷丙酮,充分混匀,-20℃下过夜培养,沉淀蛋白。沉淀分别用预冷的甲醇和体积分数80%丙酮冲洗1次,4℃下干燥后置于-20℃保存备用。
蛋白质沉淀中加入 500 μL裂解液 (7 mol/L urea,2 mol/L thiourea,4%CHAPS,1%DTT,0.5%IPG buffer),至沉淀完全溶解后,并于 10 000 g,4 ℃下离心30 min,用Bradford方法[11]定量蛋白质。
1.3 双向电泳相关程序设定
第一向采用 17 cm pH 4-7、pH 5-8、pH 3-10的bio-rad预制胶条进行水化上样(上样量分别为1 000,1 200,1 400 μg)上样体积 360 μL,应用表 1 所示的程序进行等电聚焦。等电聚焦结束后将第一向胶条分别置于含质量分数2%DTT和2.5%碘乙酰胺的 平 衡 液 (6 mol/L urea,75 mmol/L Tris-HCl,pH 8.8,体积分数 20%glycerol,体积分数 4%SDS)中各平衡15 min,然后再转移第二向垂直电泳。第二向SDS-PAGE胶质量浓度为12 g/dL,采用恒功率进行垂直电泳,起始用1W/gel进行1 h后,改为15W/gel直到溴酚蓝到达胶底部,停止电泳,取下凝胶。然后将放在固定液 (体积分数40%甲醇,10%冰醋酸,超纯水定容)中固定2h,用考马斯亮蓝染色液(质量分数0.12%考马斯亮蓝G-250,质量分数10%磷酸,质量分数10%硫酸铵,体积分数20%甲醇,超纯水定容)进行染色12 h、再在脱色液(体积分数10%甲醇,体积分数10%冰醋酸,超纯水定容)中进行脱色直凝胶背景清晰,蛋白质点明显可见为止。脱色后的凝胶用分辨率为300dpi的Versdoc 3000凝胶成像系统采集图像,保存为GSC的图像文件,应用PDQuest 8.0.1图像分析软件进行。
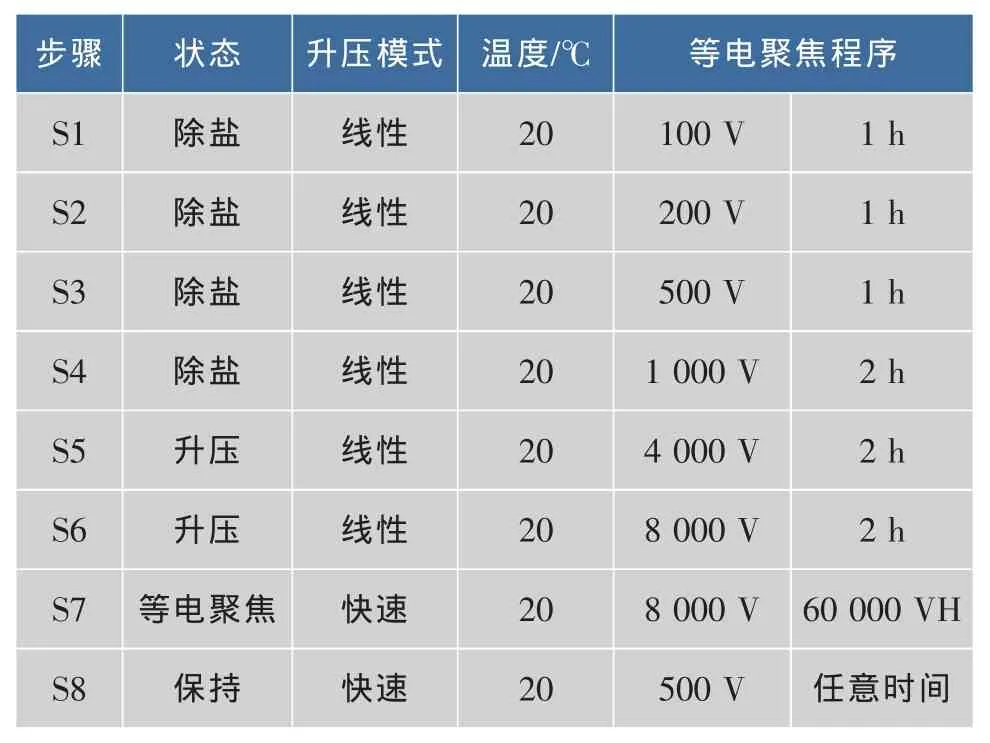
表1 17 cm胶条的双向电泳等电聚焦程序Table 1 The isoelectric focusing programme of 2-DE with 17 cm strips
2 结果与讨论
2.1 不同蛋白质提取方法对蕨菜总蛋白质2-DE图谱的影响
比较了酚抽法和TCA/丙酮结合酚抽法两种蛋白质提取方法对2-DE图谱的影响,图1表明,在相同条件下,用TCA/丙酮结合酚抽法得到大约有235个蛋白质点,而且横纹较少,点的分布相对均匀,点比较清晰;而直接的酚抽法得到大约162个蛋白质点,明显少于TCA/丙酮结合酚抽法,且所得到的图谱水平横纹较多。以上结果表明,TCA/丙酮结合酚抽法提取的蛋白质纯度较高,质量较好,无背景干扰,因此,后期实验采用TCA/丙酮结合酚抽法作为蛋白质的提取方法,这与占志勇[12]等提取油桐种仁蛋白质所采取的提取方法一致。TCA/丙酮结合酚抽法适合于抗逆境的植物性材料[10]的蛋白质提取上,如应用于松树、竹、柠檬、红树、橄榄树等植物叶片分析上,同时此方法也被应用于果肉的研究上,如苹果、橄榄、桃子[10]。而酚抽法较多应用于果肉蛋白方面的研究,如樱桃、番茄、冬枣等[13]。不同的实验材料,由于其组成不同,采用的提取方法有很大差异。

图1 不同蛋白质提取方法 (酚抽法及TCA/丙酮结合酚抽法)对蕨菜总蛋白质2-DE的影响Fig.1 Comparison of 2-DE maps of Pteridium aquilinum with different protein extraction methods
2.2 不同pH范围胶条对蕨菜总蛋白质2-DE图谱的影响
IPG胶条pH范围对2-DE图谱有重要影响,宽pH范围的IPG胶条能初步分析蛋白质的分布状况,但是等电点相近的蛋白质难以有效分离,窄pH范围IPG胶条会丢失其pH值范围之外的蛋白质,但有利于提高蛋白质的分辨率[14]。为探索蕨菜总蛋白2-DE适宜的pH范围,分别采用pH 3~10、pH 4~7和pH 5~8 17 cm的IPG胶条进行双向电泳,结果表明:在相同条件下,pH 4-7和pH 5-8图谱蛋白质点数目分别为442和710,而pH 3-10图谱的蛋白质点数目为235,蛋白点集中在胶条的中间部分,使得等电点相近的蛋白质无法得到很好的分离,蛋白质会出现重叠现象,其数量明显低于pH 4~7 和 pH 5~8 的图谱(图 2),这与王绍美等[15]研究烟草叶片蛋白质组选用pH 3~10所得现象一致。pH 4~7胶条的图谱点在大约pH 4~5之间未见有蛋白点,胶条没有得到充分利用,而使用胶条pH 5~8图谱点分散比较开,分布比较均匀,从蛋白质点的数量上看明显多于胶条pH 3~10、pH 4~7,但在pH 8端出现了一条垂直条纹,这个垂直条纹包括了所有等电点大于8的蛋白质,这是胶条pH范围的限制,使得pH>8的蛋白被压缩,尽管采用这种胶条会丢失pH范围之外的蛋白,但灵敏度和分辨率大大提高,为后续的分析鉴定奠定良好的基础。由于选用的试验材料蛋白质本身性质不同,分析所使用的IPG胶条的pH范围也不尽相同,王一鸣[16]分析桃果实硬核期的蛋白质选用了pH 5~8的胶条,Bianco等[9]在草莓成熟过中的差异蛋白质选用pH 4~7的胶条,而乔建军等[17]过氧化氢作用下东北红豆杉悬浮培养细胞中蛋白质表达差异研究选用IPG胶条pH 3~10。作者确定分析蕨菜中蛋白质的IPG胶条pH 5~8。

图2 不同pH值范围的IPG胶条对蕨菜全蛋白质2-DE图谱的影响Fig.2 Comparison of 2-DE maps of Pteridium aquilinum with three IPG strips with different gradients
2.3 不同上样量对蕨菜总蛋白质2-DE图谱的影响
蛋白质的上样量同样影响2-DE图谱的好坏,适宜的蛋白质上样量才能跑出清晰蛋白质点且蛋白质数量多的点,故确定蛋白质上样量也是双向电泳的一个关键步骤[18]。如图3所示,当蛋白质上样量达到1 400 μg时,由于蛋白质浓度过高,影响了蛋白质的聚焦,一些大相对分子质量蛋白质堆积在一起,分离效果不好,出现较多水平条纹,这可能蛋白质上样量过高、高丰度蛋白质存在、聚焦不足或过度等有关。而蛋白质上样量为1 000 μg时,由于蛋白质浓度较低,尽管胶上的蛋白质点分布均匀,低相对分子质量的蛋白质也部分呈现出来,但图谱的点清晰度没有上样量1 200 μg明显,而上样量1 200 μg图谱蛋白质点高达719个,且蛋白质点边界清晰,无拖尾现象。而1 000、1 400 μg图谱分别是592个和608个,蛋白质点数量较少且图谱质量不及上样量1 200 μg的清晰。有人认为上样量的多少与蛋白质聚焦伏小时数有一定的关系,当上样量低时,低丰度蛋白质点不清晰,可以通过提高上样量来提高蛋白质点清晰度,但上样量过大时,高丰度的蛋白易发生重叠,2-DE图谱可能会出现大量的条纹,可以通过延长聚焦程度来解决[13]。对于一定的上样量,在聚焦时需有一适宜的聚焦伏小时数,延长或缩短此数值都有可能影响蛋白质的聚焦,从而影响图谱的质量,影响下一步分析。作者比较了不同上样量2-DE图谱,发现蕨菜总蛋白质上样量1 200 μg时,等电聚焦60 000 Vh,得到电泳图谱中蛋白质点数量明显高于其他2种上样量,且背景清晰,适合下一步分析。
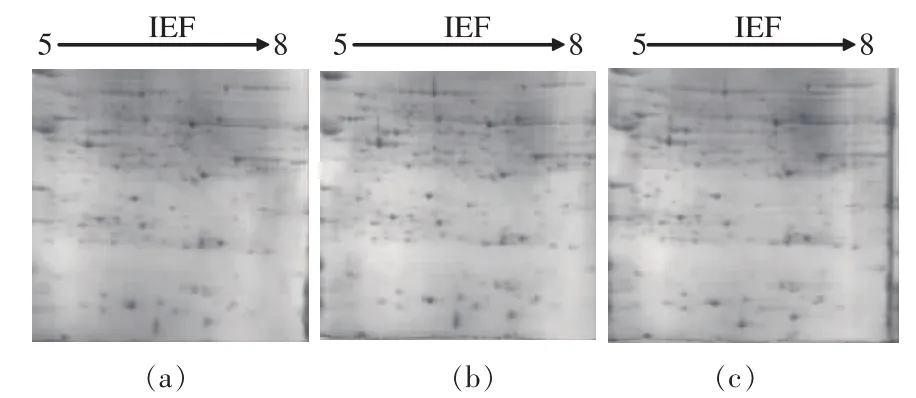
图3 不同上样量(1 000,1 200,1 400 μg)对蕨菜中总蛋白质2-DE图谱的影响Fig.3 Comparison of 2-DE maps of Pteridium aquilinum with different loading amount
3 结语
采用TCA-丙酮结合酚抽法提取蕨菜中的蛋白质,所得到的蛋白质纯度较高。采用17 cm pH 5~8胶条,蛋白质的上样量为1 200 μg,凝胶质量浓度为12 g/dL,经考马斯亮蓝G250胶体染色后所得到的图谱蛋白质点多达719个,点分布均匀,蛋白质点间边界清晰,无明显的拖尾现象,重复性好的蛋白质2-DE图谱。
[1]Bianco L,Lopez L,Scalone A G,et al.Strawberry proteome characterization and its regulation during fruit ripening and in different genotypes[J].Journal of Proteomics,2009,72:586-607.
[2]Zhang L,Yu Z,Jiang L,et al.Effect of post-harvest heat treatment on proteome change of peach fruit during ripening[J].Journal of Proteomics,2011,74:1135-1149.
[3]Obenland D M,Vensel W H.Alterations in protein expression associated with the development of mealiness in peaches[J].Journal of Horticultural Science and Biotechnology,2008,83(1):85-93.
[4]Vincent D.Optimization of protein extraction of mature grape berry clusters[J].Electrophoresis,2006,27:1853-1865.
[5]Amber A,Muhammad R K,Nagib A,et al.Comparative proteomic analysis of bacterial wilt susceptible and resistant tomato cultivars[J].Peptides,2009,(30):1600-1607.
[6]Yun Ze,Li Wenyun,Pan Zhiyong,et al.Comparative proteomics analysis of differentially accumulated proteins in juice sacs of ponkan(Citrus reticulata) fruit during postharvest cold storage[J].Postharvest Biology and Technology,2010,56:189-201.
[7]张丽,罗海波,姜丽,等.果实成熟衰老过程中蛋白质组学研究进展[J].植物生理学报,2011,47(9):861-871.ZHANG Li,LUO Hai-bo,Jiang Li,et al.Advances in proteomics related to fruit ripening and senescence[J].Plant Physiology Journal,2011,47(9):861-871.(in Chinese)
[8]左瑞华,王莉.蕨菜黄酮饲喂肉鸡的试验研究[J].皖西学院学报,2012,28(2):10-12.ZUO Rui-hua,WANG Li.Experimental study on the effect of flavonoids extracted from pteridium aquilinum var.Latiusculum on chickens[J].Journal of west Anhui University,2012,28(2):10-12.(in Chinese)
[9]Bianco L,Lopez L,Scalone AG,et al.Strawberry proteome characterization and its regulation during fruit ripening and in different genotypes[J].Journal of Proteomics,2009,72(4):586-607.
[10]Wang Wei,Rita V,Monica S,et al.A universal and rapid protocol for protein extraction from recalcitrant plant tissues for proteomic analysis[J].Electrophoresis,2006,27:2782-2786.
[11]Bradford M M.A rapid and sensitive method for the quantification of microgram quantities of proteins utilizing the principle of protein binding[J].Analytical Biochemistry,1976,72:248-254.
[12]占志勇,陈益存,韩小娇,等.一种适合油桐种仁蛋白质分离的双向电泳技术体系[J].林业科学研究,2012,25(6):745-750.ZHAN Zhi-yong,CHEN Yi-cun,HAN Xiao-jiao,et al.An improved system of two-dimensional electrophoresis for the tung tree seed protein separation[J].Forest Research,2012,25(6):745-750.(in Chinese)
[13]张丽.1-MCP和热处理调控采后桃果实蛋白表达的研究[D].南京:南京农业大学,2012.ZHANG Li.Proteomic study on the effect of heat and 1-MCP treatments on post-harvest peach fruit[D].Nanjing:Nanjing Agricultural university,2012.(in Chinese)
[14]陈伟,黄榕辉,林小敏,等.秋茄根系蛋白质组的双向电泳技术优化[J].福建农业学报,2012,27(8):863-868.CHEN Wei,HUANG Rong-hui,LIN Xiao-min,et al.Optimization of two-dimensional polyacrylamide gel electrophoresis for proteome of Kandelia candel Roots[J].Fujian Journal of Agricultural Sciences,2012,25(6):745-750.(in Chinese)
[15]王绍美,罗成刚,刘贯山,等.烟草叶片蛋白质组双向电泳实验体系的建立[J].中国烟草科学,2012,33(6):54-60.WANG Shao-mei,LUO Chenggang,LIU Guanshan,et al.Establishment of two-dimensional electrophoresis protocol for tobacco leaf proteome[J].Chinese Tobacco Science,2012,33(6):54-60.(in Chinese)
[16]王一鸣,花宝光,王有年,等.桃果实蛋白质双向电泳影响因素的研究[J].园艺学报,2007,(6):244-249.WANG Yi-ming,HUA Bao-guang,WANG You-nian,et al.Studies on influence factors of protein two-dimensional electrophoresis in prunus persica fruit[J].Acta Horticulturae Sinica,2007(6):244-249.(in Chinese)
[17]乔建军,赵红,牛晋阳,等.过氧化氢作用下东北红豆杉悬浮培养细胞中蛋白表达差异的研究[J].植物病理学报,2003,33(5):429-433.QIAO Jian-jun,ZHAO Hong,NIU Jin-yang,et al.Two-dimensional gel electrophoresis on patterns of proteins from suspension cultured cells of Taxus cuspidata following treatment with H2O2[J].ACTA Phytopathologica Sinica,2003,33(5):429-433.(in Chinese)
[18]黄榕辉,陈品品,王晓艳,等.荔枝花蕊蛋白双向电泳体系的建立与优化[J].热带作物学报,2012,33(10):1812-1818.HUANG Rong-hui,CHEN Pin-pin,WANG Xiaoyan,et al.Establishment and optimization of two-dimensional electrophoresis system for proteins of Litchi Flower buds[J].Chinese Journal of Tropical Crops,2012,33(10):1812-1818.(in Chinese)
