葫芦岛贝类养殖区浮游生物的群落结构和时空分布
2013-02-15陈雷许传才刘海映邢彬彬田涛孙康
陈雷,许传才,刘海映,邢彬彬,田涛,孙康
(大连海洋大学 辽宁省海洋牧场工程技术研究中心 农业部北方海水增养殖重点实验室,辽宁 大连116023)
葫芦岛贝类养殖区位于葫芦岛市南部近海,处于辽东湾内。该海区水深不超过10 m,地质平坦,多为软泥底,以养殖菲律宾蛤仔为主。海洋浮游植物是海洋初级生产力的主要贡献者,其种类多、数量大,是海洋动物的直接或间接饵料,是海洋食物链的基本环节。海洋浮游动物是海洋浮游植物的摄食者,也是多种海洋动物的饵料,其在海洋食物链中占据着重要地位。浮游生物的盛衰对海洋的次级生产力影响巨大,特别是在高密度的贝类养殖区。为此,本研究中作者对葫芦岛贝类养殖区的水质和浮游生物进行了不同季节的调查,旨在为该海区的贝类养殖生产提供基础资料。
1 调查时间与方法
1.1 采样点的设置及调查时间
葫芦岛贝类养殖区位于40°40'18″ ~40°41'28″N、120°52'49″~120°55'20″E,养殖区内设定10 个调查站位,如图1所示。
分别于2007年11月19日、2008年3月21日和2008年7月20日租用14.7 kW 的渔船在该海域进行水环境和浮游生物调查。
1.2 水质的测定
航行到达设定站位后,用水生80 型采水器采集水样。设定的10 个站位水深均低于10 m,按照《海洋监测规范》[1]的要求只采表层水样。
水温、盐度、pH、溶解氧、水深由6600 型多功能水质分析仪现场测定,亚硝酸盐、硝酸盐、氨氮、活性磷酸盐、活性硅酸盐、叶绿素a 取样后,在实验室按照《海洋监测规范》[1]中的方法进行测定。
1.3 浮游生物的测定
在设定站位,利用浅水Ⅱ型、浅水Ⅲ型浮游生物网和水生80 型采水器进行采样。具体方法:将浮游生物网垂直放入距海底2 m 左右处,再垂直提起,所得样品放入采样瓶内;用水生80 型采水器采集浮游植物定量样品。1 L 浮游植物样品用15 mL 鲁哥氏液现场固定;浮游动物样品用样品体积5%的福尔马林现场固定。
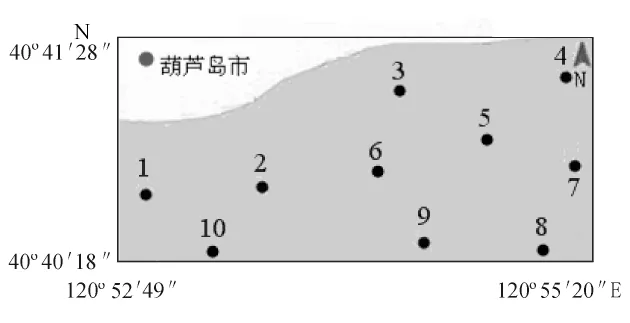
图1 葫芦岛贝类养殖区调查站位示意图Fig.1 The survey sampling position in shellfish beds in coastal Huludao
1.3.1 浮游植物的定性、定量 样品静置10 h 以上,吸去上清液,浓缩至适当体积,用吸管搅拌均匀,迅速吸取一定样品放在浮游植物计数框内,盖上盖玻片,用显微镜(Nikon 50i 型)在10×40 倍下观察,记录出现的浮游植物种类。每个样品重复5次。
样品静置10 h 以上,吸去上清液,浓缩至50 mL,再充分摇匀,准确吸取0.1 mL 置于浮游植物计数框内,用显微镜在10×40 倍下全片计数,每个样品重复5次,取其平均值,依据下列公式计算浮游植物总密度:

式中:x 为单位体积海水中浮游植物个体数量(个/m3);n 为取样观察到的个体数(个);V1为水样浓缩后的体积(mL);Vm为滤水量(m3),Vm=网口面积×采样水深;V2为取样计数的体积(mL)。
1.3.2 浮游动物的定性、定量 浮游动物的定性和定量同时进行。具体方法:样品静置10 h 以上,吸去上清液,浓缩至适当体积,将样本充分摇匀,立即用管径较粗的吸管吸取1 mL 样品置于浮游动物计数框,用显微镜在10×10 倍下全片观察,将观察到的每一个体进行定性,同时计数,每个样品重复5次,取其平均值,依据公式(同浮游植物总密度的计算公式)计算浮游动物总密度。
称量浅水Ⅱ型浮游生物网采集的浮游动物湿重,作为生物量。
1.3.3 多样性指数 采用香农—威纳指数(Shannon-Wiener diversity index)[2],其计算公式为
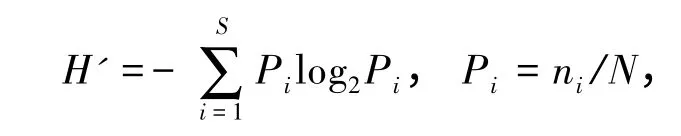
式中:S 为样品中的种类总数;Pi为样品中第i种个体所占比例;N 为采集样品中所有物种的总个体数;ni为第i种个体数。
2 结果与分析
2.1 水体理化指标
从表1可见:2007年11月、2008年3月、2008年7月该海域的水温分别为10.99、6.31、24.26 ℃;盐度为29.5 ~31.8;pH 为8.02 ~8.15;溶解氧为9.71 ~11.63 mg/L;2008年3月、2007年11月的溶解氧均高于2008年7月,但无显著性差异(P ﹥0.05);叶绿素a 含量为2008年7月(8.99 μg/L)显著高于2007年11月(3.26 μg/L)和2008年3月(1.41 μg/L) (P ﹤0.05)。

表1 葫芦岛贝类养殖区水质分析结果Tab.1 The water quality in shellfish beds in coastal Huludao
2.2 浮游植物的种类组成及分布
3次调查中,10 个站位共计有硅藻门41种(属)、甲藻门5种(属)。从出现频率看,硅藻门中的辐射圆筛藻Coscinodiscuc radiates、星脐圆筛藻Coscinodiscuc asterromphalus、格式圆筛藻Coscinodiscuc granii、小圆筛藻Coscinodiscuc sp.、具槽直链藻Melosira sulcala、布氏双尾藻Ditylum brightwellii、刚毛根管藻Rhizosolenia setigera、脆根管藻Rhizosolenia fragilissima、中华盒形藻Biddulphia sinensis 以及甲藻门中的夜光藻Noctiluca scientillans在3次调查中每个站位均有出现;硅藻门中的威氏圆筛藻Coscinodiscuc wailesii、变异直链藻Melosira varians、斯托根管藻Rhizosolenia stolterfothii、旋链角毛藻Chaetoceros curvisetus、圆柱角毛藻Chaetoceros teres、洛氏角毛藻Chaetoceros lorenzianas、密联角毛藻Chaetoceros densus、针杆藻Synedra sp.、甲藻门中的梭角藻Ceratium fusus、三角角藻Ceratium tripos在3次调查中平均出现频率为50%及以上;其他种类均低于50%(表2)。
2.3 浮游植物的密度
10 个站位的浮游植物密度均为2008年7月最高,2007年11月次之,2008年3月最低(图2)。从浮游植物密度组成来看,硅藻占81%以上,最高达98.92%,而且硅藻的优势在2007年11月表现的更为明显(图3)。
2.4 浮游动物的种类组成及分布
3次调查中,10 个站位共计有毛颚动物1种(属),被囊动物1种(属),桡足类11种(属),浮游幼虫类10种(属)。2008年3月出现15种(属),2007年11月、2008年7月均出现23种(属)。从出现频率看,桡足类中的中华哲水蚤Calanus sinicus、小拟哲水蚤Paracalanus parvus、纺锤水蚤Acartia sp.、大同长腹剑水蚤Oithona similes、胸刺水蚤Centropages sp.以及浮游幼虫类的无节幼体Nauplius larva在3次调查中每个站位均有出现;毛颚动物中的强壮箭虫Sagitta crassa、桡足类中的近缘大眼剑水蚤Corycaeus affinis、火腿许水蚤Schmackeria poplesia 以及浮游幼虫类的桡足幼体Copepodite larva、海豆芽舌贝幼虫Lingula larva、双壳类壳顶幼虫Lamellibranchia larva在3次调查中平均出现频率为50%及以上;其他种类均低于50%(表3)。
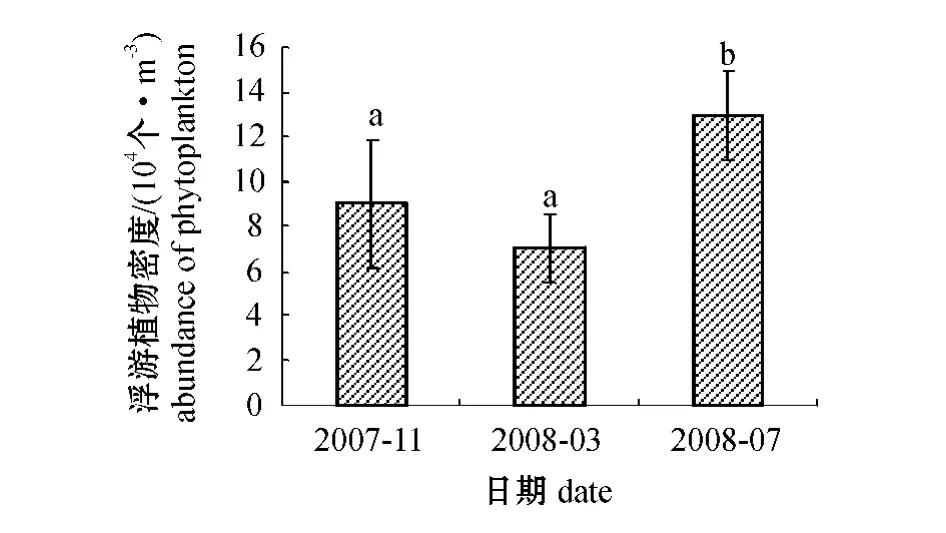
图2 浮游植物密度随时间的变化Fig.2 Changes in phytoplankton abundance with time

图3 浮游植物密度组成随时间的变化Fig.3 Changes in abundance composition in phytoplankton with time
2.5 浮游动物的密度和生物量
10 个站位的浮游动物密度和生物量均为2008年7月最高、2007年11月次之、2008年3月最低(图4)。从浮游动物密度组成来看,桡足类占70.45%,浮游幼虫占19.97%,毛颚动物占9.46%,被囊动物占0.12%;从浮游动物生物量组成来看,桡足类占69.16%,浮游幼虫占19.18%,毛颚动物占11.43%,被囊动物占0.23%(图5)。
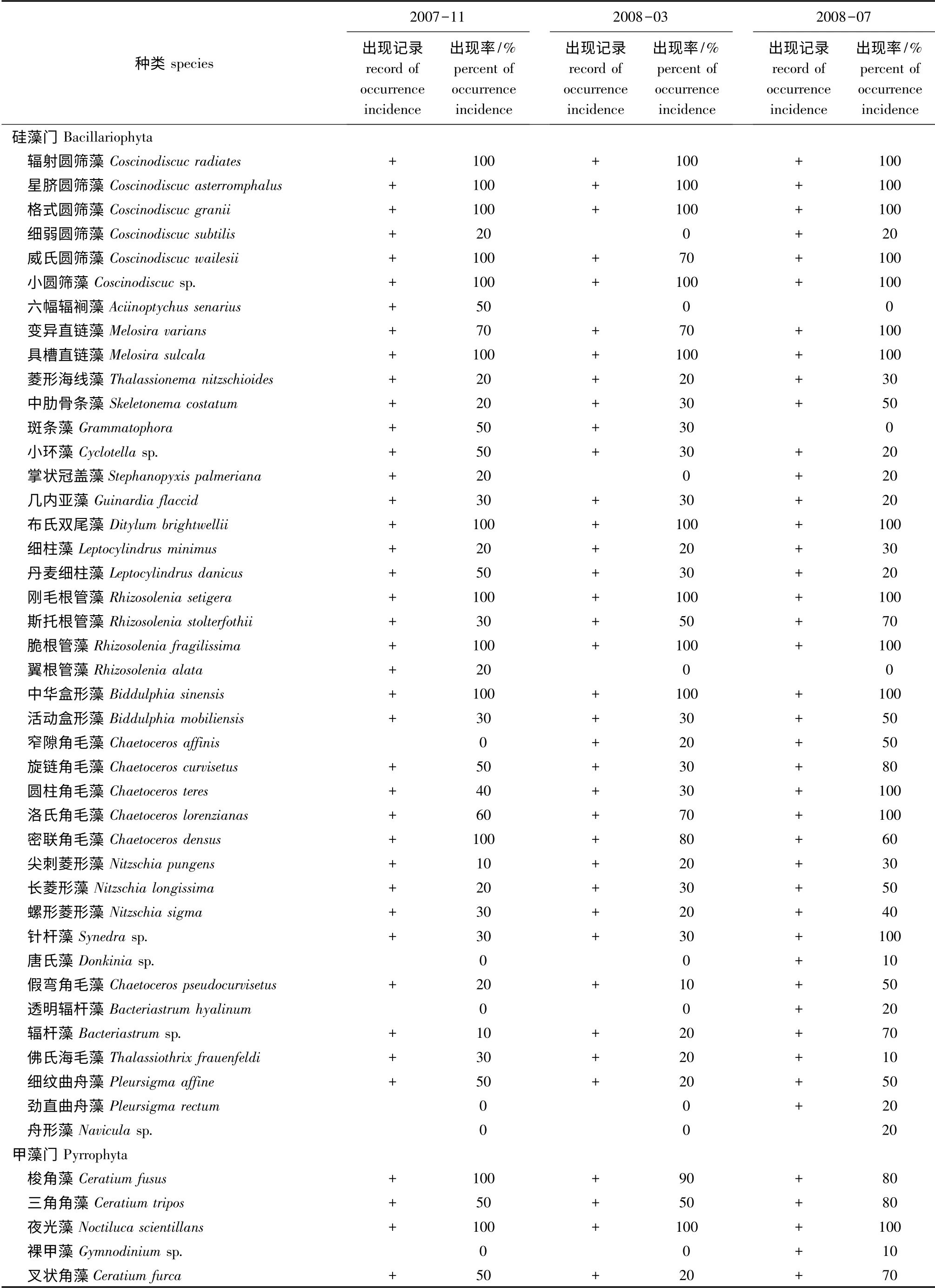
表2 葫芦岛贝类养殖区浮游植物的种类组成和分布Tab.2 The species composition and distribution of phytoplankton in shellfish beds in coastal Huludao
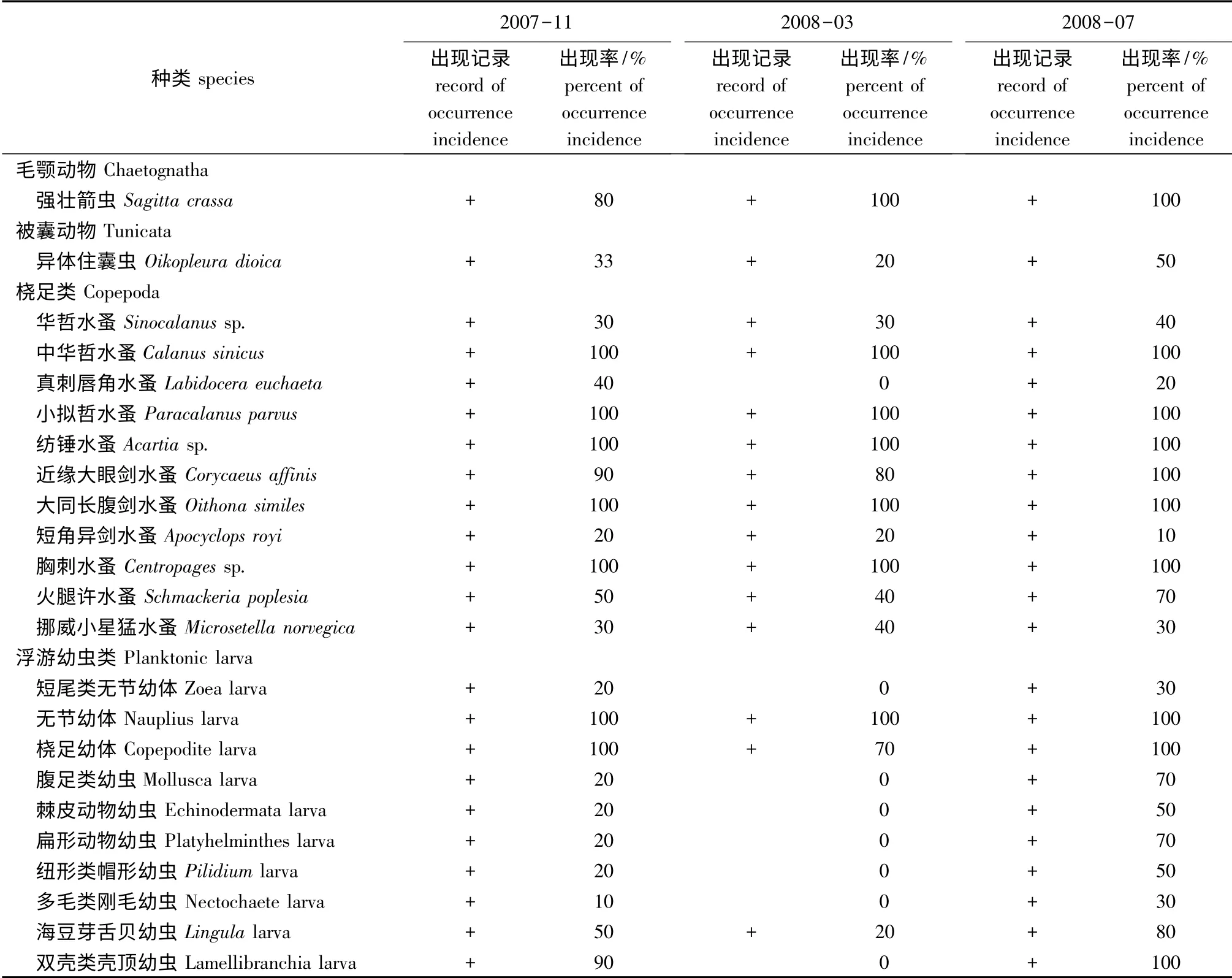
表3 葫芦岛贝类养殖区浮游动物的种类组成和分布Tab.3 The species composition and distribution of zooplankton in shellfish beds in coastal Huludao
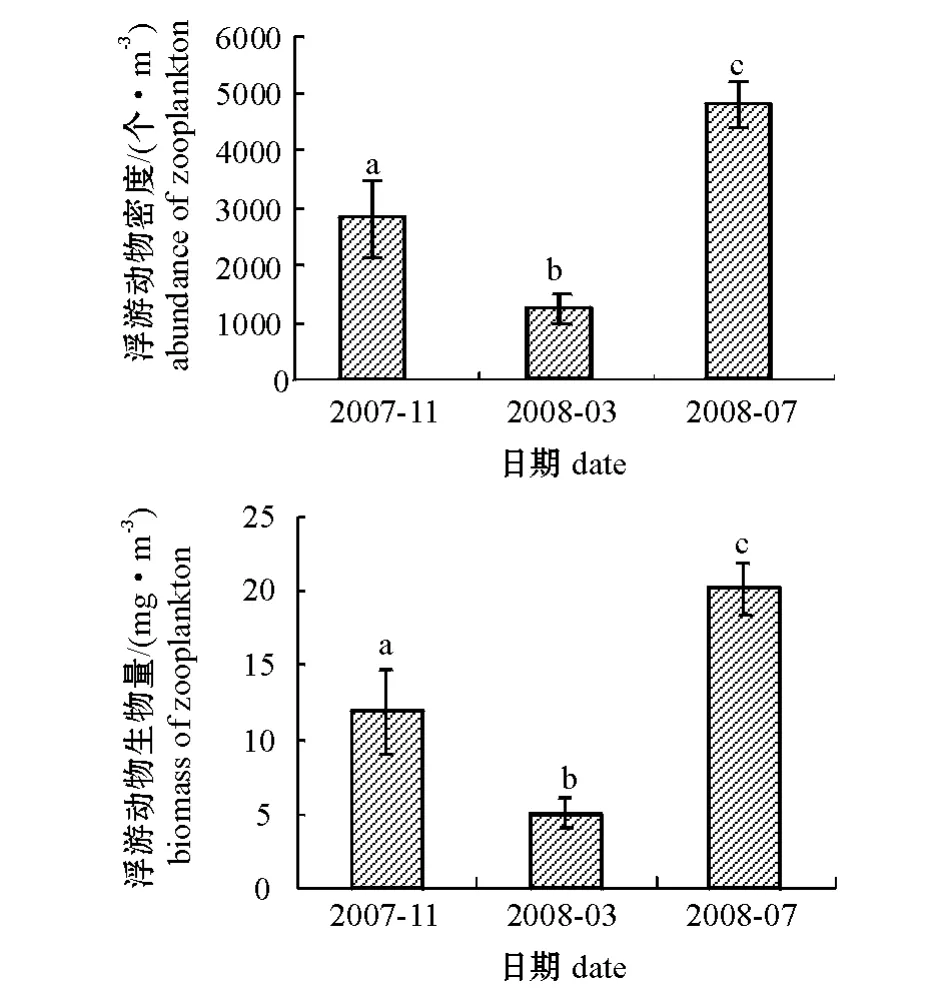
图4 浮游动物密度和生物量随时间的变化Fig.4 Chinges in abundance and biomass in zooplankton with time

图5 浮游动物密度和生物量组成随时间的变化Fig.5 Changes in abundance and biomass in zooplankton with time
2.6 浮游生物多样性指数
2007年11月、2008年3月、2008年7月,浮游植物Shannon-Wiener 多样性指数(H')分别为3.34、3.79、3.94,2008年7月最高,2007年11月最低;浮游动物H'分别为3.90、3.15、2.92,2007年11月最高,2008年7月最低。
3 讨论
3.1 葫芦岛贝类养殖区水质评价
该海域的海水盐度、pH在3次调查中比较稳定,盐度为29.5 ~31.8,pH 为8.02 ~8.15;溶解氧在夏季比春、秋两季低,但仍在8 mg/L 以上,能满足菲律宾蛤仔的生长需要;叶绿素a 含量的季节变化比较明显,夏季最高,秋季次之,冬季最低。从pH、溶解氧含量来看,该海域的海水达到《海水水质标准》(GB 3097-1997)Ⅰ类海水标准(下同)。
营养盐方面,氨氮、硝酸盐、亚硝酸盐、活性磷酸盐、硅酸盐含量都存在一定的时间差异,表现为2008年7月含量最高。从无机氮含量来看,2007年11月、2008年3月属于Ⅱ类海水,2008年7月属于Ⅳ类海水;从活性磷酸盐含量来看,2007年11月、2008年3月属于Ⅰ类海水,2008年7月属于Ⅱ类海水。分析其原因,可能是因该海域临近陆地,近岸有生活区,受陆源营养盐影响较大所致,而夏季降雨使这种影响更为明显。菲律宾蛤仔的生长适温为18 ~30 ℃,而2008年7月的水温为24.26 ℃,此时是蛤仔生长旺季。通常在适温范围内,随水温的升高,贝类的氨氮等代谢活动增强[3],贝类的代谢活动不仅能够产生大量的氨氮等溶解性无机氮,也能产生磷酸盐[4]。2007年11月、2008年3月、2008年7月海水中的N/P 值分别为221.4、86.0、51.5。兼顾营养盐化学计量限制标准和营养盐对浮游植物生长影响的阈值(DIN-limitation:DIN<1 μmol/L和P - limitation:μmol/L和30)[5],据此来评估,该海域属于P 限制。分析原因,浮游植物在夏季大量繁殖,消耗了海水中的营养盐,由于P是该海域限制性因子,这使P 的缺失更加显著,表现为在浮游植物大量繁殖季节过后N/P 值更高。
3.2 葫芦岛贝类养殖区浮游生物的季节变化
2007年11月调查10 个站位出现浮游植物共计40种(属),2008年3月共计37种(属),2008年7月种类最多,为43种(属)。分析原因,夏季水温较高,降雨相对频繁,并将陆源营养盐带入海水,为更多种类的浮游植物生长、繁殖提供了适宜的环境条件。从出现频率看,硅藻门中的辐射圆筛藻、星脐圆筛藻、格式圆筛藻、小圆筛藻、具槽直链藻、布氏双尾藻、刚毛根管藻、脆根管藻、中华盒形藻以及甲藻门中的夜光藻在3次调查中每个站位均有出现,可见这些种类是该海域常年普遍存在的。从10 个站位的调查结果来看,3次调查均是1 号、4 号站位出现浮游植物种类最多,2007年11月分别为28、27种(属);2008年3月分别为26、21种(属);2008年7月分别为28、32种(属)。但从营养盐含量来看,1、4 号站位和其他站位并没有明显差异,可能是由于1、4 号站位处在养殖区的边缘,而且靠近近岸,养殖贝类的密度小,贝类对浮游植物的摄食强度低,以及海水交换较差所致。10 个站位浮游植物密度均为2008年7月最高、2007年11月次之、2008年3月最低。浮游植物的种类和数量之所以产生明显的季节差异,即生物季节[6],是由于气候的季节性变化导致海洋水化条件发生周期性的变化而造成的。从种类组成来看,硅藻门占绝对优势,这与很多海域调查结果相近[7-9],根据贾晓平等[10]对饵料生物水平划分的等级来看,葫芦岛贝类养殖区浮游植物属低水平等级,分析原因可能是与海区中养殖了大量以摄食浮游植物为主的菲律宾蛤仔有关。
从出现频率来看,桡足类中的中华哲水蚤、小拟哲水蚤、纺锤水蚤、大同长腹剑水蚤、胸刺水蚤以及浮游幼虫类的无节幼体在3次调查中每个站位均有出现,可见其为该海域普遍存在种类,而其他种均表现出一定的季节性。从浮游动物密度和生物量来看,10 个站位均为2008年7月最高、2007年11月次之、2008年3月最低。这是因为浮游动物的生长、繁殖除与水温等水化条件有关[11]外,还取决于浮游植物的丰欠,所以浮游动物密度和生物量的季节变化规律与浮游植物季节变化规律有一定的相关性,本研究中调查发现,浮游动物呈现与浮游植物相同的季节变化规律。但该海域的浮游动物密度、生物量都显著小于同季、相近纬度黄海北部对虾放流区的浮游动物量[12]。根据贾晓平等[10]对饵料生物水平划分的等级来看,除2008年3月调查的葫芦岛贝类养殖区浮游动物属低水平等级外,其他两次的调查结果均属中低水平等级。另外,有学者研究得出浮游动物的丰度和生物量与潮流大小也有一定关系[13],由于本次调查的海域高低潮差较小(约1 m 左右),所以并未考虑潮流因素,潮流对该海域浮游动物量有无影响尚需进一步研究。
浮游植物群落的多样性指数可以在一定程度上反映出海区环境条件的优劣[14-15]。在正常环境下,丰富度指数较高;环境受污染时,丰富度指数降低。按照多样性指数与水体污染程度关系:0 ~1.0(重污染)、1.0 ~3.0(中度污染)和>3.0(轻度污染或无污染)[7]来判断,调查期间葫芦岛贝类养殖区属于轻度污染或无污染状态。
[1]国家海洋局.GB 17378—2007 海洋监测规范[S].北京:中国标准出版社,2008.
[2]董双林,赵文.养殖水域生态学[M].北京:中国农业出版社,2004.
[3]Khalil A M.Influence of starvation,body size and temperature on ammonia excretion in the marine bivalve Tapes decussates[J].Aquaculture Res,2008,25(8):839-847.
[4]Magni P,Montani S,Takada C,et al.Temporal scaling and relevance of bivalve nutrient excretion on a tidal flat of the Seto Inland Sea,Japan[J].Mar Ecol Prog Ser,2000,198:139-155.
[5]Dortch Q,Whitledge T E.Does nitrogen or silicon limit phytoplankton production in the Mississippi plume and nearby regions?[J]Cont Shelf Res,1992,12:1293-1309.
[6]何志辉,赵文.养殖水域生态学[M].大连:大连出版社,2001.
[7]赵文,魏洪祥,郭凯.2006—2007年大连大窑湾海区浮游植物的群落结构及其季节变化[J].大连海洋大学学报,2011,26(4):291-298.
[8]周凯,黄长江,姜胜,等.2000—2001年柘林湾浮游植物群落结构及数量变动的周年调查[J].生态学报,2002,22(5):688-698.
[9]陈菊芳,齐雨藻,徐宁,等.大亚湾澳头浮游植物群落结构及周年数量动态[J].水生生物学报,2006,30(3):311-317.
[10]贾晓平,杜飞雁,林钦,等.海洋渔场生态环境质量状况综合评价方法探讨[J].中国水产科学,2003,10(2):160-164.
[11]刘丙阳,赵文,郭凯,等.辽宁汤河水库浮游动物的群落结构及其时空格局[J].大连海洋大学学报,2011,26(6):526-531.
[12]董婧,刘海映,王文波,等.黄海北部对虾放流区的浮游动物[J].大连水产学院学报,2000,15(1):65-70.
[13]王彬,刘春洋,李轶平,等.长兴岛沿岸春季和夏季的浮游动物群落结构[J].水产科学,2011,30(9):538-542.
[14]李广玉,鲁静,何拥军.胶州湾浮游植物多样性与环境因子的关系[J].海洋地质动态,2005,21(4):10-13.
[15]李庆南,赵文,殷旭旺,等.辽河太子河水系的浮游植物种类多样性研究[J].大连海洋大学学报,2011,26(4):322-327.
