真鲷虹彩病毒辽宁株跨膜蛋白(ORF049L)基因的克隆及表达
2013-02-15孙志鹏徐祥李强叶仕根李华
孙志鹏,徐祥,李强,叶仕根,李华
(大连海洋大学 农业部北方海水增养殖重点实验室,辽宁大连116023)
虹彩病毒科Iridoviridae 包括5 个属,即虹彩病毒属Iridovirus、绿虹彩病毒属Chloriridovirus、蛙病毒属Ranavirus、淋巴囊肿病毒属Lymphocystivirus和细胞肿大病毒属Megalocytivirus[1],其中细胞肿大病毒属的虹彩病毒Iridoviruses 被认为是近年来导致东亚及东南亚地区等许多国家的重要经济鱼类大量死亡的主要病原之一[2-4]。因此,虹彩病毒也成为国际水生动物病毒病研究的热点之一。2009年,农业部北方海水增养殖重点实验室科研人员在中国辽宁省某养殖场发病的条石鲷Oplegnathus fasciatus体内分离到一种病毒,经过分子生物学及电镜观察等方法确定该病毒为真鲷虹彩病毒,暂时将其命名为真鲷虹彩病毒辽宁株(RSIV-LN09)[5]。
囊膜病毒的膜蛋白具有多种生物学功能[6],它是细胞识别的重要抗原表位,也是设计和制备抗病毒药物及疫苗的关键靶标[7]。Caipang等[8]和Kim等[9-10]分别利用虹彩病毒的跨膜蛋白制备出了免疫保护率较高的核酸疫苗和对病毒具有较强中和作用的多克隆抗体,王小文等[11]、何利波等[12]、吴成龙等[13]在虹彩病毒功能蛋白研究方面也开展了一些工作,但关于其膜蛋白结构和功能方面的研究却很少[14]。开展膜蛋白方面的研究对于阐明病毒与宿主细胞的作用机制以及开发抗病毒疫苗具有重要作用。为此,本研究中作者克隆了真鲷虹彩病毒辽宁株一个跨膜蛋白(ORF049L)的基因序列,利用生物信息学方法分析了该蛋白的基本结构特征,经原核表达和纯化得到了大量高纯度的重组蛋白His-049L,为进一步制备病毒跨膜蛋白单克隆抗体及其功能研究奠定了基础。
1 材料与方法
1.1 材料
1.1.1 病毒、质粒和菌株 虹彩病毒分离自2009年辽宁省某养殖场的发病条石鲷。克隆载体pMD-18T 购于宝生物工程(大连)有限公司,表达载体pET-28a(+)购于Novagen 公司,大肠杆菌DH5α 及BL21(DE3)感受态细胞购于天根生化科技(北京)有限公司。
1.1.2 工具酶和试剂 T4 DNA 连接酶及限制性核酸内切酶EcoR I、Sal I 购于宝生物工程(大连)有限公司;质粒小量抽提试剂盒、氨苄青霉素(Amp)、盐酸胍购自上海生物工程有限公司;卡那霉素(Kan)、异丙基-β-D-硫代半乳糖苷(IPTG)、PCR 产物纯化回收试剂盒购自BBI 公司;琼脂糖凝胶DNA 回收试剂盒、His-Tag 单克隆抗体购自天根生化科技(北京)有限公司;His-Bind Purification Kit 购自Novagen 公司。
1.2 方法
1.2.1 病毒总DNA 的提取 取濒死鱼的脾脏100 mg,置于1.5 mL Eppendorf 管中,在10 ℃条件下,采用CTAB 方法[15]提取病毒DNA,于-20 ℃下保存备用。
1.2.2 ORF049L 基因的克隆 根据文献[9]和质粒pET-28a(+)酶切位点设计引物,上游引物P1: 5' GAATTCATGTACCCTGACTGTCCCAG 3'(EcoR I);下游引物P2:5' GTCGACTTATTTCAT- AAGCCTTGCAC A 3'(Sal I)。
PCR 反应总体系25 μL,其中包括:Taq 酶0.2 μL,10×buffer 2.5 μL,模板DNA 1.0 μL,上下游引物P1、P2 各1 μL,ddH2O 19.3 μL。反应条件为:95 ℃下预变性5 min;94 ℃下变性30 s,55 ℃下退火30 s,72 ℃下延伸40 s,共进行30 个循环;最后在72 ℃下再延伸8 min。PCR 产物经电泳鉴定、产物回收试剂盒纯化后连接至pMD-18T 载体中,然后转化至大肠杆菌DH5α 感受态细胞中。挑选阳性克隆送上海生物工程有限公司测序。
1.2.3 ORF049L 基因及其编码的蛋白序列分析采用Blastn和Blastx 程序(http://blast.ncbi.nlm.nih.gov/)进行序列比对;采用SignalP 4.0 Server程序(http://www.cbs.dtu.dk/services/SignalP/)进行信号肽预测;采用 ExPASy(http://www.expasy.org/)和TMpred(http://www.ch.embnet.org/software/TMPRED_ form.html)在线工具进行ORF049L 蛋白的理化性质及跨膜结构域分析;采用DNA Star 软件的Protean 功能进行蛋白抗原特性分析。
1.2.4 原核表达条件的优化 按照质粒提取试剂盒说明书中的方法提取pMD-18T-049L 重组质粒,用EcoR I和Sal I 限制性内切酶对重组质粒pMD-18T - 049L和pET - 28a 质粒进行双酶切,用T4 DNA 连接酶将切胶回收的目的片段与pET-28a 质粒连接后转化至大肠杆菌DH5α 感受态细胞中,并挑选阳性克隆进行测序,将测序结果正确的pET-28a -049L 质粒转化至大肠杆菌BL21(DE3)感受态细胞中,然后涂布于卡那霉素(Kan,30 μg/mL)LB 筛选平板上。次日挑取转化至LB 平板上长出的阳性菌落,于37 ℃条件下在LB 液体培养基(Kan,30 μg/mL,下同)中活化过夜,即为初始培养液。参照文献[16-18]中的方法进行原核表达条件(诱导温度、IPTG 浓度及诱导时间)的优化,具体步骤如下:
诱导温度:取初始培养液,按照1%接种量分别接种到3 个内有1 mL LB 液体培养基的离心管中,于37 ℃条件下培养至OD600nm值为0.5 时加入IPTG,使其终浓度为1.0 mmol/L,分别于16、25、37 ℃下诱导6 h,离心收集菌体并经超声破碎后进行SDS-PAGE 分析。
IPTG 浓度:取初始培养液,按照1%接种量分别接种到6 个内有1 mL LB 液体培养基的离心管中,于37 ℃条件下培养至OD600nm值为0.5 时加入IPTG,使 其 终 浓 度 分 别 为0、0.2、0.4、0.6、0.8、1.0 mmol/L,37 ℃下继续培养6 h,离心收集菌体并经超声破碎后进行SDS-PAGE 分析。
诱导时间:取初始培养液,按照1%接种量分别接种到4 个内有1 mL LB 液体培养基的离心管中,于37 ℃条件下培养至OD600nm值为0.5 时加入IPTG,使其终浓度为1.0 mmol/L,37 ℃下继续培养,分别于加入IPTG 后的0、1、3、6 h 后取样,离心收集菌体并经超声破碎后进行SDS-PAGE 分析。
1.2.5 Western blot 分析 将表达产物进行SDSPAGE 分析后,电转移至硝酸纤维素(NC)膜上。在4 ℃条件下用质量浓度为50 g/L 的脱脂乳封闭过夜;用PBST 洗涤3次,每次5 min;置于抗His单抗中(用0.01 mol/L PBS 稀释至终浓度为0.1 μg/mL),于37 ℃下缓慢摇动1 h;再用PBST 洗涤3次,每次5 min。将NC 膜加入至碱性磷酸酶(AP)标记的羊抗小鼠IgG 抗体中(按1∶2 000稀释于0.01 mol/L PBS 中),于37 ℃下缓慢摇动1 h,再用PBST 缓冲液洗涤3次后,加入NBT/BCIP底物显色液显色5 min,观察结果。
1.2.6 融合蛋白的纯化 融合蛋白在宿主菌中主要以不可溶的包涵体状态存在。将表达产物进行超声波破碎后离心收集包涵体,然后用含变性剂的1×Bind Buffer(500 mmol/L NaCl,20 mmol/L Tris-HCl,5 mmol/L 咪唑,6 mol/L 盐酸胍,pH 7.9)于冰上充分溶解,在4 ℃下以16 000 g 离心30 min,上清用0.45 μm 微孔滤膜过滤,将过滤好的上清加入到已平衡好的层析柱中,按照His-Bind Purification Kit 蛋白变性条件下的纯化方式进行洗脱并分段收集结合的目的蛋白。取10 μL 收集物用水5 倍稀释后,进行SDS-PAGE 分析。将纯化好的蛋白液置于-20 ℃下保存备用。
2 结果
2.1 ORF049L 基因的克隆
以重组质粒pMD-18T-049L 为模板,用EcoR I、Sal I 内切酶进行酶切验证以及用P1和P2 引物进行PCR 扩增。经10 g/L 琼脂糖凝胶电泳,可得到429 bp 的预期DNA 目标带(图1)。
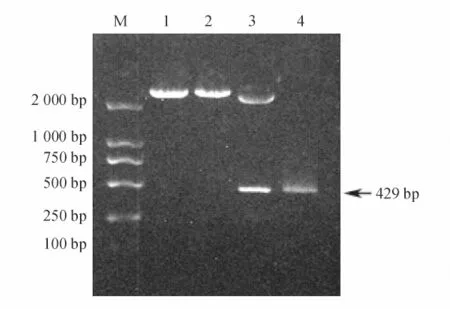
图1 重组质粒pMD-18T-049L 的酶切及PCR 鉴定Fig.1 Identification of recombination plasmid pMD-18T-049L by enzyme digestion and PCR
2.2 ORF049L 基因及其编码蛋白的序列分析
对测序结果分析表明,RSIV-LN09-ORF049L的全长为429 个核苷酸,编码了一个由142 个氨基酸组成的蛋白,推测其相对分子质量为16 127.8。该蛋白上无信号肽区域,等电点为7.53;不稳定指数为34.04,属稳定蛋白;总平均疏水值为0.149,属疏水蛋白[19]。跨膜拓扑结构预测结果表明,在第121 ~138 个氨基酸残基处为一个由内向外的跨膜区(score:1855),而在第62 ~80 个氨基酸残基处为由外向内的跨膜区(score:622,score 值大于500可视为显著)(图2)。NCBI Blast同源性搜索结果显示,RSIV-LN09-ORF049L 核苷酸 序 列 与 RBIV(AY532606.1)、OSGIV(AY894343.1)、LYCIV(AY779031.1)、ISKNV(AF371960.1)、TBIV(GQ27349 2.1)5 个基因序列的相似度分别为99%、99%、99%、94%、92%。编码的氨基酸序列与 RBIV ORF049L(AAT71864.1)、OSGIV ORF52L(AAX82361.1)、ISKNV ORF050L(NP 612272.1)和TBIV ORF48L(ADE34393.1)4 个蛋白的氨基酸序列的相似度分别高达100%、100%、90%、87%。

图2 ORF049L 蛋白跨膜拓扑结构的预测Fig.2 Predicted membrane topology of ORF049L protein
综合Kyte-Doolittle 亲水性分析、Hopp-Woods最大局部亲水性分析、Jameson-Wolf 抗原指数分析和Emini表面可能性分析,得出结果如下:ORF049L 蛋白具有许多潜在的抗原决定簇,尤其在氨基酸序列的第1 ~11、33 ~41、53 ~61、76 ~84、91 ~98、106 ~118、139 ~141 区域及附近存在B 细胞抗原表位的可能性较高,易于与抗体嵌合[20](图3)。
2.3 融合蛋白的表达、纯化及Western blot 分析
2.3.1 表达条件的优化 参照张喆等[16]的方法进行融合蛋白表达条件的优化。从图4(a)可见:在相同的IPTG 浓度(1 mmol/L)和诱导时间(6 h)下,不同的培养温度(16、25、37 ℃)可显著影响转化了pET-28a-049L 的大肠杆菌BL21(DE3)全菌蛋白(重组蛋白)的表达;在培养温度为37 ℃时,重组蛋白的相对表达量最高,在培养温度为16 ℃时,重组蛋白的相对表达量最低。
从图4(b)可见:在相同的培养温度(37℃)和诱导时间(6 h)条件下,不同的IPTG 浓度(0、0.2、0.4、0.6、0.8、1.0 mmol/L)可显著影响重组蛋白的表达;不添加诱导剂时无目的蛋白表达,用0.2、0.4 mmol/L 的IPTG 诱导时重组蛋白的相对表达量很低,用0.8 mmol/L 的IPTG 诱导时重组蛋白的相对表达量最高。
从图4(c)可见:在相同培养温度(37 ℃)和IPTG 浓度(1 mmol/L)条件下,不同的诱导时间(0、1、3、6 h)对重组蛋白的表达有较大影响;重组蛋白的相对表达量随诱导时间的增加而增加,在诱导时间为4 h 重组蛋白有明显表达,诱导时间为6 h 重组蛋白的相对表达量最大。
2.3.2 纯化及Western blot 分析 SDS-PAGE 分析表明:经IPTG 诱导后的重组菌全菌蛋白比转化了pET-28a 的大肠杆菌BL21(DE3)全菌蛋白(未诱导和诱导)、未经诱导的转化了pET-28a-049L 的大肠杆菌BL21(DE3)全菌蛋白在相对分子质量为17 000 处多出一条蛋白条带(图5(a))。经Western blot 鉴定,该条带能特异性地与His·Tag 单克隆抗体发生反应(图5(b)),证实了17 000 处的条带为含有目的蛋白的融合表达产物。
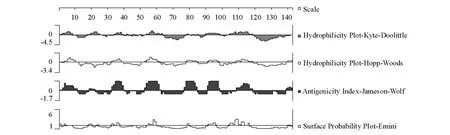
图3 ORF049L 蛋白的亲水性、抗原指数及表面可能性分析Fig.3 Hydrophilicity plot,surface probability plot and antigenicity index for ORF049L protein
3 讨论
目前,虹彩病毒科内已经有14 株病毒完成了全基因组测序[21]。经序列对比后发现,RSIVLN09 - ORF049L 与数据库中 RBIV ORF049L(AAT71864.1)、OSGIV ORF52L(AAX82361.1)、ISKNV ORF050L(NP 612272.1)和TBIV ORF48L(ADE34393.1)4 个蛋白的氨基酸序列高度相似,其序列相似度分别为100%、100%、90%和87%,未发现其他具有较高相似度的氨基酸序列。因这4种蛋白所属病毒都是细胞肿大病毒属的病毒,故推测这些相似蛋白可能是细胞肿大病毒属的病毒(Megalocytivirus)所特有的结构蛋白,而这一特点为利用该蛋白制备病毒的单克隆抗体提供了重要的参考依据。
本研究中采用TMpred在线工具对 RSIV-LN09-ORF049L 蛋白结构进行分析,结果表明,该蛋白在第62 ~80和第121 ~138 氨基酸残基处存在两个跨膜区域,这与Kim等[9]基于隐马尔可夫模型(Hidden Markov model,HMM)的预测结果略有不同,可能与两者采用的计算方法不同有关,但对于ORF049L 蛋白是跨膜蛋白的结论是一致的。通过对ORF049L 蛋白的抗原决定簇分析发现,蛋白的潜在B 细胞抗原优势表位主要集中在氨基酸序列的可变区域,说明该蛋白具有良好的抗原性[22]。抗原表位与蛋白质的高级结构密切相关,但是目前该蛋白的结构和具体功能尚不清楚,因此,本研究结果只可作为确定该蛋白潜在优势表位的参考,蛋白实际特性还需要进一步进行试验验证。
为进一步研究虹彩病毒跨膜蛋白的功能,在上述生物信息学分析的基础上,进行了RSIV-LN09-ORF049L 重组蛋白的表达研究。经SDS-PAGE 分析表明,经IPTG 诱导后的重组菌全菌蛋白比转化了pET-28a 的大肠杆菌BL21(DE3)全菌蛋白(未诱导和诱导)、未经诱导的转化了pET-28a-049L 的大肠杆菌BL21(DE3)全菌蛋白在相对分子质量约为17 000 处多出一条蛋白条带。这正好与目的基因和pET-28a 载体上的标签序列一起融合表达的重组蛋白的预期大小一致。通过Western blot 鉴定发现,该条带能特异性地与His·Tag 单克隆抗体发生反应。这表明所获得的相对分子质量为17 000 的蛋白即为His-049L 重组蛋白。研究发现,诱导温度、IPTG 浓度及诱导时间等因素对His-049L 重组蛋白的表达都有一定的影响。经优化后的表达条件为:在37 ℃培养条件下,用0.8 mmol/L IPTG 诱导6 h。在此条件下,可以得到大量的包涵体蛋白,经变性溶解及镍琼脂糖凝胶柱纯化后即可获得纯度较高的重组蛋白。目前利用纯化蛋白制备单抗的工作正在进行中,这也为虹彩病毒的早期检测及ORF049L 蛋白功能等研究提供了基础。
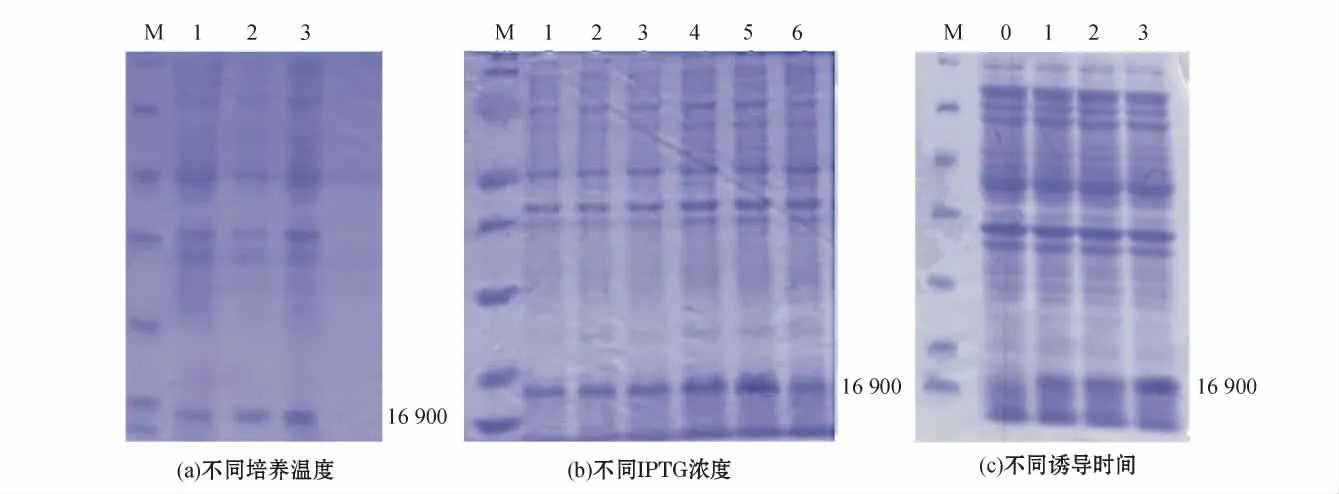
图4 不同诱导条件下重组蛋白His-049L 的表达Fig.4 Expression of recombinant protein His-049L under different induction conditions

图5 重组蛋白His-049L 的表达、纯化及Western blot 检测Fig.5 Expression,purification and western blotting analysis of recombinant protein His-049L
[1]洪健,周雪平.ICTV 第八次报告的最新病毒分类系统[J].中国病毒学,2006,21(1):84-96.
[2]He J G,Wang S P,Zeng K,et al.Systemic disease caused by an iridovirus-like agent in cultured mandarin fish,Siniperca chuatsi(Basilewsky),in China[J].J Fish Dis,2000,23:219-222.
[3]Shi C Y,Wang Y G,Shao L Y,et al.The first report of an iridovirus-like agent infection in farmed turbot,Scophthalmus maximus,in China[J].Aquaculture,2004,236:11-25.
[4]Dong C F,Weng S P,Shi X J,et al.A new marine megalocytivirus from spotted knifejaw,Oplegnathus punctatus,and its pathogenicity to freshwater mandarin fish,Siniperca chuatsi[J].Virus Res,2010,147:98-106.
[5]李华,孙志鹏,李强,等.条石鲷检出的虹彩病毒特性研究[J].病毒学报,2011,27(2):158-164.
[6]杨金华,叶荣.病毒跨膜蛋白的结构功能与抗病毒药物设计[J].微生物与感染,2009,4(4):231-240.
[7]He J,Hu H J,Harrison R,et al.Transmembrane segments prediction and understanding using support vector machine and decision tree[J].Exp Syst Appl,2006,30:64-72.
[8]Caipang C M,Takano T,Hirono I,et al.Genetic vaccines protect red sea bream,Pagrus major,upon challenge with red sea bream iridovirus(RSIV)[J].Fish & Shellfish Immun,2006,26:130-138.
[9]Kim Y,Ha Y,Ahn S J,et al.Production and characterization of polyclonal antibody against recombinant ORF049L of rock bream(Oplegnathus fasciatus)iridovirus[J].Process Biochem,2007,42(2):134-140.
[10]Kim Y,Kim S.Production and characterization of polyclonal antibody against recombinant ORFs of rock bream iridovirus(RBIV)[J].J Nati Fish Univ Kroea,2007,56(1):171-177.
[11]王小文,陈新华.大黄鱼虹彩病毒腺苷三磷酸酶(ATPase)基因的克隆与表达[J].病毒学报,2004,20(1):81-85.
[12]何利波,柯飞,张奇亚.蛙虹彩病毒一个序列保守基因(RGV-12L)的克隆表达及定位分析[J].水生生物学报,2010,34(6):1166-1171.
[13]吴成龙,史成银,黄捷,等.大菱鲆红体病虹彩病毒主要衣壳蛋白基因在毕赤酵母中的重组分泌表达[J].渔业科学进展,2009,30(3):55-61.
[14]Xu X P,Lu J,Lu Q X.Characterization of a membrane protein(VP001L)from infectious spleen and kidney necrosis virus(ISKNV)[J].Virus Genes,2008,36(1):157-167.
[15]刘荭,高隆英,史秀杰,等.用逆转录多聚酶链式反应从凡纳对虾中检出传染性皮下组织和造血器官坏死病毒[J].水产学报,2002,26(2):185-188.
[16]张喆,李健,王芸,等.中国对虾细胞色素P450 基因CYP4 原核表达条件优化[J].海洋科学,2011,35(9):49-55.
[17]方珍珍,景宏丽,江育林,等.草鱼呼肠孤病毒VP5 蛋白的表达与纯化[J].大连海洋大学学报,2012,27(6):508-512.
[18]陶然,刘瑞,王晴,等.哈维氏弧菌硫氧还蛋白还原酶在大肠杆菌中的表达及对大菱鲆的免疫保护作用[J].大连海洋大学学报,2012,27(2):137-142.
[19]金春梅,张守发,于龙政.牛瑟氏泰勒虫P23 基因的克隆与生物信息学分析[J].安徽农业科学,2008,36(24):10381-10382.
[20]张昱,王永录,张永光.口蹄疫病毒株AF72 VP1 的结构构建与B 细胞表位预测[J].生物技术通报,2008(6):158-163.
[21]Shi C Y,Jia K T,Yang B,et al.Complete genome sequence of a Megalocytivirus(family Iridoviridae)associated with turbot mortality in China[J].Virology J,2010,7:159.
[22]王笑英,杜培革,吴春风.OLFM1 蛋白的生物信息学分析及其多克隆抗体制备与鉴定[J].中国免疫学杂志,2010,26(8):721-723.
