腹膜假黏液瘤23例临床诊治和预后分析
2013-02-14魏振军李虹义罗继征
魏振军,李虹义,梁 浩 ,罗继征
腹膜假黏液瘤(pseudomyxoma peritonei,PMP)指腹腔内大量胶冻样黏液聚集并在腹膜、网膜及腹盆腔脏器上广泛种植的临床病变。目前研究已证实阑尾黏液性肿瘤是导致PMP的主要病因[1-2]。PMP具有特殊的临床及病理特点,目前临床对其认识尚不够充分,术前误诊率高,给诊治带来较大困难。笔者对1995年5月—2009年6月收治的23例PMP的临床资料进行回顾性分析,现总结如下。
1 资料与方法
1.1 临床资料 解放军总医院于1995年5月—2009年6月收治PMP 23例,男13例,女10例;年龄36~75(56.6 ±12.8)岁。
1.2 入选标准 病例均符合PMP诊断标准[3],即大量黏液样物黏着于腹膜脏层或壁层、大网膜及肠壁的浆膜面,形成大小不等的囊泡状;光镜下囊泡壁由很薄的结缔组织组成,囊泡内充满黏液,囊壁内衬高柱状上皮细胞,有时内衬上皮完全缺如。
1.3 纳入分析的因素 包括性别、年龄、症状、体征、医技检查、治疗及生存率等。
1.4 随访 对入组病例进行电话或书信以及门诊方式随访。生存期以第一次手术时间开始计算,随访时间12~180个月。
1.5 统计学处理 应用SPSS 17.0统计学软件进行数据分析,小样本资料比较采用χ2检验精确概率法;生存期比较采用Log-rank检验,α=0.05为检验水准;Kaplan-Meier法计算生存率并绘制生存函数图。
2 结果
2.1 一般情况 本组≥60岁10例,男5例,女5例;<60岁13例,男8例,女5例。不同年龄段性别比较差异无统计学意义(P>0.05)。既往慢性阑尾炎病史3例。10例女性患者中合并双侧卵巢黏液性囊腺瘤2例,卵巢黏液性腺癌1例。
2.2 症状与体征 主诉症状依次为进行性腹胀17例(73.9%),腹部包块 13 例(56.5%),腹痛 9 例(39.1%),发热 4 例(17.4%),排便困难 2 例(8.7%),腹泻、消瘦、四肢关节疼痛各 1 例(4.3%)。体征:中下腹或右下腹部包块 9例(39.1%),右下腹压痛 9 例(39.1%),移动性浊音阳性6 例(26.1%)。
2.3 医技检查
2.3.1 实验室检查:术前进行血清四项肿瘤标志物检测 12例,其中癌胚抗原(CEA)升高 8例(66.7%),CA19-9 升高 7 例(58.3%),CA125 升高6例(50.0%),CA72-4 升高 5 例(41.7%),CEA、CA19-9同时升高5例(41.7%),四项同时升高3例(25.0%)。术后复发的10例中 CEA升高 9例(90.0%)。
2.3.2 术前影像学检查:行腹部B超检查21例,其中腹盆腔囊实性或囊性包块15例(71.4%),流动性差回声腹水8例(38.1%)。CT检查12例,肝脾表面扇形压迹9例(75.0%),腹部囊实性肿块和腹水各 8例(66.7%),腹水与包块并存 5例(41.7%)。X线钡剂灌肠检查4例,回盲部不规则充盈缺损3例,阑尾充盈不佳1例。其他:行结肠镜检查3例,回盲部肿物1例,余未见异常。
2.4 诊断与治疗 本组全部接受手术治疗。术前诊断:腹腔肿物6例,卵巢肿瘤、回盲部结肠癌及阑尾炎各3例,腹膜间皮瘤及肠梗阻各2例,阑尾肿瘤及腹腔结核各1例,诊断PMP仅2例。其中行腹腔减瘤术17例,肿瘤细胞减灭术3例,因肿瘤巨大或腹腔转移广泛仅行活检术3例。全部病例无腹盆腔以外脏器转移,肠系膜淋巴结转移1例。最多行5次手术,平均2.2次。术后接受全身化疗3例(分别为奥沙利铂+氟尿嘧啶+四氢叶酸钙、替加氟/尿嘧啶+丝裂霉素、去氧氟尿苷+四氢叶酸钙+表柔比星等),腹腔内灌注化疗9例(氟尿嘧啶+丝裂霉素/卡铂或顺铂),其中1例同时行全身化疗(奥沙利铂+氟尿嘧啶+四氢叶酸钙)。
2.5 病理诊断 23例术后病理示:黏液湖中可见少量黏液性上皮成分(箭头),见图1。诊断为PMP。其中伴阑尾低级别黏液性肿瘤9例,阑尾黏液腺癌14例。
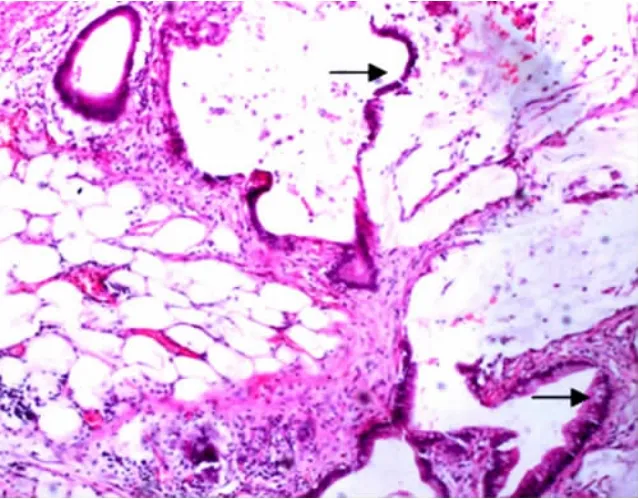
图1 腹膜假黏液瘤病理表现(HE×40)
2.6 预后生存 获得随访18例。12例在术后2个月~4年复发。7例于术后2~10年死于肿瘤复发,11例存活。Kaplan-Meier法计算总体生存率,3、5及10年生存率分别为 79.7%、54.7%及 27.3%(图2)。生存时间(97.0 ±14.1)个月,中位生存时间120.0 个月(95%CI:51.4 ~188.6)。术后腹腔灌注化疗8例中位生存时间78.0个月,未行腹腔灌注化疗的10例,中位生存时间为51.0个月,Log-rank检验两者生存时间差异无统计学意义(P=0.098)。
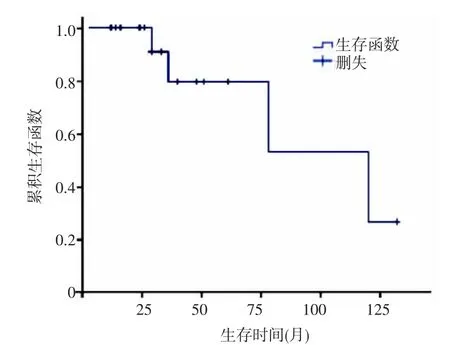
图2 18例获随访腹膜假黏液瘤生存曲线图
3 讨论
PMP由Werth于1884年首先提出,之所以称之为假黏液瘤是因为腹水中黏液生化性质与普通黏液瘤不同。本组病例术后病理均明确证实伴有阑尾黏液性肿瘤,提示阑尾黏液性肿瘤与PMP有密切联系,也与研究证实的PMP主要起源于阑尾相一致[1-2]。PMP发病率低,临床相对少见,性别差异无显著性,好发于中老年人群[4]。本组中不同年龄段性别构成比例差异无统计学意义,发病年龄(56.6 ±12.8)岁,与文献报道相符。
PMP临床表现多无特异性,本组主要表现为进行性腹胀、腹部包块、右下腹压痛、移动性浊音阳性等,这是PMP极易误诊的重要原因。Miner等[5]研究也提示,PMP患者中,多数表现为进行性腹胀、急性阑尾炎症状,而14%以胃肠道梗阻症状为主,6%出现腹股沟疝。出现上述症状的原因是黏液性肿瘤破裂穿孔,向腹盆腔内广泛播散并种植在腹盆腔脏器及大小网膜表面,粘连形成肿块,或形成大量黏液性腹水,部分病例此阶段也可无明显症状。少部分病例因肿瘤生长阻塞阑尾管腔,导致腔内引流不畅并发感染,临床出现右下腹痛、发热等症状[6]。
CEA、CA19-9、CA125、CA72-4 等肿瘤标志物水平在本组PMP中均增高,虽不具特异性,但可用于帮助鉴别诊断和疗效的判定。尤其在术后复发病例中,CEA升高比例较高(90.0%),提示CEA对判断术后有无复发有一定参考价值。Carmignani等[7]研究发现复发病例再次手术前CEA水平增高提示预后较差,CEA和CA19-9水平正常提示预后较好。腹部B超可探查到中下腹实性或囊实性肿块,或流动性差回声的腹水征。而CT可发现腹腔内多发低密度肿块及弥漫积液,肝脾表面扇形压迹,网膜呈饼样增厚或钙化。相比之下,CT可更好反映出腹盆腔内病变情况,对判断复发和病情评估有重要价值,可以作为首选检查[8]。X线气钡双重造影检查在回盲部也可发现不规则充盈缺损或有外压性改变。
PMP的预后与原发肿瘤的性质、腹膜肿瘤的组织学分级及治疗方式等因素相关[9]。研究证实,肿瘤细胞减灭术联合腹腔灌注化疗能改善PMP患者预后,延长生存时间,推荐为标准治疗方案[10]。多数病例确诊时腹盆腔内已有广泛种植转移,而肿瘤细胞减灭术难度大、风险高,目前腹腔减瘤术仍应用较多。本组治疗以腹腔减瘤术为主。因PMP进展主要在腹盆腔内,除手术外腹腔灌注化疗等亦十分重要。Elias等[11]研究提示,术后是否行腹腔灌注化疗也是影响PMP预后的重要因素之一。本研究术后联合腹腔灌注化疗者5年生存率和中位生存时间均高于未行腹腔灌注化疗者,但差异无统计学意义,考虑与样本量偏小等因素有关。但上述结果仍提示术后联合腹腔灌注化疗在一定程度延长了患者生存时间。Cole等[12]研究肯定了腹腔灌注化疗在PMP治疗中的重要地位,提出除非有更新的前瞻性研究数据,所有PMP病例均应行腹腔灌注化疗。本组近期预后相对较好,3、5年生存率为79.7%、54.7%,但10年生存率较低(27.3%),考虑与入组病例中阑尾黏液腺癌所占比例(60.9%)较高有关。
PMP起病多数隐匿、进展缓慢,早期可无任何症状,给诊断治疗带来困难。要提高诊断率,关键是要加深对本病的认识。对腹胀、腹部包块和不明原因腹腔积液,既往有阑尾炎或阑尾切除史,B超及CT发现中下腹囊实性占位,X线钡剂灌肠提示阑尾未显影、回盲部压迹或阑尾开口处充盈缺损,应积极进行阑尾源性PMP鉴别诊断。手术联合腹腔灌注化疗是治疗PMP和提高患者生存率的主要措施。
[1] Ferreira CR,Carvalho JP,Soares F A,et al.Mucinous ovarian tumors associated with pseudomyxoma peritonei of adenomucinosis type:immunohistochemical evidence that they are secondary tumors[J].Int J Gynecol Cancer,2008,18(1):59-65.
[2] 郭爱桃,宋欣,韦立新.女性腹膜假黏液瘤的组织学起源分析[J].临床与实验病理学杂志,2007,23(1):62-66.
[3] 刘复生.中国肿瘤病理学分类(上卷)[M].北京:科学技术文献出版社,2005:311.
[4] Smeenk R M,van Velthuysen M L,Verwaal V J,et al.Appendiceal neoplasms and pseudomyxoma peritonei:a population based study[J].Eur J Surg Oncol,2008,34(2):196-201.
[5] Miner T J,Shia J,Jaques D P,et al.Long-term survival following treatment of pseudomyxoma peritonei:an analysis of surgical therapy[J].Ann Surg,2005,241(2):300-308.
[6] Esquivel J,Sugarbaker P H.Clinical presentation of the Pseudomyxoma peritonei syndrome[J].Br J Surg,2000,87(10):1414-1418.
[7] Carmignani C P,Hampton R,Sugarbaker CE,et al.U-tility of CEA and CA 19-9 tumor markers in diagnosis and prognostic assessment of mucinous epithelial cancers of the appendix[J].JSurg Oncol,2004,87(4):162-166.
[8] 于海涛,胡智军,董健.腹膜假黏液瘤影像诊断价值:附25 例分析[J].医学影像学杂志,2011,21(6):877-880.
[9] Carr N J,Finch J,Ilesley IC,et al.Pathology and prognosis in pseudomyxoma peritonei:a review of 274 cases[J].JClin Pathol,2012,65(10):919-923.
[10] Chua T C,Moran B J,Sugarbaker P H,et al.Early-and long-term outcome data of patients with pseudomyxoma peritonei from appendiceal origin treated by a strategy of cytoreductive surgery and hyperthermic intraperitoneal chemotherapy[J].J Clin Oncol,2012,30(20):2449-2456.
[11]Elias D,Gilly F,Quenet F.Pseudomyxoma peritonei:a French multicentric study of 301 patients treated with cytoreductive surgery and intraperitoneal chemotherapy[J].Eur JSurg Oncol,2010,36(5):456-462.
[12]Cole K,Choudry H,Jones H,et al.Critical role of hyperthermic intraperitoneal chemoperfusion in the treatment of a patient with pseudomyxoma peritonei[J].J Surg Oncol,2012,106:513-516.
