关于开尔文公式推导的讨论*
2013-02-13李爱昌
李爱昌
(廊坊师范学院化学与材料科学学院 河北廊坊065000)
开尔文公式是基础物理化学和界面化学中的一个重要公式,通常在教学中用热力学方法进行推导并介绍其应用。该公式的推导方法大致可以分为两种:第一种是基于气液平衡时化学势相等的方法;第二种是基于始终态相同的不同途径其状态函数的改变量相同的方法。在一些物理化学教材中,对于此公式的推导存在一些令人困惑的问题,本文拟就此谈一下自己的理解和看法。
1 开尔文公式的推导方法
1.1 开尔文公式的第一种推导方法
已有热力学著作[1]对纯物质系统中弯曲界面存在下的液气平衡条件进行了严格的推导,结果可用下式表示:

或

式中α表示液相,β表示气相;σ为表面张力,r为球形液滴半径,pα为液体的压力,pβ为小液滴的饱和蒸气压,μα和μβ分别为液相和气相的化学势。由此可得:弯曲界面存在下气液达平衡的条件与水平液面相同,仍然是气液两相的化学势相等,所不同的只是互成平衡的气液两相压力不等。
基于式(1)的开尔文公式的推导方法在本文中称为第一种推导方法。推导过程如下:
对于平面液体,当气液两相达平衡时,有:

当同温下液体以球形小液滴形式分散存在时,应满足式(1),故有:
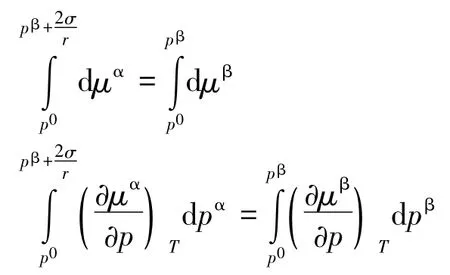
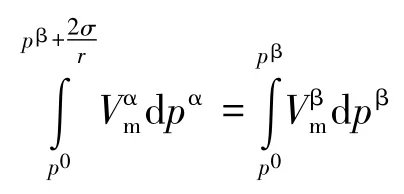

因为2σ/r≫(pβ-p0),故上式可写为:
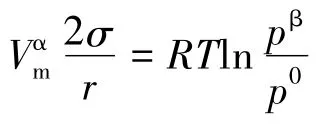
整理得:

式中M和ρ分别是液体的摩尔质量和密度。为使符号统一,本文小液滴的饱和蒸气压一律用p表示,则开尔文公式变为:

1.2 开尔文公式的第二种推导方法
这是基于状态函数特性的一种推导方法,也是存在问题较多的方法。下面以3种教科书[2-4]为例简述于下。
文献[2]认为,把物质的量为dn的微量液体由水平液面转移至半径为r的球形小液滴上,这个过程使小液滴的界面面积增加了8πrdr,界面吉布斯自由能增加了8πrσdr。另外,在这一过程中,吉布斯自由能增加也可以表示为:
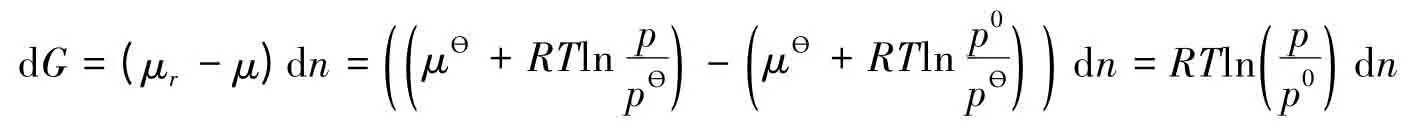
式中p和p0分别表示小液滴和水平液面上的饱和蒸气压。
文献[2]认为,这两个吉布斯自由能的变化相等,即:
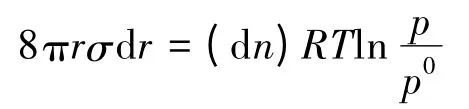
由于dn=4πr2drρ/M,将此式代入上式即得开尔文公式(4)。
这种推导方法认为,把dn液体由平面转移至小液滴上,界面吉布斯自由能增加等于该系统的吉布斯自由能增加。小液滴饱和蒸气压的增加是由于界面吉布斯自由能的增加引起的。
文献[3]推证过程如下:
1mol平面液体变为半径为r的球形小液滴,系统吉布斯自由能的增加(实际应为液体相吉布斯自由能的增加)为:
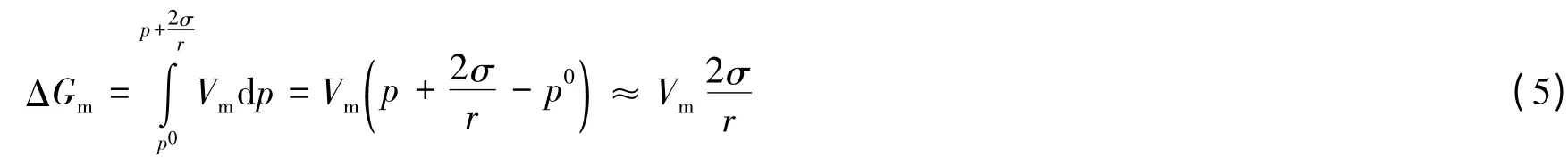
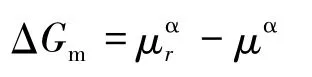
分别是小液滴和平面液体相的化学势,也是与之达平衡的对应气相的化学势。若把蒸气作为理想气体看待,则有:

故

把式(6)代入式(5)即得式(4)所表示的开尔文公式。
文献[4]采用如下的等温循环方法:

过程(Ⅰ)是平面液体的气液平衡,过程(Ⅲ)是小液滴的气液平衡,过程(Ⅱ)表示等温下把平面液体分割为小液滴的过程,过程(Ⅳ)是蒸气的等温变压过程。
文献[4]在2007年以前的印刷本认为:
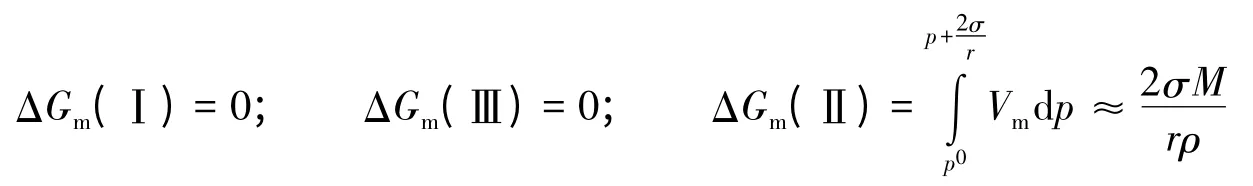
而2008年以后的印刷本(版次相同)则表示为:

文献[4]的各种印刷本都能根据状态函数的性质,由ΔGm(Ⅰ)=ΔGm(Ⅱ)+ΔGm(Ⅲ)+ΔGm(Ⅳ)得到式(4)表示的开尔文方程。
2 讨论
第一种推导方法简明严谨,不存在讨论的问题,下面只对第二种推导方法进行分析讨论。
总结归纳上述属于第二种推导的3种不同方法,可知根本的不同有两点:第一是对于把平面液体分散为小液滴,计算系统吉布斯自由能变化的方法和结果不同;第二是对引起微小液滴的饱和蒸气压增大的原因看法不一。
关于第一点,根据界面热力学,对于有弯曲界面的气液复相系统,把dn mol纯液体自水平液面转移至小液滴上,则系统吉布斯自由能的变化为[5]:
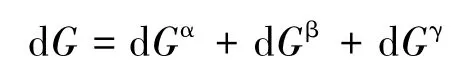
式中γ表示界面相。若系统中不包括气相β(对第二种推导方法,系统中不包括气相才有意义),则有:
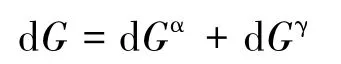
若把界面相看做Gibbs表面(没有厚度和体积),则有:
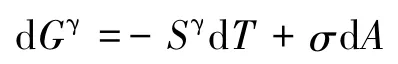
对于体相纯液体,有:
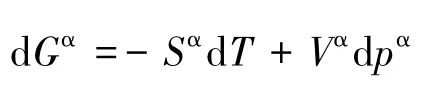
所以,
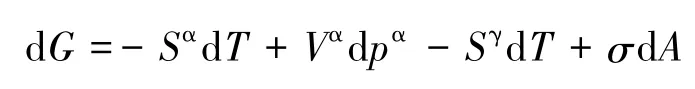
在等温条件下,上式为:
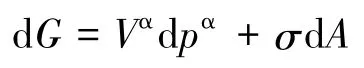
即在等温条件下把平面液体分散为小液滴,若忽略气相,则系统吉布斯自由能的变化由两部分构成,一部分是液相吉布斯自由能的变化,是由液相压力的变化引起的;另一部分是界面相吉布斯自由能的变化,是由界面相面积的变化引起的。
显然,2008年以后印刷的文献[4]是正确的;只考虑界面相吉布斯自由能的变化[2],或只考虑液相吉布斯自由能的变化[3],都是欠妥当的。
关于第二点,由式(1)可知,在弯曲界面存在的气液平衡条件中,只涉及两体相的化学势(或称摩尔吉布斯自由能),界面相吉布斯自由能并不出现在平衡条件中。故由此条件限制所导致的系统中气相的平衡压力(即液体的饱和蒸气压)的变化只能是由另一体相(液相)状态的变化——等温下液体的压力变化引起的,而不可能由界面相吉布斯自由能的变化引起。读者通过阅读本文1.1节更容易理解这一点。文献[2]在推导开尔文公式时,把小液滴化学势(或饱和蒸气压)的增大与界面吉布斯自由能的改变相关联,这种方法容易引起误解。读者容易证明,若忽略水平液面的界面面积,把平面液体分割为球形小液滴这一过程的界面吉布斯自由能变化与该过程液体吉布斯自由能随压力的变化恰好相等。若在推导开尔文公式时说明上述关系,则对读者深刻理解开尔文公式有重要意义。
3 结论和建议
在等温条件下将平面液体分散为小液滴,系统(不包括气相)吉布斯自由能的变化由液相自由能的变化和界面相自由能的变化两部分构成。导致小液滴化学势(或饱和蒸气压)发生改变的能量是由弯曲界面下液体的附加压力引起的液相吉布斯自由能的变化,而不是界面相吉布斯自由能变化。
开尔文方程的第一种推导方法抓住了问题的实质——气液两相达平衡时化学势相等,不涉及界面相,概念明确,思路清晰,简单明了,是值得推荐的方法。不少教材[1,6-7]采用的正是这种方法。第二种推导方法涉及到第三相——界面相,因而使问题复杂化。然而,这种方法有利于学生理解和掌握界面热力学方法,因此,对于学生基础较好的院校可以考虑采用该种方法教学。
[1]王竹溪.热力学简程.北京:人民教育出版社,1964
[2]李松林,周亚平,刘俊吉.物理化学(下册).第5版.北京:高等教育出版社,2009
[3]印永嘉,奚正楷,张树永,等.物理化学简明教程.第4版.北京:高等教育出版社,2007
[4]傅献彩,沈文霞,姚天扬,等.物理化学(下册).第5版.北京:高等教育出版社,2006
[5]顾惕人,朱王步瑶,李外朗,等.表面化学.北京:科学出版社,1994
[6]胡英.物理化学.第5版.北京:高等教育出版社,2007
[7]孙世刚.物理化学(下册).厦门:厦门大学出版社,2008
