配位反应中的物种保护策略*
2013-02-13周朝晖陈全亮
周朝晖 陈全亮
(厦门大学固体表面物理化学国家重点实验室 福建厦门361005)
官能团保护是有机合成反应的重要手段,对某个特定基团的保护或对被保护基团的去保护直接影响着有机反应的成功与否。在不少配位反应中也涉及物种保护,但目前对这方面的研究还较少。本文从有机反应中的官能团保护研究出发,将结合一些配位反应方面的例子,探讨配位反应中的物种保护策略,既涉及配体对金属离子的保护,又包括金属离子对配体的保护。络合滴定就是一个对金属离子进行保护的典型实例。
1 有机反应中的官能团保护
官能团保护是有机合成中很重要的策略之一。当一个反应可能在反应底物的不同部位进行时,采取基团保护,可以使反应试剂对不同的官能团或处于不同化学环境的相同官能团进行选择性反应,从而提高化学反应的选择性。保护基团必须满足:(1)与反应底物有选择地反应,且高产率地生成一个被保护的底物,生成的底物易分离提纯并适于进行后续反应;(2)可与易得到的无害的合适试剂反应而被选择性移去,所选用的合适试剂不会进攻再生的官能团[1-2]。
在有机合成中,常需要保护的基团有羰基、氨基、羟基、双键等,如哥纳香三醇goniotriol和8-acetylgoniotriol的合成过程中涉及到用乙二醇对羰基进行保护,反应结束后可用磷酸水解去除保护基使羰基复原[3];高柠檬酸的合成中利用乙醇酯化保护羧酸基团,三氟乙酸作为去保护试剂,反应如图1所示[4]。
2 配位反应中的物种保护
2.1 络合滴定中金属离子的保护
在络合滴定中,经常需要利用络合反应、氧化还原反应或沉淀反应消除干扰离子的干扰。例如硫氰化钾与二价钴离子反应生成蓝色的络离子,可以用光度分析鉴定二价钴离子的存在。但溶液中若存在三价铁离子,三价铁离子与硫氰化钾反应将生成红色络离子而产生干扰。若加入NaF,使铁离子与氟离子结合生成无色离子,就可消除三价铁离子在分析中对二价钴离子的干扰,此处NaF就是一种掩蔽剂。而加入一种试剂使已掩蔽的离子再释放出来的方法称为解蔽法,加入的这种试剂称为解蔽剂。利用选择性的解蔽剂,可以提高络合滴定的选择性。如在有多种金属离子的乙二胺四乙酸配合物溶液中,加入苦杏仁酸,从SnY(或TiY)中夺取金属离子,定量释放出EDTA。然后,用标准Zn溶液滴定释放出的EDTA,即可求出Sn(或Ti)的量。

图1 官能团保护的实例
2.2 金属离子配位保护下的配体反应性
金属离子能与配体反应形成不同类型的金属配合物。金属配合物可以按金属核数不同分为单核、双核和多核配合物;也可以根据配位聚合物的维数分为一维、二维和三维配位聚合物。金属配合物的形成种类与金属或配体本身的特性有关,也与反应条件有关[5-6]。在配位合成中,由于配体对金属的特定保护,合成过程需要考虑不同配体与金属的配位能力。这种配体保护现象,可以应用在配合物的自组装研究上[7-9]。
以金属盐与丁二酸和联吡啶反应为例,一锅煮一般只能得到金属联吡啶的配合物,这是由于联吡啶的配位能力强于丁二酸,如图2(a)所示。但当丁二酸与金属离子形成配位聚合物后,配位聚合物再与联吡啶反应得到的就是丁二酸和联吡啶的混配配合物,如图2(b)所示。这说明丁二酸与金属形成水溶性配位聚合物后较为稳定,丁二酸的位置不容易被联吡啶取代[10]。由此可见,配位聚合物中的金属离子对丁二酸进行了保护,使它免受联吡啶的进攻而形成单核的金属联吡啶配合物。
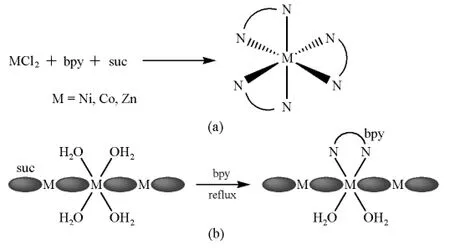
图2 金属盐与丁二酸和联吡啶的反应(bpy为联吡啶,suc代表丁二酸盐)[10]
又如,在高水溶性配位聚合物[Zn(NO3)2(H2O)(1,3-H4pdta)]n(H4pdta为1,3-丙二胺四乙酸)溶液中直接加入过量的溴化钾或硫氰酸钾,单齿配体之间可以发生取代反应,形成溴代或异硫氰酸取代的1,3-丙二胺四乙酸锌配位聚合物[11](图3)。
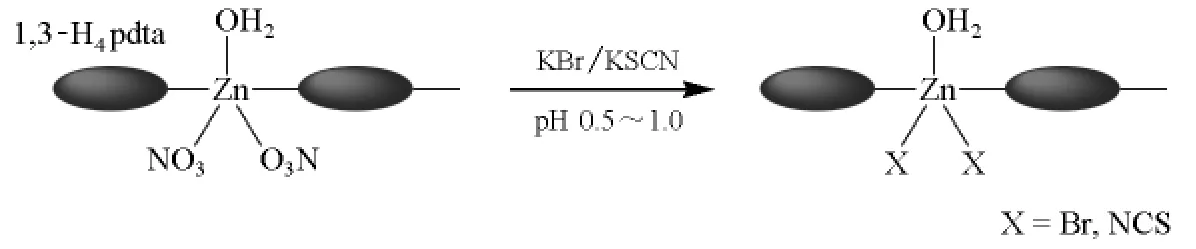
图3 1,3-丙二胺四乙酸硝酸锌配位聚合物的配体取代反应[11]
金属离子与配体反应形成配合物后,金属和配体之间相互保护,并且金属或配体在特定情况下会表现出独特的反应性。在有机合成中,商业化生产乙二胺三乙酸的工艺通常包含保护基的保护和去保护5步反应:乙二胺二乙酸钠盐酸化保护氨基形成2-氧代哌嗪乙酸;加入甲醛生成4-羟甲基-2-氧代哌嗪乙酸;再通过氢氰酸取代得到4-氰亚甲基-2-氧代哌嗪乙酸;碱水解得到2-氧代哌嗪-1,4-二乙酸钠盐,释放出氨;加入足够量的碱去除环保护即可得到乙二胺三乙酸钠盐(图4)[12-13]。但如果使用金属离子对配体进行保护,在过氧化氢存在下,根据配位反应中的物种保护策略原理,可以方便地利用乙二胺四乙酸钛合成乙二胺三乙酸钠,如图5所示[14-15]。钛离子配位保护了乙二胺四乙酸上的3个羧基基团,同时增强了未配位羧基α碳的亲核性能,可以一步直接从水合乙二胺四乙酸钛制备过氧乙二胺三乙酸钛配合物,碱性水解得到乙二胺三乙酸钠。详细的中间体分离和表征研究表明:乙二胺四乙酸与四氯化钛螯合为水合乙二胺四乙酸钛配合物后,在酸性条件下,水合钛配合物与过氧化氢作用形成负一价的过氧乙二胺四乙酸钛配阴离子,释放出未配位的乙酸基团;加碱得到负二价的过氧乙二胺四乙酸钛配阴离子;后者的过氧基团对未配位羧基的α碳进行亲核进攻,完成羧酸亚甲基消除反应,得到过氧乙二胺三乙酸钛配合物。类似的是,1,2-丙二胺四乙酸配位单元在钛离子保护下可以立体选择性转化为高位阻的1,2-丙二胺三乙酸钠。除了过氧金属钛表现出较强的配位保护性能外,钼的过氧化氢反应体系也常常存在类似的物种保护现象。例如乳酸在过氧钼溶液中被氧化成乙酸;苹果酸被氧化成草酸[16-17]。

图4 乙二胺三乙酸的工业制备方法[12-13]
2.3 配位原子保护下的金属原子簇反应性
金属离子与配体螯合后,可能会对配体的反应性产生影响。同样的,配体也将反过来改变金属离子的反应性。以固氮酶的铁钼辅基(FeMo-co)催化活性中心为例(图6),其组成可表示为MoFe7S9C-高柠檬酸,中心原子的确认影响了科学家对铁钼辅基的认识以及对固氮酶固氮机理的研究。早期研究并没有发现中心配位原子[18],后来1.16Å分辨率的单晶衍射分析确认中心含有轻质原子X,很可能是N,但不排除C和O[19]。直到最近,1.00Å分辨率的单晶衍射分析和X光发射光谱研究才将X确定为C,C与周围铁原子的平均距离为2.00Å[20-21]。尽管铁钼辅基对氮分子或一氧化碳等底物的络合活化和加氢转化途径尚不明了,但中心负四价C原子的配位改变了八核原子簇的电子分布,直接影响固氮成氨或一氧化碳转化为低碳烃的反应过程[22-23];由于Fe原子与3个S原子和一个碳原子配位形成四面体构型(图6),C原子的配位也增强了钼参与底物络合活化和转化的可能性[24-27]。因此,固氮酶铁钼辅基中心C原子的确认将会加快固氮酶催化反应及其作用机理研究的步伐。
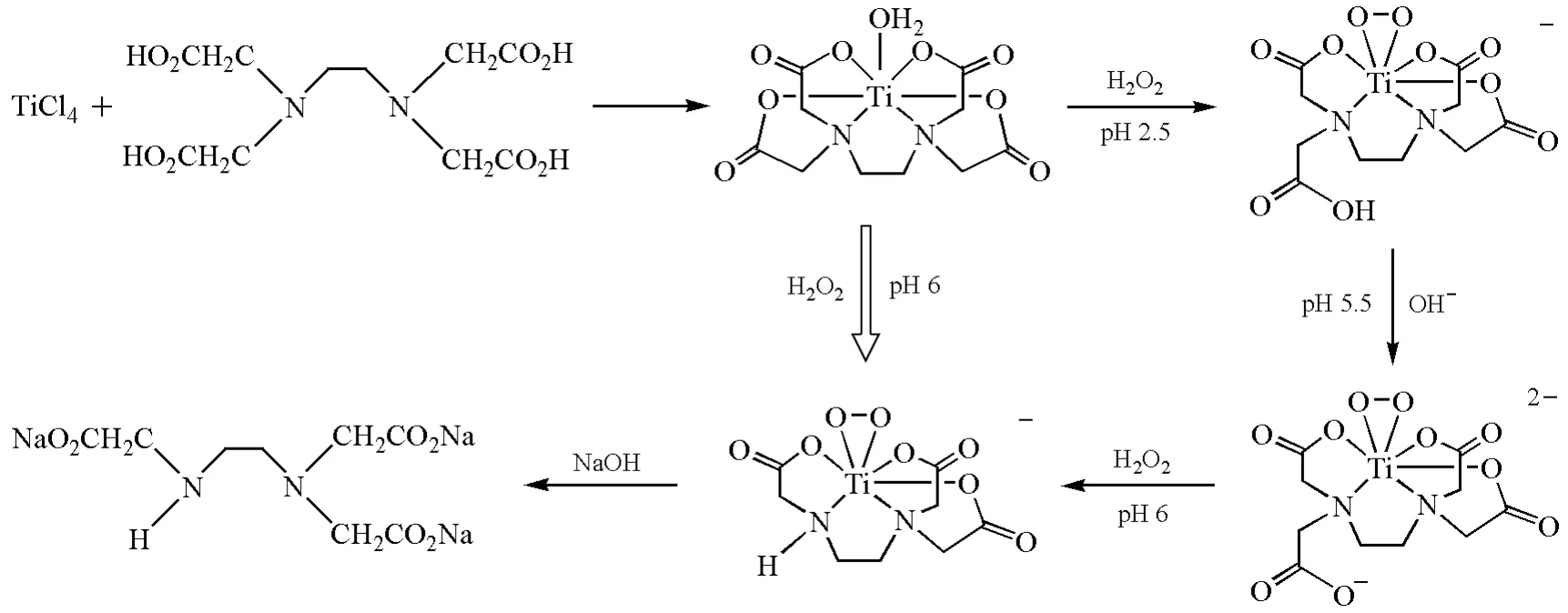
图5 过氧钛乙二胺四乙酸制备乙二胺三乙酸的反应途径[14-15]

图6 固氮酶中的铁钼辅基的结构
3 结语
与有机合成中的官能团保护不同,配位反应中的物种保护并不特别普遍,这主要是由于配位键与共价键相比要弱,使得相应的基团保护和去保护反应容易产生其他的转化反应。但当形成螯合物或配位聚合物后,多齿螯合和配位聚合物框架的形成增强了被保护物种的稳定性,因而表现出一些独特的反应性。配位反应的物种保护现象既有趣又有用,探索配位反应的物种保护机理,掌握利用好物种保护,可以更好地开拓配位反应的应用。
[1]Greene T W,Wuts T W.有机合成中的保护基.华东理工大学有机化学教研室译.上海:华东理工大学出版社,2004
[2]武钦佩,李善茂.保护基化学.北京:化学化工出版社,2007
[3]Shing T K M,Tusi H C,Zhou Z H.J Org Chem,1995,60:3121
[4]Chen H B,Chen L,Huang P Q,et al.Tetrahedron,2007,63:2148
[5]朱龙观.高等配位化学.上海:华东理工大学出版社,2009
[6]McCleverty J A,Meyer T J.Comprehensive Coordination Chemistry.Vol.1-10.2nd ed.Boston:Pergamon,2004
[7]Chen X M,Tong M L.Acc Chem Res,2007,40:162
[8]Zang H Y,Lan Y Q,Li S L,et al.Dalton Trans,2011,40:3176
[9]Meng J X,Lu Y,Li Y G,et al.Cryst Growth Des,2009,9:4116
[10]Zhou Z H,Yang J M,Wan H L.Cryst Growth Des,2005,5:1825
[11]Chen M L,Yang F,Zhou Z H.Polyhedron,2012,47:60
[12]Parker B A,Cullen B A,Gaudette R R.Preparation of Ethylenediaminetriacetic Acid.US Patent,5250728.1993-10-05
[13]Parker B A,Cullen B A,Gaudette R R.Preparation of Ethylenediaminetriacetic Acid.US Patent,5449822.1995-09-12
[14]Zhou Z H,Deng Y F,Liu Q X.Ⅰnorg Chem,2007,46:6846
[15]周朝晖,张华林,刘琼馨.乙二胺三乙酸的制备方法.中国专利,101293846.2008-10-29
[16]Zhou Z H,Hou S Y,Wan H L.Dalton Trans,2004,1393
[17]Hou S Y,Zhou Z H,Wan H L,et al.Ⅰnorg Chem Commun,2003,6:1246
[18]Kim J,Rees D C.Science,1992,257:1677
[19]Einsle O,Tezcan F A,Andrade S L A,et al.Science,2002,297:1696
[20]Spatzal T,Aksoyoglu L,Zhang L M,et al.Science,2011,334:940
[21]Lancaster K M,Roemelt M,Ettenhuber P,et al.Science,2011,334:974
[22]Lee C C,Hu Y L,Ribbe M W.Science,2010,329:642
[23]Hu Y L,Lee C C,Ribbe M W.Science,2011,333:753
[24]Zhou Z H,Zhao H,Tsai K R.JⅠnorg Biochem,2004,98:1787
[25]Chen Q L,Chen H B,Cao Z X,et al.Dalton Trans,2012,41:1202
[26]Zhou Z H,Wang H X,Yu P,et al.JⅠnorg Biochem,2013,118:100
[27]Seefeldt L C,Dance I G,Dean D R.Biochem,2004,43:1401
