从猕猴肝脏组织扩增黄嘌呤脱氢酶/氧化酶基因片段
2013-02-05唐东红罕圆圆罗云王城宽黄英毕正生叶尤松
唐东红,罕圆圆,罗云,王城宽,黄英,毕正生,叶尤松
(1.中国医学科学院北京协和医学院 医学生物学研究所,昆明 650118;2.云南省中医学院,昆明 650200)
黄嘌呤脱氢酶/氧化酶(xanthine dehydrogenase/oxidase,XDH/XO)是一种非特异性需氧脱氢酶,人类的XDH/XO 酶在嘌呤代谢过程中催化嘌呤代谢的最后两步,从黄嘌呤和次黄嘌呤形成尿酸代谢产物终产物尿酸,在尿酸的代谢过程中发挥着重要的作用,是体内核酸代谢中一种非常重要的酶。在生物进化过程中,人类及部分灵长类体内尿酸氧化酶失活[1,2],尿酸成为嘌呤代谢的终产物,它起到组织免受氧化损伤的作用。
XDH/XO 的分布有物种和组织特异性,狗和小鼠心肌内XDH/XO 活性很高,兔和猪心肌内XDH/XO 活性很低,在人体及灵长类动物体内XDH/XO主要分布于肝脏组织,其次为小肠,其余组织例如一些上皮细胞中的含量不足前两者含量的3%[3]。研究证实,高尿酸状态下,XO 活性也增加,血尿酸水平增高,24 h 尿酸排泄量相应增加,持续的高尿酸血症状态可引起组织器官发生相应的病变,诱发痛风性关节炎、痛风性皮下结节、肾结石等疾病,而且血尿酸水平与高血压、冠状动脉粥样硬化、肥胖、脂代谢紊乱、心力衰竭及脑梗死等许多心血管疾病密切相关,增加心血管疾病和糖尿病死亡率[4-6],高尿酸血症和痛风为严重危害人类健康的代谢类疾病,从尿酸代谢途径的各个环节分析,XDH/XO 是尿酸生成过多的高尿酸血症的一个主要发病原因。目前,XDH/XO 抑制剂是治疗高尿酸血症的主要药物之一,如别嘌呤醇(Allopurinol)。但该药物在常规剂量(300 mg)下药效的局限性及较大的临床副作用,在一定程度上限制了别嘌呤醇在治疗高尿酸血症中的应用。近年来,研究者以XDH/XO 为靶点进行了相关研究,发现了一些活性化合物对其有一定的抑制作用,例如Jeongmi 等[7]发现多种中草药混合提取物含有的多酚类和黄酮类能够抑制肝脏XO活性,更多的有效的XO 竞争型抑制剂类药物还有待于进一步研究。为进一步开展高尿酸血症致病机理及开发控制血液尿酸水平的抗高尿酸血症新药,建立体内XDH/XO mRNA 及XDH/XO 蛋白表达水平的监测方法意义重大。
本实验选取由中国医学科学院医学生物学研究所全国医学灵长类研究中心饲养的猕猴的新鲜肝脏组织,进行肝组织总RNA 的提取,参照GenBank:U39487.1 人类hXDH/XO 基因编码序列cDNA 序列作为参考,设计引物,利用RT-PCR 对猕猴XDH/XO 基因进行扩增,并对扩增后所获得的基因片段进行序列分析及生物信息学分析,实验结果可为下一步在猕猴中开展高尿酸血症致病机理研究,抗高尿酸血症新药研发奠定一定的工作基础。
1 材料方法
1.1 实验动物
1 只雄性普通级猕猴,由中国医学科学院医学生物学研究所全国医学灵长类中心提供[SCXK(滇)2010-0003],7.6 kg,8 周龄,实验在中国医学科学院医学生物研究所进行[SYXK(滇)2010-0007]。动物实验由中国医学科学院医学生物学研究所动物实验伦理委员会审查通过,批准号为(2011)-003,同时按照实验动物使用的3R 原则给予人道关怀。
1.2 主要试剂与仪器
Trizol 试剂(invitrogen 公司),PrimeScript RT reagent Kit(大连宝生物工程有限公司),Premix Ex Taq 酶(大连宝生物工程有限公司),DL2000 DNA marker(大连宝生物科技有限公司),梯度PCR 仪(Bio-Rad,USA),SS-325 高压蒸气灭菌箱(Tomy,Japan),PowerPac Basic 电泳仪(Bio-Rad,USA),凝胶成像分析系统(Bio-Rad,USA),ND-1000 紫外分光光度计(DanoDrop,USA)。
1.3 PCR 引物设计与合成
引物设计根据NCBI 提供的人类XDH/XO 核苷酸序列(U39487.1),利用Primer 5.0 软件进行设计,扩增其CDS 区域,所设计的上游引物为:5'-CCTTTTCTGAATCAGGCAGGAGCCC-3,下游引物为:5'-CAGTCGCGGAGCAGGGACAC-3',目的片段大小为683 bp,由大连宝生物科技有限公司合成。
1.4 猕猴新鲜肝脏组织的获得及肝组织总RNA的提取
对猴号为030408305 的猕猴进行肝脏组织活体穿刺,获得少量肝组织,约50 mg。将50 mg 新鲜肝脏组织在液氮中碾磨成粉末后,加入0.5 mL Trizol,充分裂解后加0.2 mL 氯仿,剧烈震荡后置冰上,出现分层后于4℃13 500 r/min离心30 min,转移水相,加等体积预冷异丙醇,放置-20℃1 h 后,于4℃13 500 r/min离心30 min,离心管底可见RNA沉淀。经75%乙醇洗脱后,将RNA 沉淀置于室温自然干燥,用20 μL DEPC 处理水溶解后,于65℃变性5 min,取0.15 μL 总RNA 提取液于1.5%琼脂糖凝胶上电泳,紫外灯下观察28 S 和18 S RNA 条带亮度,分析RNA 的完整性,ND-1000 紫外分光光度计测定A260/A280nm,分析纯度、RNA 浓度。
1.5 RT-PCR
根据PrimeScript RT reagent Kit 逆转录试剂盒操作说明进行。每10 μL 体系中依次加入5 ×PrimeScript Buffer 2 μL,PrimeScript RT Enzyme Mix 0.5 μL,Oligo dT Primer 0.5 μL,Random 6 mers 0.5 μL,总RNA(浓度稀释为500 ng/μL)1 μL,RNase Free dH2O 5.5 μL,逆转录条件为:37℃,45 min,85℃,30 s,4℃,逆转录得到cDNA。以逆转录所获得的cDNA 为模板进行XDH/XO 基因的PCR 扩增:反应体系为25 μL。分别加上、下游引物各1 μL(20 μmol/L)、模板cDNA 5 μL、灭菌去离子水5.5 μL、Premix Ex Tag 12.5 μL。反应条件为:94℃预变性5 min,93℃变性30 s、65.5℃退火30 s、72℃延伸30 s、33 个循环,72℃延伸10 min。扩增产物经1.5%琼脂糖凝胶电泳后,在凝胶影像分析仪下观察所扩增的目的片段。
1.6 目的片段基因的序列测定
将RT-PCR 产物送百泰克生物科技公司测序,测序结果使用ChromasPro 软件进行碱基序列拼接,利用DNAMAN 软件对目的基因核苷酸进行分析。
1.7 基因编码蛋白的生物信息学分析
采用瑞士生物信息学研究所的蛋白分析专家系统SWISS-MODEL(http://swissmodel.expasy.org/)进行蛋白质三维结构建模。利用生物信息学工具interproscan(http://www.ebi.ac.uk/Tools/pfa/iprscan/)对所获得的XDH/XO 核苷酸序列进行基因编码蛋白的生物信息学分析。
2 结果
2.1 猕猴肝脏组织总RNA 的提取
从猕猴新鲜肝脏组织提取的总RNA 进行电泳,结果可观察到见28 S、18 S、5 S 三条带,见图1,说明所提取的总RNA 无降解,可进一步用于后续实验。所提取的总RNA 样品经Nanodrop-1000 超微量核酸测定仪测定,A260/A280nm 值为1.94,介于1.8 ~2.0 之间时,说明纯度较高。

图1 猕猴肝脏组织总RNA 电泳图Fig.1 Electrophoresis of total RNA from the liver tissue of rhesus macaque
2.2 猕猴XDH/XO 基因RT-PCR 检测结果
肝组织的RT-PCR 产物经1.5%的琼脂糖电泳,结果扩增出目的条带,与所设计的片段大小一致,结果见图2。

图2 RT-PCR 电泳结果Fig.2 Result of electrophoresis of the RT-PCR products
2.3 基因测序结果及序列分析
送由上海生物工程有限公司进行单向测序,测序波峰图略。序列共测到683 个核苷酸,编码208个氨基酸,相对分子质量为22 721,包括了1 个编码53 个氨基酸的开放阅读框(ORF),见图3。DNAMAN 对目的基因核苷酸序列与NCBI 报道的人类(Homo sapiens,U39487.1)mRNA 核苷酸序列、小鼠Mus musculus(NM0111723.2)、家鼠Rattus norvegicus(NM 017154.4)、野猪Sus scrofa (JN896312.1)XDH/XO 基因mRNA 核苷酸序列同源性进行同源性比较分析,见图4,其中与人类同源性最高,为95.32%,与小鼠、家鼠、野猪同源性分别为84.94%、84.53%、85.94%。图5 显示了不同物种XDH/XO 基因核苷酸序列系统发生树。
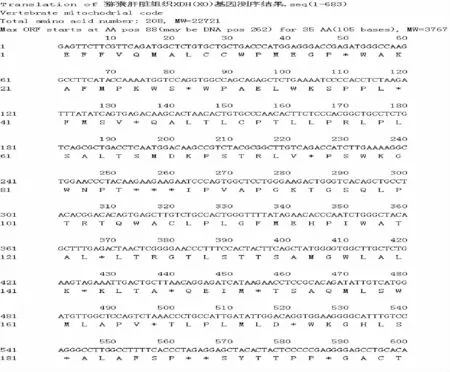
图3 猕猴XDH/XO 基因片段序列测定结果Fig.3 Results of sequencing XDH/XO gene fragments in the rhesus monkey
2.4 SWISS-MODEL 及InterProScan 构建XDH/XO 基因编码蛋白三维结构及预测结构域
图6 显 示SWISS-MODEL(http://swissmodel.expasy.org/)构建XDH/XO 基因编码蛋白三维结构。图7 显 示InterProScan (http://www.ebi.ac.uk/Tools/pfa/iprscan/)预测的结构域功能,结果显示该段XDH/XO 编码蛋白含有醛氧化/脱氢酶的钼喋呤结合点结构域(Aldehyde oxidase/xanthine dehydrogenase molybdopterin binding domain)、黄嘌呤脱氢酶结构域(Xanthine dehydrogenase domain)。
3 讨论
目前研究者已对人、鼠、果蝇、蚊、猫等多种动物的XDH/XO 基因结构进行研究及染色体定位[8-12],绘制出人类XDH/XO(hXDH/XO)基因在位于2p22的一个单基因座上,有报道显示hXDH/XO 基因有三种不同的cDNA 序列[13],小鼠的XDH/XO(mXDH/XO)基因在位于17 号染色体短臂上,与昆虫的XDH/XO(mXDH/XO)基因结构有很大差异。
研究已证实[3],哺乳动物体内该酶主要利用NAD+作为电子受体以黄嘌呤脱氢酶的形式存在,它是XO 的前体,相对无活性,但当组织处于缺血低氧等病理情况下,就可以转化为该酶的另一种形式XO,XO 可利用分子氧作为电子受体,在一定的条件并释放大量的反应性氧代谢物使活性大大提高并催化组织中由于缺氧不能进一步代谢和分解而积聚的黄嘌呤氧化反应,例如组织在低氧状况下的再冲氧,从而产生大量的自由基。自由基对体内细胞膜、DNA、蛋白质均有害[14]。XDH/XO 是由两个催化活性互不依赖的、相同的亚单位组成的同型二聚体,每个亚单位相对分子质量约150 ×103,各含一个活性中心,每个活性中心包括四个活性辅助基团:Mo,FAD,两个Fe/S 丛,XDH 转化成XO 初期发生巯基氧化反应,随后通过巯基反应物处理可逆反应,然后由钙依赖介导从亚单位分子基团裂解成一个相对分子质量约为20 ×103的不可逆反应[3]。从尿酸代谢途径的各个环节分析,XDH/XO 是尿酸生成过多的高尿酸血症的一个主要发病原因。

图4 不同物种XDH/XO 基因核苷酸序列比对分析Fig.4 Alignment of XDH/XO gene nucleotide sequence from different species

图5 不同物种XDH/XO 基因核苷酸序列系统发生树Fig.5 Phylogenetic tree of XDH/XO gene sequences of different species

图6 SWISS-MODEL 模拟XDH/XO 三维结构Fig.6 Three-dimensional structure of XDH/XO simulated with SWISS-MODEL

图7 InterProScan 预测XDH/XO 基因编码蛋白的结构域Fig.7 Prediction of the conserved domain of XDH/XO by InterProScan
本次实验利用RT-PCR 的方法对猕猴新鲜肝脏组织的XDH/XO 基因进行了体外扩增,经过RTPCR 扩增得到的目的片段显示其序列共测到683 个核苷酸,DNAMAN 软件预测该段核苷酸的氨基酸序列包括了1 个编码53 个氨基酸的开放阅读框(ORF),通过与NCBI 报道的人类、小鼠、家鼠、野猪的XDH/XO 基因mRNA 互补的cDNA 核苷酸序列同源性比较分析,结果显示所扩增得到的目的片段与人类同源性最高,为95.6%。目前国内外对猕猴的XDH/XO 基因序列还未见报道,本实验采用RTPCR 参考人类XDH/XO 基因的CDS 区设计引物,并扩增出XDH/XO 基因的cDNA 核苷酸片段。生物信息学分析采用InterProScan 的结构域功能预测结果显示该段XDH/XO 编码蛋白含有醛氧化/脱氢酶的钼喋呤结合点结构域及黄嘌呤脱氢酶结构域,XDH/XO 为同型二聚体,其2 个亚单位均有1 个钼蝶呤辅因子(molybdopterin,Mo-pt)、2 个Fe/S 簇、1个黄素腺嘌呤二核苷酸辅基(FAD),且每个亚基都可独立行使催化功能。在XDH 向XO 转变的过程中,Fe/S 中心和Mo-pt 中心均无明显变化,因此该酶的两种形式均可催化次黄嘌呤向尿酸的转化,由此推测所扩增的该段XDH/XO 基因编码的蛋白可能为酶活性中心。
本文实验结果为进一步利用猕猴进行高尿酸血症致病机理研究及抗高尿酸血症新药研发奠定工作基础。所获得猕猴XDH/XO 基因为进一步研究尿酸相关调节基因的mRNA 水平的定量分析及蛋白表达变化奠定了一定工作基础。
[1]Oda M,Satta Y,Takenaka O,et al.Loss of urate oxidase activity in ominoids and its evolutionary implications [J].Mol Biol Evol.,2002,19(5):640 -653.
[2]Friendman TB,Polanco GE,Appold JC,et al.On the loss of uricolytic activity during primate evolution-I.Silencing of urate oxidase in a hominoid ancestor [J].Comp Biochem Physiol,1985,81B:653 -659.
[3]Sumi S,Wada Y.[Xanthine oxidase (xanthine dehydrogenase)][J].Nihon Rinsho,1996,54(12):3226 -3229.
[4]Chilappa CS,Aronow WS,Shapiro D,et al.Gout and hyperuricemia[J].Compr Ther,2010,36:3 -13.
[5]Puig JG,Martinez MA.Hyperuricemia,gout and the metabolic syndrome[J].Curr Opin Rheumatol.2008,20(2):187 -191.
[6]Luk AJ,Simkin PA.Epidemiology of hyperuricemia and gout[J].Am J Manag Care 2005,11(15 Suppl):S435 -442;quiz S465 -468.
[7]Lee J,An J,Yang HJ,et al.Reparatory and preventive effects of oriental herb extract mixture (OHEM)on hyperuricemia and gout[J].Food Sci Biotechnol,2010,19(2):517 -524.
[8]Xu P,Huecksteadt TP,Harrison R,et al.Molecular cloning,tissue expression of human xanthine dehydrogenase [J].Biochem Biophys Res Commun,1994,199(2):998 -1004.Erratum 1995,215(1):429.
[9]Rytkonen EM,Halila R,Laan M,et al.The human gene for xanthine dehydrogenase (XDH)is localized on chromosome band 2q22[J].Cytogenet Cell Genet,1995,68(1 -2):61 -63.
[10]McManaman JL,Shellman V,Wright RM,et al.Purification of rat liver xanthine oxidase and xanthine dehydrogenase by affinity chromatography on benzamidine-sepharose [J].Arch Biochem Biophys,1996,332(1):135 -141.
[11]Coleman M,Hemingway J.Amplification of a xanthine dehydrogenase gene is associated with insecticide resistance in the common house mosquito Culex quinquefasciatus[J].Biochem Soc Trans,1997,25(3):526S.
[12]Saksela M,Raivio KO.Cloning and expression in vitro of human xanthine dehydrogenase/oxidase[J].Biochem J,1996,315(Pt 1):235 -239.
[13]Poss WB,Huecksteadt TP,Panus PC,et al.Regulation of xanthine dehydrogenase and xanthine oxidase activity by hypoxia[J].Am J Physiol,1996,270(6 Pt 1):L941 -946.
[14]Kayyali US,Donaldson C,Huang H,et al.Phosphorylation of xanthine dehydrogenase/oxidase in hypoxia [J].J Biol Chem,2001,276(17):14359 -14365.
