氯气回收中的次氯酸钠密度测量计算的分析
2013-01-29覃德光
覃德光
(唐山氯碱有限责任公司,河北 唐山063305)
唐山三友氯碱有限责任公司废氯气回收采用稀NaOH 吸收的方法,废氯气通过氢氧化钠2 次回收,回收尾气放空,生成的次氯酸钠作为商品出售。在实际控制中,氢氧化钠的浓度是预先配置好的,由于废氯气的流量是不可控制的, 需测定氢氧化钠溶液中溶质的反应情况。
1 同一浓度时氯气与碱液反应密度计算
取¢=100 mm H=1 000 mm 圆管道计算。 设配制的NaOH 溶液的质量分数为11.92% , 查表得20 ℃时的密度为1.13 g/cm3。则圆柱液体体积为:V=3.14×52×100=7 850 cm3,由W=ρV 得:圆柱中NaOH 溶液的重量为:W=1.13×7 850=8 870.5(g),则溶液中NaOH 的量为8 870.5×11.92%=1 057.363 6(g)。则溶液中H2O 的量为:8 870.5-1 057.363 6=7 813.136 4(g)。
通入Cl2后,假使后NaOH 完全反应,生成物如下:

反应后的总质量为7 813.136+773.2+984.67+237.91=9 808.916(g),总体积变为7 850+237.91=8 087.91(cm3),溶液密度为ρ=W/V=9 808.916/8 087.91=1.212 8(g/cm3)。
通入Cl2后假使有25%NaOH 参与反应,则生成物如下:
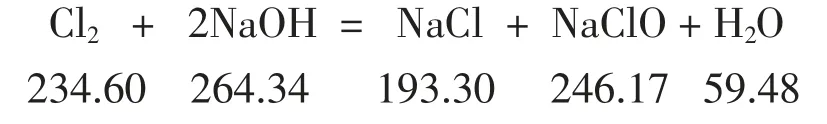
反应后的总质量为:7 813.136+193.3+246.17+59.48+793.022=9 105.11(g),总体积变为7 850+59.48=7 909.48(cm3),溶液密度为W/V=9 105.11/7 909.48=1.151 2(g/cm3)。
通入Cl2后,假使有50%NaOH 参与反应,生成物如下:

反应后的总质量为7 813.136+386.60+492.33+118.95+528.68=9 339.696 (g), 总体积变为7 850+118.95=7 968..95(m3),溶液密度为W/V=9 339.696/7 968.95=1.172(g/cm3)。
通入Cl2后,假使有75%NaOH 参与反应,生成物如下:

反应后的总质量为7 813.136+579.9+738.5+178.43+264.34=9 574.306(g),总体积变为7 850+178.43=8 028.43(cm3),溶液密度为9 574.306/8 028.43=1.192 5(g/cm3)。
依次类推计算可得出见表1。

表1 配制的NaOH溶液的百分比浓度为11.92%时的计算结果
绘制曲线图如下:

同样,可以算出当配制的NaOH 浓度为15.09%时,反应百分比与密度表的关系,见表2。

表2 NaOH浓度为15.09%时的计算结果
绘制曲线图如下:
2 NaOH 配制浓度不同时的反应液密度计算
配制NaOH 为不同浓度时, 百分之百反应后液体密度计算结果见表3。

表3 不同浓度NaOH时,完全反应后的液体密度
绘制曲线图如下:

从以上计算可以看出,相同NaOH 起始浓度时,溶液密度随NaOH 与Cl2反应百分数成线性关系,由P=ρg H 可知,当保持液位不变时,可以用差压变送器通过测量差压变化的办法来确定NaOH 是否反应完成。然而,当NaOH 原始配制浓度不同时,其起始差压和差压变化范围均不同, 其浓度变化范围与溶液起始密度关系见表4。 (液位保持1 m 距离不变)。
从表4 可以看出, 随着NaOH 溶液起始浓度的增加,反应完成后溶液密度差增加,同时,相同高度下用差压变送器测量差压△P=△ρg H 时的变化范围也增加,又由于不同起始NaOH 浓度密度不同,在相同高度下起始差压不同,这时,差压变送器的零点不同,量程选择也不同,为测量准确,必须使每次配制的NaOH 溶液浓度相同,变送器零点才能稳定,变送器量程选择才符合要求。当液柱高度变化后,不同浓度下的差压变化范围又将不同,因此,必须根据实际设备情况确定,当然,实际液柱高度越高,相同起始浓度下其压差变化越大,对密度变化测量越有利。

表4 NaOH配制浓度与反应完成密度的关系
3 NaOH 反应完成后的情况分析
同样取¢=100 mm H=1 000 mm 圆管计算,设配置的NaOH 溶液的百分比浓度为11.92% ,通过上述计算得,反应完成后溶液密度为9 808.916/8 087.91=1.212 8(g/cm3)。 其体积增加了,假使氯气与碱反应生成氯化钠, 次氯酸钠时溶解体积变化不计, 取与该起始浓度下与烧碱完全反应的氯气量的10%作过量计算,结果如下:

反应后的总质量为7 813.136+773.2+984.67+237.91+48.24+69.39-23.79=9 902.75(g),总体积变为7 850+237.91-23.79=8 064.12(cm3),溶液密度为9 902.75/8 064.12=1.228 0(g/cm3)。由计算可知,其密度继续增加。同样方法可得出不同起始浓度时,氯气10%过量反应时的密度,见表5。
从上图可以看出,该密度曲线斜率变低,虽然溶液密度继续增加,但变化速率变缓。如果废氯气流量相对稳定, 仪表测量记录曲线显示在100%反应处出现拐点。
4 测量误差分析
通过上述分析, 用微差压变送器测量次氯酸钠密度,达到控制反应进程的目的是可行的。通过上述

表5 氯气过量10%时,NaOH配制浓度与密度的关系

绘制图形如下:计算,发现测量精度的影响因素。
(1)次钠与氯化钠反应过程中的溶解体积变化,在计算中被忽略。
(2)由于溶液密度与温度有关,当温度变化时,由于密度变化将引起误差, 特别是起始配制时的温度与反应后的温度不可能完全一致, 可以通过不同温度时的同种溶液的密度比较得出误差。 实际控制过程中可以通过假使反应温度的办法, 用反应后温度下的NaOH 密度作为起始密度计算。
(3)由于NaOH 浓度不同,溶液密度不同,反应完成后吸收的氯气量均不同,引起的差压变化不同,所以,必须考虑起始NaOH 浓度变化。
5 结语
用差压变送器测量氯气与氢氧化钠溶液反应过程中的密度,达到控制反应进程的目的,理论上是可行的,希望通过本文的介绍,能够解决次钠生产中的控制问题,以提高生产的自动化水平。
