地榆中α-葡萄糖苷酶抑制活性因子的筛选
2013-01-28陈丽华潘自红曹云丽马庆一
陈丽华,潘自红,曹云丽,马庆一
(平顶山学院化学化工学院,河南平顶山467000)
据专家预测到2025年全球糖尿病患者将达3 亿[1],而目前糖尿病在中国正处于爆发期,每天以至少3 000人的速度增长,已成为继心血管疾病和脑瘤之后的第三位“健康杀手”,预防和治疗该病已经成为全球医药和食品领域日益关注的研究课题之一。现代医学发现高血糖是引发糖尿病并发症的重要因素,糖尿病并发症又是引起糖尿病死亡率增大的一个重要原因[2],研究还表明,餐后高血糖对心脑血管并发症的发生有着重要的影响,所以降低餐后血糖,是预防糖尿病,减少并发症和降低死亡率的重要措施之一。
食物中碳水化合物等在唾液和胰α-淀粉酶作用下先水解为寡糖,然后经小肠上皮绒毛膜刷状缘上α-葡萄糖苷酶的作用生成单糖再进入血液。这一控制血糖生成的关键酶活性的抑制可以阻滞寡糖水解,延缓糖的吸收,避免血糖的峰值,使其平稳且缓慢地维持在一定水平上[3]。
地榆是中国药典收载的良种药用之一[4],有多种药用价值,能够凉血,止血,抗菌,降糖,解毒,止吐,治疗烫伤等。地榆中含有主要化学成分为多糖,皂甙,鞣质和黄酮等[5]。本研究旨在从中药地榆中分离提取α-葡萄糖苷酶抑制剂活性成分,对所得活性成分的α-葡萄糖苷酶抑制活性和其性质进行初步研究与探讨,其中我们主要考察的特征是:1)抑制强度,以IC50和Ki等参数来衡量;2)与酶的络合机制(是否竞争性);3)稳定性。文中详细阐述和对比了两组分各特征参数的实验结果。这些数值将会成为新产品研发的重要依据,这将为进一步充分研究其构效关系,对发现高效、安全的降低餐后血糖新药物具有重要作用。
1 仪器和试剂
ZFQ85A 旋转蒸发器:上海医械专机厂;80-1 离心沉淀器:上海手术器械厂;TGL-18C 高速台式离心机:上海安亭科学仪器厂;85-2 磁力搅拌器:江苏中大仪器厂;ZF-C 三用紫外灯:上海康禾光电仪器有限公司;756 紫外可见分光光度计:上海分析仪器厂;QYQ 微量移液器:北京表云航空仪表有限公司;α-葡萄糖苷酶:SIGMA;4-硝基苯-α-D-吡喃葡萄糖苷(PNPG):E.Merck 公司;对硝基苯酚(PNP):仪征市鼎信化工有限公司;APD-600 大孔树脂:西安树脂厂;地榆:郑州中药城;拜糖平:郑州药店;其余试剂均为国产分析纯。
2 方法
2.1 地榆中各成分的提取
2.1.1 地榆药材的预处理
将地榆根在不超过40 ℃的烘箱中烘干,粉碎,过40 目筛,备用。
2.1.2 地榆总物质水粗提液的提取
称取地榆粗粉20 g 置于200 mL 蒸馏水中,50 ℃下搅拌提取2 h,趁热抽滤,滤渣再加水160 mL,重复上述操作。所得滤液与上次合并,减压浓缩至100 mL左右,先加入活性炭和硅藻土各5 g,脱色,抽滤,滤液再加聚酰胺树脂15 g 放置过夜。抽滤,滤液浓缩并定容为50 mL,即得总物质,避光,冷藏,待用做组分定性检测及酶动力学测定。
2.1.3 地榆中皂甙的提取
称取地榆粗粉20 g,95%乙醇提取[6],甲醇溶乙醚沉淀初步纯化[7],再用大孔吸附树脂分离纯化[8],将纯组分浓缩至3 mL 为皂甙液,冷藏,待用做组分定性检测及酶动力学测定。
2.1.4 地榆中鞣质的提取[9]
称取地榆粗粉20 g,置于带塞三角瓶内,加入体积比为1 ∶1 丙酮/水混和溶液100 mL,置于暗处,室温冷浸24 h,减压抽滤,滤渣再加入体积比为1 ∶1 丙酮/水混和溶液80 mL 重复上述操作,合并两次的滤液,滤液用石油醚萃取2 次~3 次,再用二氯甲烷萃取2 次~3次,萃取后的水相中加入4%的明胶,离心,上清液中继续加入4%的明胶直至无白色沉淀生成,离心,合并离心后的沉淀物。沉淀用体积比为1 ∶1 丙酮/水混和溶液50 mL 浸提,浸提时控制水浴温度于30 ℃~40 ℃之间,重复3 次~4 次,将浸提液减压浓缩除去丙酮,浓缩时严格控制温度不超过40 ℃,浓缩后高速离心(9 000 r/min),所得液体应澄清透明,少量水溶解,待检测确认其成分。
2.1.5 地榆中多糖的提取[10]
称取地榆粗粉20 g,用95%乙醇200 mL 加热回流2 h,趁热抽滤,滤渣再用95%乙醇160 mL 加热回流2 h,趁热抽滤,滤渣用水160 mL 在50 ℃~60 ℃水浴下搅拌提取2 h,趁热抽滤,滤渣再用水120 mL 在同条件提取2 h,趁热减压抽滤,合并两次滤液,减压浓缩,浓缩后的滤液中加入聚酰胺脱色过夜,减压抽滤,真空浓缩,少量水溶解,避光,冷藏,待进行其组分的定性检测,备用,待进行酶抑制动力学测定。
2.1.6 地榆中黄酮的提取
称取地榆粗粉20 g,用95%乙醇200 mL 加热回流2 h,趁热抽滤,滤渣再用95%乙醇160 mL(加热回流2 h,趁热抽滤,合并两次滤液.将滤液减压浓缩至浸膏状,用100 mL 水溶解,过滤,向滤液中滴加4%的明胶[11],至不再产生沉淀为止。离心,上清液浓缩至少量,用石油醚(100 mL×3)萃取。水层加0.1 mol/L 盐酸调pH 等于1,并加入食盐饱和,用乙酸乙酯萃取,至乙酸乙酯层无黄酮检出,减压浓缩乙酸乙酯层至干,用少量水溶解,即得黄酮提取液,定容,避光,冷藏,待进行其组分的定性检测,备用,待进行酶抑制动力学测定。
2.2 地榆中各提取物的定性检测[12]
检测多糖:α-萘酚试验(Molisch 紫环反应);检测鞣质:三氯化铁试验;明胶试验:香草醛-盐酸试验;检测皂甙:泡沫试验、醋酐浓硫酸试验(Liebrmann Burchard)、氯仿-浓硫酸实验(Tschugaeff);检测黄酮:盐酸-镁粉试验。
2.3 地榆中各成分抑制效果的测定
2.3.1 实验条件的确定和α-葡萄糖苷酶活性的测定[4]
方法1:在带塞的试管中加入3 mL pH6.81 的缓冲液和0.75 mL 的PNPG(2 mmol/L),在37 ℃下保温10 min后,加入15μL 的α-葡萄糖苷酶(酶的浓度为5.0 mg/mL),在37 ℃下分别反应2、4、6、8、10、15 min 后,以4 %Na2CO3终止反应,在400 nm 处测定其吸光度。同时选未加酶的反应液为空白,以消除PNPG 自身水解产生的对硝基苯酚(PNP)对测定波长下吸光度的贡献所造成的偏差。
方法2:在本法中,α-葡萄糖苷酶活性测定实验于室温下直接在比色皿中进行(其它皆与方法1 同),每分钟读一次吸光度值并记录。
2.3.2 拜堂平抑制活性的测定
反应体系组成的设计结果见表1。
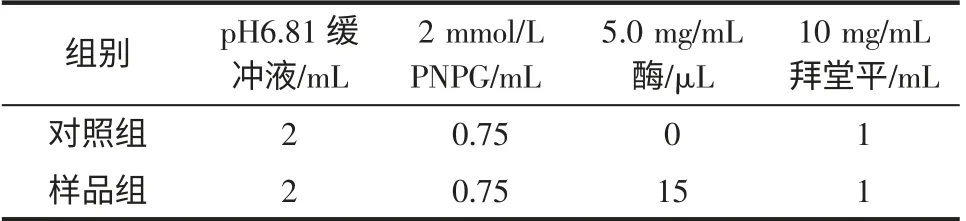
表1 拜堂平抑制活性检测反应体系的组成Table 1 Reactant system for evaluate the effects of Glucobay on the activity of a-glucosidase
将拜堂平、PNPG,缓冲液混合置于比色皿中,静置10 min 后加入15 μL α-葡萄糖苷酶,快速激烈振荡后开始计时,在400 nm 下每分钟读取一次吸光度值,以不加酶的相同混合液为空白,以消除PNPG 和拜堂平本身对吸光度的影响。
2.3.3 地榆中各成分抑制活性的测定
反应体系见表2,操作同2.3.2,以反应15 min 时的吸光值为基准计算各组分的抑制率,并与拜堂平相比较。抑制率计算公式:

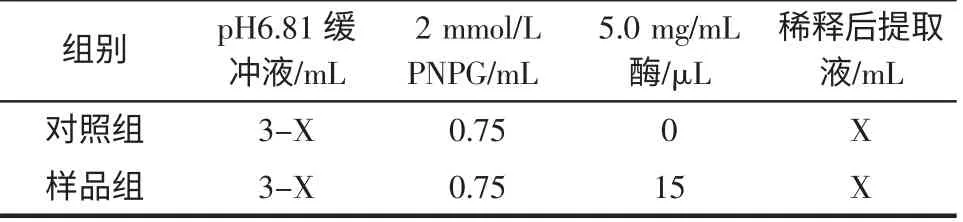
表2 各提取液抑制活性的反应体系Table 2 Reactant system for evaluate the effects of extracts on the activity of a-glucosidase
2.4 抑制剂用量对酶活性的影响
2.4.1 不同浓度地榆黄酮对酶活性的影响
试验设计见表3(每个浓度下都以不加酶的相同混合液作为对照),然后作抑制率-抑制剂浓度图确定最大半抑制浓度IC50[13-14]。
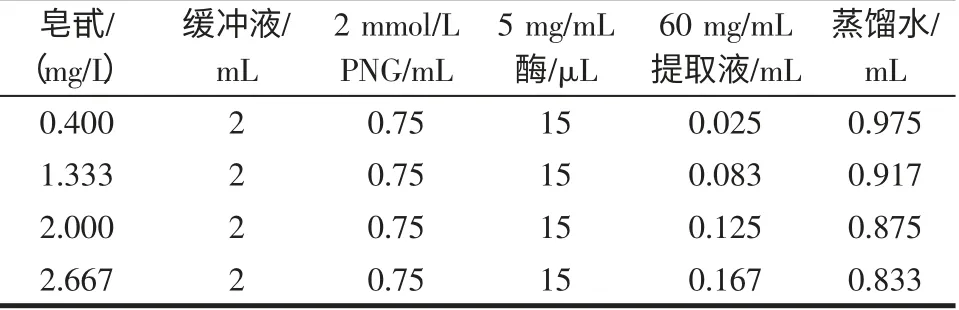
表3 不同浓度黄酮时的反应体系组成Table 3 Reactant system for evaluate the effects of flavone on the activity of a-glucosidase
2.4.2 不同浓度地榆鞣质提取液对酶活性的影响
试验设计见表4(每个浓度下都以不加酶的相同混合液作为对照),然后作抑制剂浓度-抑制率图确定最大半抑制浓度IC50。
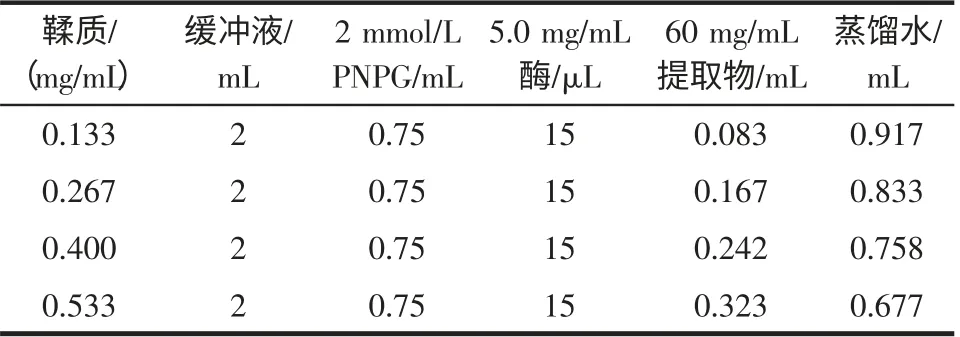
表4 不同浓度鞣质时的反应体系Table 4 Reactant system for evaluate the effects of tanins on the activity of a-glucosidase
2.5 温度对抑制剂活性的影响
先将抑制剂溶液(0.400 mg/mL)分别于40、50、60、70、80、90、100 ℃保温10 min,迅速冷却至室温,然后各取1 mL,与0.75 mL PNPG(浓度为10 mmol/L)和2 mL 缓冲溶液混合(每个温度下都以不加酶的相同混合液作为对照),测定对α-葡萄糖苷酶的抑制活性[15]。每个温度下都以不加酶的相同混合液作为对照,测定对α-葡萄糖苷酶的抑制活性[5]。
2.6 抑制剂的抑制动力学试验
2.6.1 α-葡萄糖苷酶的抑制动力学试验
改变底物浓度,在400 nm 下测定不同底物浓度(0.25、1.00、2.00、2.50、3.075、5.00 mmol/L) 时 酶 的 活性,保证反应总体积和酶用量不变,且每个浓度下都以不加酶的相同混合液作为对照),可得到一系列不同底物浓度条件下的酶活力,按Lineweave-Burk 作图法,求出米氏常数[16]。
2.6.2 地榆中黄酮和鞣质的抑制动力学试验
每种抑制剂选两个浓度,各浓度抑制剂所对应的反应体系见表5(每个底物浓度下都以不加酶的相同混合液作为对照),由系列不同底物浓度条件下的酶活力,按Lineweave-Burk 作图法,确定抑制类型和抑制常数[17-18]。黄酮终浓度分别选择为1.333 mg/mL 和2.667 mg/mL,鞣质浓度为0.400 mg/mL 和0.133 mg/mL。
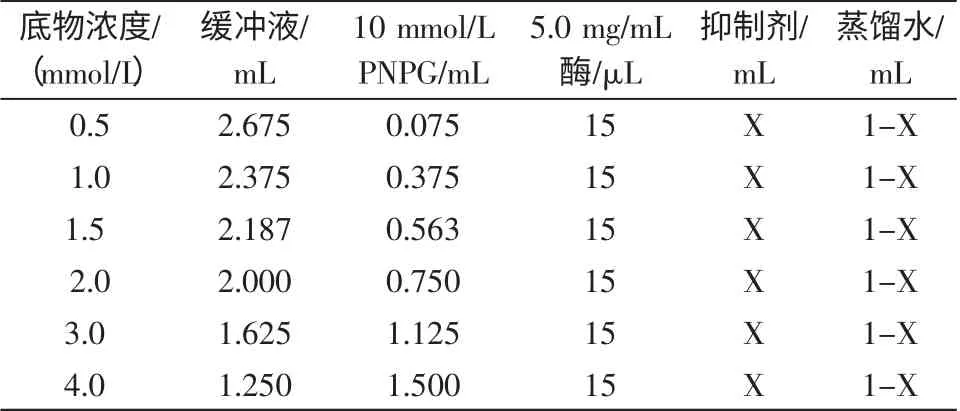
表5 不同浓度底物时山茱萸中皂甙和鞣质抑制动力学试验的反应体系Table 5 Reactant system for evaluate the effects of different tannin and flavone concentrationes on the activity of a-glucosidase under different concentrations of substrate
3 结果和分析
3.1 提取率
从地榆中提取、分离并部分纯化得到水粗提物、多糖、黄酮、鞣质、皂甙。各组分的得率分别为1.45%、1.27%、1.06%、0.87%、0.88%。
3.2 各提取物的定性检测
地榆中各组分的定性检测结果如表6 所示。

表6 地榆各组分的定性检测结果Table 6 The results of qualitative test for inhibitors extracted from Sanguisorba officinalis
尽管水提总物质并无必要总是等于各组分得率之和,事实上中草药水粗提液的得率常小于各组分得率之和,这是由于某些组分中还有非水溶性物质的存在。但与水溶性组分相比,地榆水粗提物的得率仍然偏低,这主要是脱色过程中的严重损失造成的。
3.3 实验条件的确定和α-葡萄糖苷酶活性的测定
分别计算37 ℃和室温26 ℃下测得的吸光度随时间的变化数值,并共同绘制成A-t 曲线,如图1。
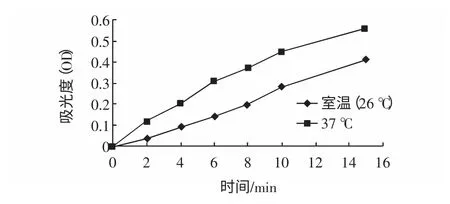
图1 两种温度下A-t 曲线图Fig.1 The absorb value curves depending on time at different temperatures
从图1 中可以看出,虽然在两个温度下吸光度在某一特定时间点的数值以及其随时间变化曲线的斜率均随温度的升高而增加,但两曲线的形状和变化趋势十分相像(即在同样的时间点上完成从直线到上翘弧线至平台的过渡),仅有的差别是绝对数值的不同,因此可以将传统的Tremblay[19]测定法改为在室温下比色皿中直接测定。
3.4 各组分对α-葡萄糖苷酶活性的作用效果及其与拜堂平的比较
底物浓度为2 mmol/L,各成分浓度均为0.400 mg/mL时各成分与酶作用的结果,绘制吸光度与时间的关系见图2。
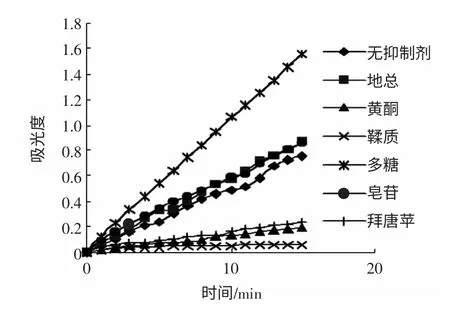
图2 各成份对酶作用的时间与吸光度曲线图Fig.2 The absorb value curves depending on time of all αglucosidase inhibitors extracted from Sanguisorba officinalis
从图2 中可看出,地榆多糖对α-葡萄糖苷酶有激活作用(本实验暂不作详细探究),地榆水粗提物和皂甙提取液有些许激活作用,而黄酮和鞣质具有显著的抑制效果。以第15 分钟的吸光度计算抑制率,结果如图3 所示。
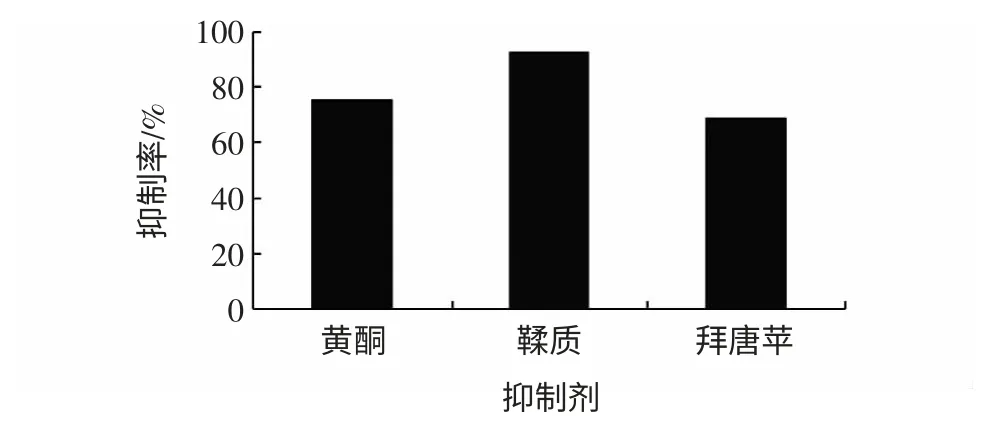
图3 不同抑制剂的抑制率Fig.3 The inhibit ratio of all α-glucosidase inhibitors extracted from Sanguisorba officinalis and Acarbose
由上述的实验结果说明:1)地榆黄酮和鞣质的抑制率分别为75.10%和92.23%(浓度为0.400 mg/mL),高于拜唐苹(2.667 mg/mL 时的抑制率68.51%);2)地榆多糖具很强的激活作用,皂甙提取液有些许的激活作用;3)总物质水提液有些许的激活作用,这是因为它主要含有升糖活性的多糖。
3.5 抑制剂性质的研究
3.5.1 地榆黄酮、鞣质不同浓度对酶活性的影响
选用底物浓度为2 mmol/mL,反应时间15 min 为基准。测定不同浓度的地榆黄酮与酶反应液的吸光度,从而计算出浓度分别为0.400、1.333、2.000、2.667 mg/mL时的抑制率分别为:75.10%、81.03%、92.09%、96.97%,作抑制率-抑制剂浓度图,如图4 所示。
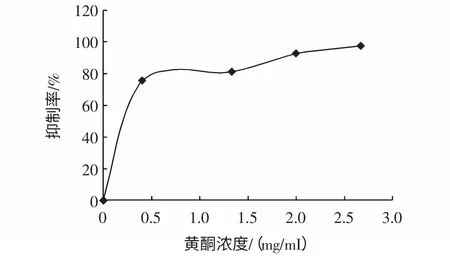
图4 黄酮浓度-抑制率图Fig.4 Inhibitory ratio depending on the concentrationes of flavones
选用底物浓度为2 mmol/mL,反应时间15 min 为基准。测定不同浓度的黄酮鞣质与酶反应液的吸光度,从而计算出浓度分别为0.133、0.267、0.400、0.533 mg/mL 时的抑制率分别为:91%、92.36%、93.28%、94.33%。作抑制率-抑制剂浓度图如图5 所示。
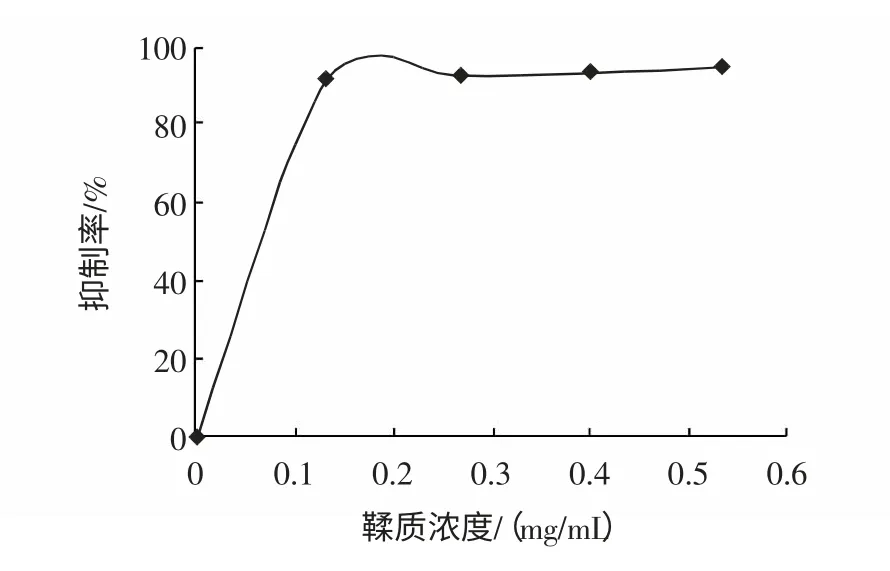
图5 鞣质浓度-抑制率图Fig.5 Inhibitory ratio dependingonthe concentrationes of tanins
从图4 中可看出,黄酮随着抑制剂用量的增加,其抑制活性也不断提高,当达到2.000 mg/mL 时,黄酮抑制剂的用量已处于“饱和状态”,其继续增加无助于抑制活性的增强。并从图求出最大半抑制浓度IC50=0.266 mg/mL。从图5 可知,鞣质随着抑制剂用量的增加,其抑制活性也不断提高,当达到0.267 mg/mL 时,鞣质抑制剂的用量已处于“饱和状态”,其继续增加无助于抑制活性的增强。并从图中求出最大半抑制浓度IC50=8.13×10-2mg/mL。
3.5.2 温度对抑制剂活性的影响
温度对抑制剂活性的影响的结果见图6。
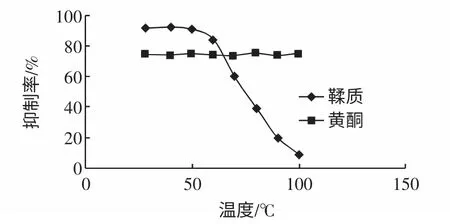
图6 温度对抑制剂活性的影响Fig.6 Effect of temperature on inhibitory ratio of tannins and flavones
由图6 发现黄酮的抑制活性不随温度的改变而发生变化,即使在100 ℃下仍有明显的抑制活性,证明此抑制剂在30 ℃~100 ℃范围内稳定。鞣质的抑制活性在50 ℃以下稳定,在50 ℃以上随温度的升高而降低,这是由于鞣质对温度不稳定,在高温下会使鞣质严重氧化、降解或缩聚,从而影响其抑制效果。
3.5.3 抑制剂的抑制动力学试验
3.5.3.1 α-葡萄糖苷酶的抑制动力学试验
不同底物浓度时酶反应A-t 曲线图(λ=400 nm)如图7 所示。根据图7,以直线部分求各底物浓度下酶反应速度,绘图8 如下所示。
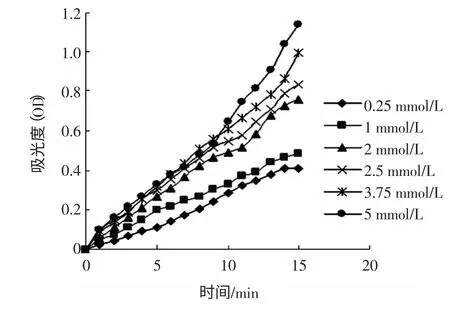
图7 不同底物浓度时酶的A-t 曲线图Fig.7 The absorb curves depending on time when different concentration of pNPG was hydrolyzed by a-glucosidase
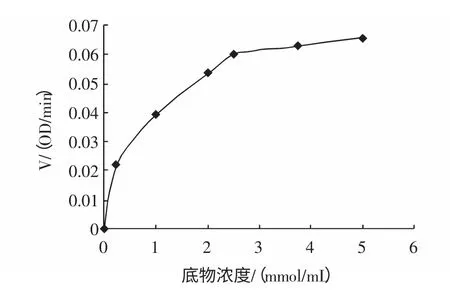
图8 底物浓度与酶反应速度的关系Fig.8 The curves of reaction speed depending on the concentration of substrates
为求Km,首先根据[s]与V 求1/[s]与1/V,所得数值绘图9。
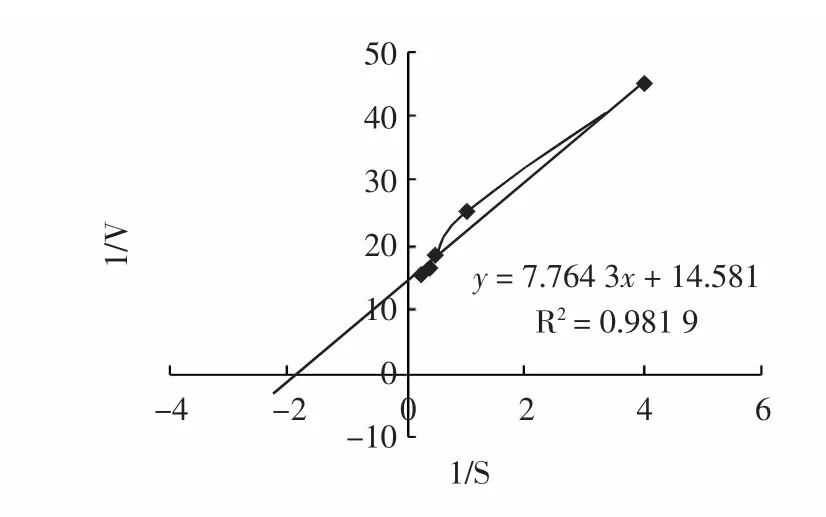
图9 α-葡萄糖苷酶的Lineweave-Burk 的双倒数曲线Fig.9 Lineweaver-Burk curve of α-glucosidase
3.5.3.2 地榆中黄酮的抑制动力学试验
不同底物浓度地榆黄酮浓度分别为1.333、2.667 mg/mL 时的A-t 值分别如图10、图11 所示。
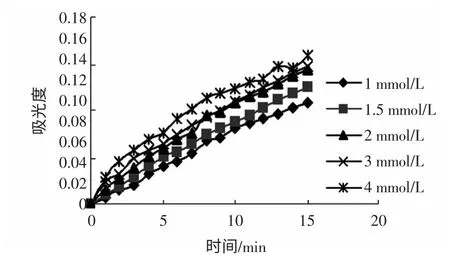
图10 黄酮浓度为1.333 mg/mL 时的A-t 图Fig.10 Absorb curves depending on time for different concentration of substrate when the concentration of flavone is 1.333 mg/mL

图11 黄酮浓度为2.667 mg/mL 时的A-t 图Fig.11 Absorb curves depending on time for different concentration of substrate when the concentration of flavone is 2.667 mg/mL
由图9 所得线性方程y=7.764 3x+14.581 求出其在y轴上的截距为1/Vmax=14.581,则Vmax=0.068 6 OD/min,在x 轴上的截距为-1/Km=-1.878,Km=0.532 mmol/L。Km是酶催化反应的一个重要常数,它反映底物和酶结合的亲和力,Km 值越小,说明酶与底物的亲合力越大。由图10 和图11,并以直线部分求速度,得出两种抑制剂浓度下S-V 图,如图12。
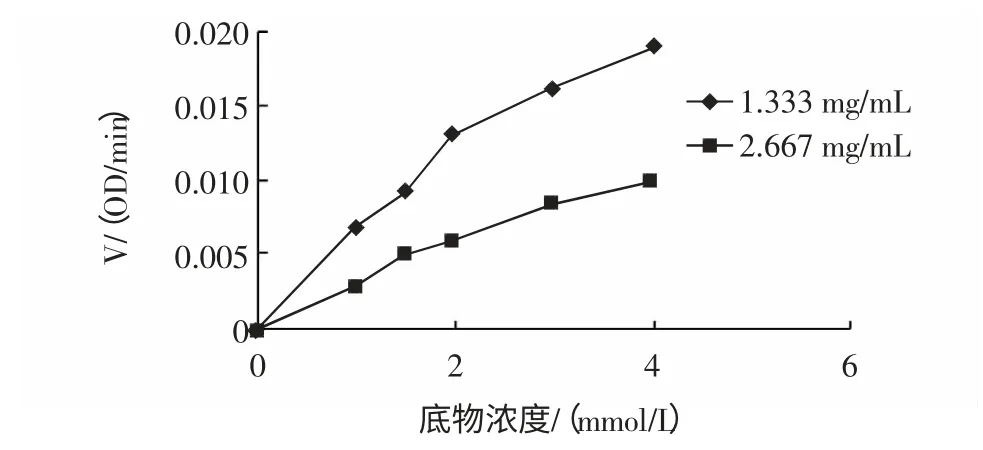
图12 两种抑制剂浓度下S-V 图Fig.12 Reaction speed depending on the concentrations of substrates under two concentrations of flavone
根据[s]与V 求1/[s]与1/V,由1/[s]与1/V 所得数值绘图得图13。

图13 地榆黄酮的Lineweave—Burk 的双倒数曲线Fig.13 Lineweaver-Burk curve of flavone
从图中求得地榆黄酮浓度为1.333 mg/mL 时Km′=9.09 mmol/L,浓度为2.667 mg/mL 时Km′=20.79 mmol/L,再根据α-葡萄糖苷酶的Km=0.532 mmol/L 和Vmax=0.068 6 OD/min,可求出黄酮浓度为1.333 mg/mL 时Ki=0.082 9 mg/mL,浓度为2.667 mg/mL 时Ki=0.070 1 mg/mL。由于实验中存在一些误差,Ki并不完全相等,取两个浓度下Ki的平均值,得黄酮的Ki=0.076 5 mg/mL。
3.5.3.3 地榆中鞣质的抑制动力学试验
不同底物浓度,地榆鞣质浓度分别为0.133 和0.400 mg/mL 时的A-t 值分别如图14 和图15 所示。
由图14 和图15,并以直线部分求速度,得出两种抑制剂浓度下S-V 图如下图16。
根据[s]与V 求1/[s]与1/V,由1/[s]与1/V 所得数值绘图得图17。
从图17 中求得鞣质浓度为0.133 mg/mL 时Km′=3.12 mmol/L,浓度为0.400 mg/mL 时Km′=6.73 mmol/L,再根据α—葡萄糖苷酶的Km= 0.532 mmol/L,Vmax=0.068 6 OD/min,可求出鞣质浓度为0.133 mg/mL 时Ki=0.027 4 mg/mL,浓度为0.400 mg/mL,Ki=0.034 4 mg/mL。由于实验中存在一些误差,取两个浓度下Ki 不完全相等,取其平均值,得鞣质的Ki=0.030 9 mg/mL。
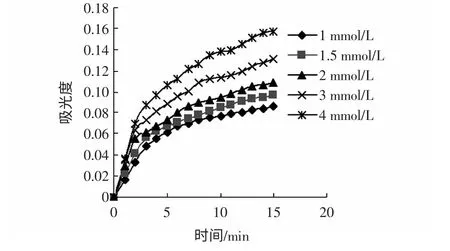
图14 鞣质浓度为0.133 mg/mL 时A-tFig.14 Absorb curves depending on time under different concentration of substrate when the concentration of tanins is 0.133 mg/mL
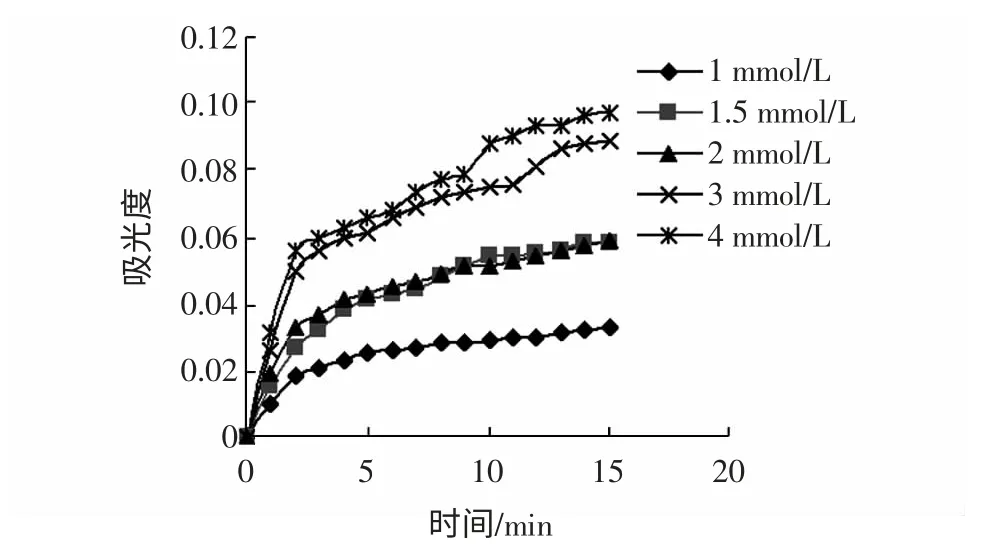
图15 鞣质浓度为0.400 mg/mL 时A-tFig.15 Absorb curves depending on time under different concentration of substrate when the concentration of tanins is 0.400 mg/mL
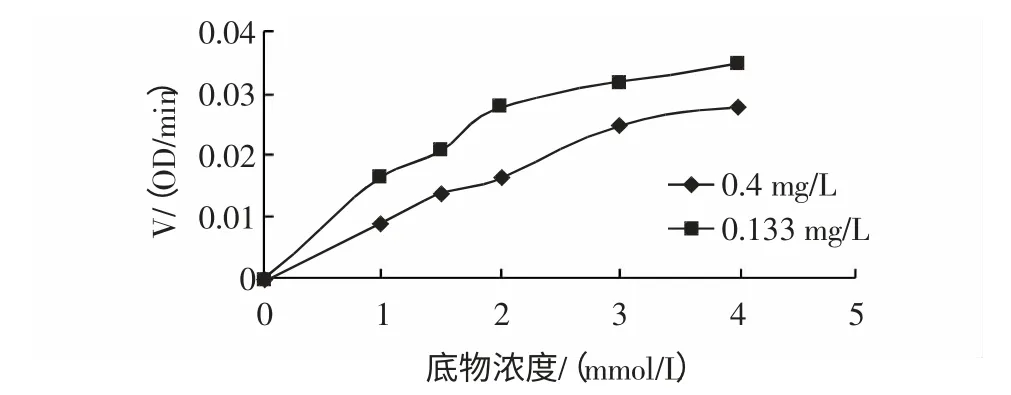
图16 两种抑制剂浓度下S-V 图Fig.16 Rreaction speed depending on the different concentrations of substrates under two concentrations of tanins

图17 地榆鞣质的Lineweave—Burk 的双倒数曲线Fig.17 Lineweaver-Burk curve of tanins
4 结论与展望
1)地榆提取分离并部分纯化后得到水溶性总物质、多糖、鞣质、皂甙和黄酮,其得率分别为1.45 %、1.27%、0.87%、0.88%、1.06%。
2)地榆黄酮和鞣质是优良的α-葡萄糖苷酶抑制剂,浓度均为0.400 mg/mL,它们的抑制率分别为75.10%和92.23%,而拜唐苹2.667 mg/mL 时的抑制率68.51%,所以地榆提取物黄酮和鞣质的α-葡萄糖苷酶抑制活性均明显高于拜堂平。
3)黄酮和鞣质的抑制效果均随着抑制剂用量的增加而增加,其IC50分别为0.266mg/mL 和8.13×10-2mg/mL。黄酮抑制活性在30 ℃~100 ℃范围内稳定;鞣质的抑制活性在50 ℃以下稳定,在50 ℃以上随温度的升高而降低。
4)黄酮和鞣质的Ki分别为Ki=0.076 5 mg/mL 和0.030 9 mg/mL,它们均属于竞争性抑制剂。
[1] 刘霞,冯长根.酶抑制剂在抗糖尿病药物中的应用研究[J].中国医学杂志,2003,38(2):89-91
[2] Gaster B Hrisch I B.The effects of improved glycemic control on complications in type 2 diabetes[J].Arch Intern Med,1998,158(2):134-141
[3] 李治州,许激扬,陈代杰.氧化葡萄糖酸菌转化制备米格列纯关键中间体[J].工业微生物,2002,32(1):45-48
[4] 原春兰,李宗孝,杨佩云.地榆中熊果酸的提取[J].中国医药工业杂质,2002,33(10):478-479
[5] 秦国伟,陈梅玉,徐任生.地榆化学成分的研究[J].中草药,1991,22(11):483-485
[6] 励建荣,夏道宗.山茱萸中马钱素的提取工艺研究[J].工艺技术,2002,23(20):45-47
[7] 徐勤.鞣质的研究进展[J].华夏医学,2004,17(1):113-115
[8] 朱英,罗永明,付小梅.大孔树脂分离油茶皂甙和黄酮的研究[J].林产化学与工业,1999,19(1):40-42
[9] 沈忠明,殷建伟,袁海波.虎杖鞣质的降血糖作用研究[J].天然产物研究与开发,2004,16(3):220-221
[10] 李平,王艳辉,马润宇.山茱萸多糖提取过程研究[J].北京化工大学学报,2003,30(1):13-16
[11] 刘翀,杨洋.生物类黄酮提取研究进展[J].中外食品,2004(10):22-26
[12] 北京医学院,北京中医学院.中草药成分化学[M].北京:人民卫生出版社,1980:5-300
[13] 吕凤霞.α-葡萄糖苷酶抑制剂的产生菌筛选、性质及其发酵条件优化的研究[J].南京农业大学报,2003,5(6):33-35
[14] Eisaku Tsujii,Makoto Muroi ect.Nectrisine Is a Potent Inhibitor of α-Glucosidases, Demonstrating Activities Similarly at Enzyme and Cellular Levels[J].Biochmical and biophysical research communications,1996,220(2):459-466
[15] 李英,张兰,杨万山,等.α-葡萄糖苷酶抑制剂的筛选和初步研究[J].上海大学学报,2000,6(4):129-132
[16] 王镜岩.生物化学[M].北京:高等教育出版社,2002:216-355
[17] 戚以政,汪叔平.生化反应动力学与反应器[M].2 版.北京:化学工业出版社,1990:89-120
[18] 郭勇,郑穗平.酶学[M].上海:华南理工大学出版社,2000:123-137
