地木耳多糖的抗氧化活性
2013-01-28汤俊胡征宇
汤俊,胡征宇
(1.常熟理工学院生物与食品工程学院,江苏常熟215500;2.中国科学院水生生物研究所,湖北武汉430072)
正常情况下,机体的抗氧化系统可以精确的调控自由基的产生和清除,使之处于动态平衡中,但很多因素,如辐射、污染以及机体健康状态等都可以影响或打破这个平衡,使机体内的自由基过量积累而造成伤害,如引起脂质过氧化而改变生物膜结构及功能、损伤DNA、使蛋白质变性及酶活力丧失等,这些危害都直接或间接的导致了炎症、衰老、心血管疾病及肿瘤的发生[1-2]。
研究证明,一些来源于高等植物或藻类的天然化合物,特别是天然多糖,具有优良的抗氧化活性[3-4],在预防心脑血管疾病、癌症以及帕金森氏症等神经退行性疾病方面起着非常重要的作用,因此寻找新的安全、有效、经济的天然抗氧化剂成为人们关注的热点[5-7]。
地木耳,学名为普通念珠藻(Nostoc commune),隶属蓝藻门念珠藻属,是一种分布很广的食用念珠藻。地木耳富含有多种人体所必需氨基酸、微量元素和维生素,而且蛋白质的含量高,具有很高的保健价值。本文采用体外清除超氧自由基、羟自由基、脂质自由基及对人胚肾细胞293 的超氧化歧化酶(SOD)、过氧化氢酶(CAT)和谷胱甘肽过氧化物酶(GPx)活性的影响等模型来评价其多糖的抗氧化活性,以期为地木耳的功用开发提供数据支持和理论参考。
1 材料与方法
1.1 多糖提取物的制备
地木耳藻体粉碎后用80%乙醇浸泡24 h,索氏提取器提取至浸出液无色。藻体悬于蒸馏水中,95 ℃水提3 h,收集上清液,浓缩后加乙醇得絮状沉淀,离心收集并用乙醇和丙酮重复洗涤3 次,冷冻干燥,得多糖提取物。
1.2 清除超氧阴离子自由基
采用氮蓝四唑还原法测定提取物对超氧自由基的清除作用。超氧自由基由还原性辅酶I/吩嗪硫酸甲酯体系产生[8]。反应体系:Tris-HCl 缓冲液(20 μmol/mL,pH 8.0)中,含有还原性辅酶I,吩嗪硫酸甲酯,氮蓝四唑以及不同浓度的多糖提取物(2 μg/mL~40 μg/mL)。摇匀,室温反应5 min,于560 nm 波长处测定吸光度值(A)并根据下列公式计算清除率。
清除率= [(A 对照-A 样品)/A 对照]×100%
1.3 清除羟自由基活性测定
羟自由基由Fe3+/H2O2/脱氧核糖体系产生[9]。磷酸缓冲液(20 μmol/mL,pH 7.4)中,包含EDTA、FeCl3·6H2O、抗坏血酸、H2O2、脱氧核糖及不同浓度(6 μg/mL~30 μg/mL)的多糖溶液,37 ℃水浴1 h,加10%三氯乙酸及1%硫代巴比妥酸,沸水浴15 min,测定532 nm波长处吸光值,计算清除率。在不含EDTA 体系中,EDTA 由等体积的磷酸缓冲液代替[10]。
1.4 抑制蛋黄匀浆脂质过氧化活性
采用硫代巴比妥酸法测定[11]。以1.15%的氯化钾稀释成10%的蛋黄匀浆,现配现用。蛋黄匀浆与FeSO4(100 μmol/L),H2O(250 μmol/L)及不同浓度的提取物混匀,加蒸馏水调整体积至1 mL,37 ℃水浴1 h。然后加三氯乙酸(20%,pH 3.5)和硫代巴比妥酸(0.67%)各1.5 mL 并继续水浴15 min。离心取上清液在532 nm处测定光吸收值,计算清除率。
1.5 人胚肾细胞293 抗氧化酶活力的测定
1.5.1 细胞存活率的测定
采用四甲基偶氮唑盐(MTT)微量酶反应比色法测定细胞存活率[12]。人胚肾细胞293(HEK293)以4×104个/孔的密度接种于96 孔板,37 ℃,5%CO2培养箱培养24 h 后加入不同浓度(0.5 μg/mL~30 μg/mL)的多糖提取物。继续培养24、48、72 h。在孵育的最后4 h,加入5 mg/mL 的MTT。孵育结束后,除去MTT 溶液,加入DMSO 以溶解形成的甲瓒颗粒,在570 nm 处测定光吸收值。
1.5.2 细胞SOD,CAT 和GPx 酶的制备及活力测定
将HEK293 细胞接种于细胞培养板。24 h 后,吸除培养液,加入含有不同浓度提取物(1、5、25 μg/mL)的新鲜培养基,继续孵育24 h。细胞经胰酶消化、PBS 清洗,离心后用超声波破碎,14 000 g 离心15 min 收集上清,采用试剂盒测定SOD,CAT 和GPx 的酶活力。
1.6 数据处理
数据用Origin 7.0 处理,数据表示为平均值±标准差,P<0.05 为差异显著。
2 结果
2.1 清除超氧阴离子自由基
在辅酶I 和吩嗪硫酸甲酯体系产生的超氧阴离子自由基的清除实验中,地木耳多糖提取物表现出显著的清除超氧自由基的活性,并且随浓度的升高清除作用增强见图1。
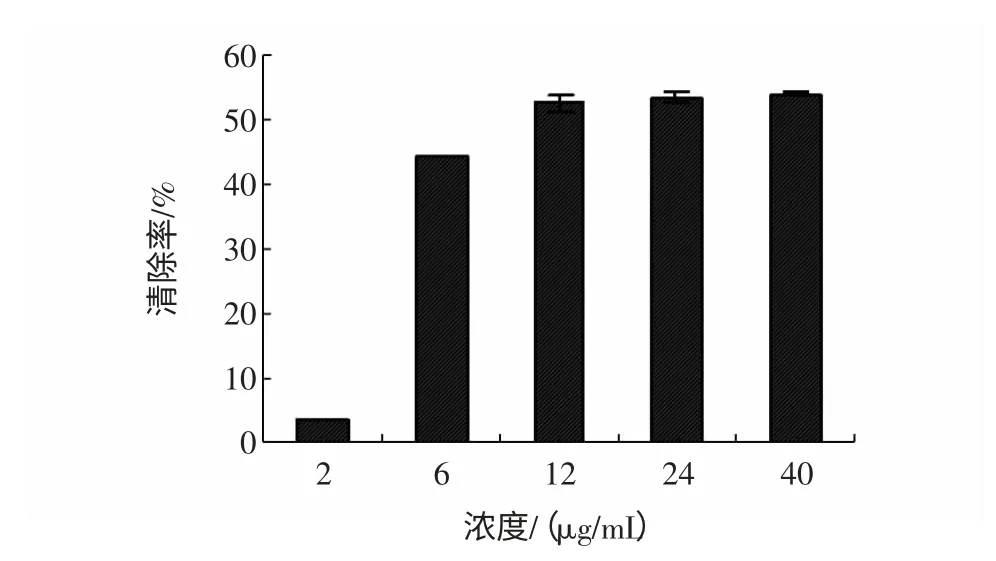
图1 地木耳及多糖提取物清除超氧阴离子自由基Fig.1 Superoxide radical scavenging effect of polysaccharide extracts from N.commune
由图1 可知,在提取物浓度为6 μg/mL 处,清除作用有非常显著的上升趋势,清除率由2 μg/mL 处的3.9%上升到44.1%。随后,随着多糖浓度的升高,清除活性呈现缓慢增强的趋势,在40 μg/mL 时,清除作用达到53.9%。
2.2 清除羟自由基
地木耳多糖提取物清除不同体系产生的羟自由基,见图2。
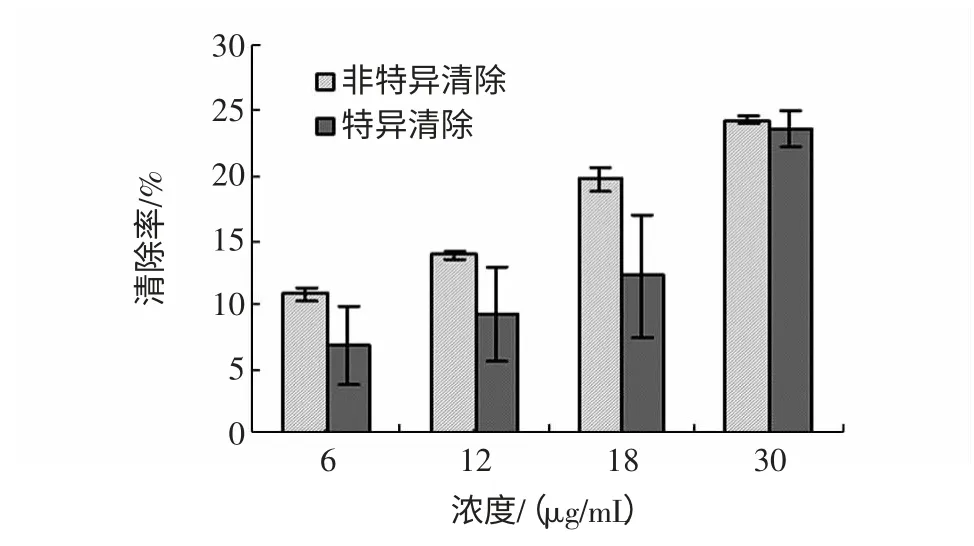
图2 地木耳多糖提取物清除不同体系产生的羟自由基Fig.2 Scavenging effect of polysaccharide extract of N.commune on hydroxyl radical generated in different systems
如图2 所示,地木耳多糖提取物对两个体系产生的羟自由基均具有清除作用且呈现量效关系,最高清除率分别为30 μg/mL 浓度处的23.5%和24.2%。但在6 μg/mL~18 μg/mL 浓度范围内,地木耳多糖提取物对非特异体系产生的羟自由基清除活性明显高于特异体系。
2.3 抑制脂质过氧化
地木耳多糖提取物抑制脂质过氧化,见图3。

图3 地木耳多糖提取物抑制脂质过氧化Fig.3 Inhibition effect on lipid peroxidation of polysaccharide extracts from N.commune
图3 显示,地木耳多糖提取物对蛋黄匀浆作为介质的脂质过氧化有较显著的抑制作用。在10 μg/mL的浓度下,脂质过氧化抑制率为3.7%,作用不显著。但随提取物浓度的升高,清除率显著增强,在100 μg/mL的最高测试浓度下,清除率达到17.4%。
2.4 HEK293 细胞存活率的测定
细胞和不同浓度的多糖提取物共同孵育24、48、72 h,将对照组光吸收值设定为100%,测定细胞存活率,见图4。
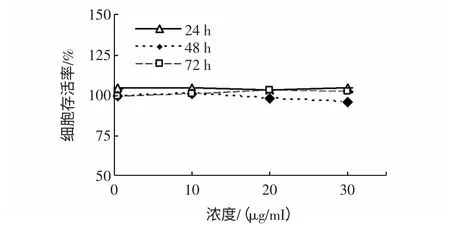
图4 地木耳多糖提取物对人胚肾细胞293 存活率的影响Fig.4 Effect of N.commune polysaccharide extract on the viability of HEK 293cells
如图4 所示,存活率无显著差异,说明提取物对HEK293 细胞没有细胞毒性作用。
2.5 酶活力测定
酶活力测定,见表1。
由表1 可以看出,在1 μg/mL 浓度处,多糖提取物对SOD、CAT、GPx 的酶活力增强作用微弱,但是随着多糖浓度的升高,提取物对酶活力表现出显著的增强作用。 SOD 酶活力在5 μg/mL 浓度处提升最大,为18.9%。CAT 和GPx 的酶活力均在25 μg/mL 浓度处得到最大提高,提高率分别达到31.9%、39.6%。结果表明,地木耳多糖提取物对GPx 和CAT 的酶活力影响要高于对SOD 酶活力的影响。
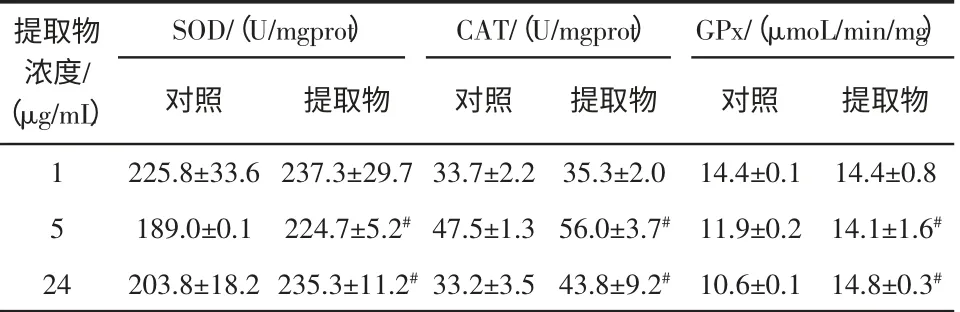
表1 地木耳多糖提取物对HEK293 细胞超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GPx)酶活力的影响Table 1 Effect of N.commune extract on the activities of SOD,CAT and GPx in HEK 293 cells
3 分析与讨论
自从提出衰老的自由基学说以来,大量的研究发现人类的许多疾病都与机体的自由基氧化损伤有关[13]。在寻找抗氧剂的过程中,人们发现微量元素、维生素、中草药、食品的有效成分等均具有清除自由基的作用,而抗氧化多糖因其低毒、安全、来源广等特点备受关注[14-15]。研究发现,多糖的抗氧化活性可能是多糖抗肿瘤、抗病毒、抗感染、抗炎症等其他活性的作用机理之一[16-17]。
超氧阴离子自由基和羟自由基是最具代表性的活性氧自由基。在机体的氧化反应中,超氧阴离子自由基通常最先形成,其本身活性较弱,但可通过形成其他多种有破坏作用的自由基而使其功能放大。羟自由基是毒性最强的自由基,它几乎能与所有的功能性生物大分子起反应,造成生物体的巨大伤害,例如攻击膜质,引发脂质过氧化[18-19]。脂质过氧化则是由于不饱和脂肪酸链的氢被抽掉而引发的特征性链式反应,是导致细胞膜损伤的主要原因。
本实验结果表明,地木耳多糖提取物能有效的清除超氧自由基、羟自由基、抑制蛋黄匀浆过氧化反应,还可显著提高抗氧化酶的活性。
羟自由基的清除活性测定,一般采用位点特异和非特异两个体系。地木耳多糖提取物对位点特异体系产生的羟自由基的清除活性高于非特异体系,分析其原因,可能是由于位点非特异体系中有EDTA 的存在,对体系中的二价铁离起到螯合作用,使羟自由基的产生受到限制。而在位点特异体系中,EDTA 被磷酸缓冲液代替,自由基的生成和提取物对金属离子及对自由基的清除作用都不会受到限制,因而清除率要高于非特异体系。
SOD、CAT 和GPx 是生物体抗氧化酶系统中非常重要的三种酶。一般情况下,它们参与并介导自由基的产生与淬灭,维持体内自由基的正常代谢水平[20]。SOD 催化超氧阴离子发生歧化反应,生成H2O2,而H2O2和其它内源及外源的过氧化物又可被CAT 和GPx 进一步清除。实验结果表明,地木耳多糖提取物可显著提高三种抗氧化酶的活性,有效的降低细胞所受到的自由基的危害。
黄泽波等对念珠藻多糖组分及结构进行了研究并发现,地木耳多糖含有半乳糖、葡萄糖、木糖、海藻糖等组分[21]。这些单糖都是有效的还原剂,其抗氧化作用可能与其组分的还原性质有关。
综上所述,地木耳多糖提取物抗氧化活性显著,可以作为天然抗氧化剂的优良来源。
[1] Luo D, Fang B. Structural identification of ginseng polysaccharides and testing of their antioxidant activities[J].Carbohydrate Polymers,2008,72(3):376-381
[2] Wang Q S,Zhao X Y,He S Z,et al.Differential Proteomics Analysis of Specific Carbonylated Proteins in the Temporal Cortex of Aged Rats: The Deterioration of Antioxidant System[J]. Neurochemical Research,2010,35(1):13-21
[3] Andrea D H, Svenja K, Roland U, et al. Fucoidans and fucoidanases-focus on techniques for molecular structure elucidation and modification of marine polysaccharides[J].Applied Microbiology and Biotechnology,2009,82(1):1-11
[4] Chen B L,You W L,Huang J,et al.Isolation and antioxidant property of the extracellular polysaccharide from Rhodella reticulata[J].World Journal of Microbiology and Biotechnology,2010,26(5):833-840
[5] Cho M L, Chen Y, Sang M K, et al. Molecular characterization and biological activities of watersoluble sulfated polysaccharides from Enteromorpha prolifera[J].Food Science and Biotechnology,2010,19(2):525-533
[6] Didyk N P,Blum O B.Natural antioxidants of plant origin against ozone damage of sensitive crops[J].Acta Physiologiae Plantarum,2011,33(1):25-34
[7] Tang J,Hu Z Y,Chen X W.Free radical scavenging and antioxidant enzymes activation of polysaccharide extract from Nostoc sphaeroides[J]. American Journal of Chinese Medicine,2007,35(5):887-896
[8] Nishikimi M,Appaji N,Yagi K.The occurrence of superoxide anion in the reaction of reduced phenazine methosulphate and molecular oxygen[J].Biochemical and Biophysical,Research Communications,1972,46(2):849-854
[9] Halliwell B, Gutteridge J M, Aruoma O I. The deoxyribose method:A simple "test-tube" assay for determination of rate constants for reactions of hydroxyl radicals[J]. Analytical Biochemistry,1987,165(1):215-219
[10] Sun C,Wang J W,Fang L,et al.Free radical scavenging and antioxidant activities of EPS2,an exopolysaccharide produced by a marine filamentous fungus Keissleriella sp.YS 4108[J].Life Science,2004,75(9):1063-1073
[11] Desmarchelier C,Lisboa R R,Coussio J,et al.Antioxidant and free radical scavenging activities in extracts from medicinal trees used in the'Caatinga'region in northeastern Brazil[J].Journal of Ethnopharmacology,1999,67(1):69-77
[12] Hansen M B,Nielsen S E,Berg K.Re-examination and further development of a precise and rapid dye method for measuring cell growth/cell kill[J]. Journal of Immunological Methods, 1989,119(2):203-210
[13] Parvaiz A,Maryam S,Satyawati S.Reactive oxygen species,antioxidants and signaling in plants[J]. Journal of Plant Biology, 2008, 51(3):167-173
[14] Dhan P, Neeraj K. Cost Effective Natural Antioxidants[J].Nutrition and Health,2011,(4):163-187
[15] Dong C H, Yao Y J. In vitro evaluation of antioxidant activities of aqueous extracts from natural and cultured mycelia of Cordyceps sinensis[J].LWT-Food Science and Technology,2008,41(4):669-677
[16] Schepetkin I A,Quinn M T.Botanical polysaccharides:Macrophage immunomodulation and therapeutic potential[J]. International Immunopharmacology,2006,6(3):317-333
[17] Yazdanparast R, Ardestani A. In vitro antioxidant and free radical scavenging activity of Cyperus rotundus[J]. Journal of Medicinal Food,2007,10(4):667-674
[18] Tseng Y H, Yang J H, Mau J L. Antioxidant properties of polysaccharides from Ganoderma tsugae[J]. Food Chemisty, 2008,107(2):732-738
[19] Wang J, Zhang Q, Zhang Z, et al. Antioxidant activity of sulfated polysaccharide fractions extracted from Laminaria japonica[J].International Journal of Biological Macromolecules,2008,42(2):127-132
[20] Nevcihan G,Cengiz S,Bektas T,et al.Evaluation of antioxidant activities of 3 edible mushrooms: Ramaria flava(Schaef.: Fr.) Quél,Rhizopogon roseolus (Corda)T.M.Fries.,and Russula delica Fr.[J].Food Science and Biotechnology,2010,9(3):691-696
[21] Huang Z,Liu Y,Paulsen B S,et al.Studies on polysaccharides from three edible species of Nostoc(Cyanobacteria) with different colony morphologies: comparison of monosaccharide compositions and viscosities of polysaccharides from field colonies and suspension cultures[J].Journal of Phycology,1998,34(6):962-968
