异甘草酸镁注射液治疗抗结核药物所致急性肝损伤的临床研究
2013-01-14郭新枝陈裕程俊伟陈永芳张晓慧王志刚刘宝琴
郭新枝,陈裕,程俊伟,陈永芳,张晓慧,王志刚,刘宝琴
河南省传染病医院结核科,郑州 450015
结核病是由结核分枝杆菌感染引起的传染病。世界卫生组织(World Health Organization,WHO)估计2011年全世界新发结核病例近870万,每年约140万人死于结核病[1]。直接督导下的短程化疗(directly observed treatment, short-course,DOTS)战略实施16年间挽救了2 000万人的生命,同时也确立了结核病治疗中多药联合的原则[1]。虽然多药联合抗结核疗效显著,但抗结核药物均能引起不同程度、不同频度的不良反应, 如皮疹、胃肠道和神经系统功能紊乱,其中最严重的是药物性肝损害(drug-induced liver injury,DILI)[2-4]。在一线抗结核药物中,异烟肼、利福平和吡嗪酰胺对肝脏都具有潜在的毒性,加上抗结核治疗一般周期较长,不良反应显著降低了患者对治疗的依从性和抗结核治疗的有效性,最终导致治疗失败、复发或耐药出现[4]。因此,针对抗结核药物所致肝损伤的早期有效治疗将有助于保证患者对抗结核治疗的依从性,进一步提高结核病治疗的成功率。
异甘草酸镁的有效成分为单一18-α 异构体甘草酸,是从天然甘草中提取的甘草酸经碱催化异构化后成盐精制而得,具有更强的抗感染、保护肝细胞膜、解毒、抗生物氧化及改善肝功能的作用,临床研究证实其能明显改善病毒性、药物性、酒精性等肝脏急性或慢性炎症的临床症状和肝功能指标[5],但目前该药单独用于治疗抗结核药物所致肝损伤的疗效尚不确切。本研究采用随机、双盲、阳性药平行对照设计,以硫普罗宁注射液为对照,评估异甘草酸镁注射液在治疗抗结核药物引发急性肝损伤中的有效性和安全性。
1 材料与方法
1.1 病例选择
按照结核病诊断标准[6],选取2010年3月~2011年6月我院收治住院的初治肺结核病例中抗结核治疗过程发生肝功能异常者。入选的病例满足以下条件:①年龄18~70岁。②患者在本次抗结核治疗前从未接受任何抗结核药物治疗或抗结核治疗疗程少于1个月。③当前抗结核治疗方案为DOTS方案(2HRZE/4HR,H:异烟肼,R:利福平,Z:吡嗪酰胺,E:乙胺丁醇)。④治疗期间血清丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)、总胆红素(total bilirubin,TBIL)、碱性磷酸酶(alkaline phosphatase,AKP)4项指标中1项或1项以上≥2倍正常上限(upper limit of normal,ULN),但TBIL≤3 ULN。⑤日本消化疾病周(Digestive Disease Week,DDW)药物性肝损伤诊断标准评分>6(由3名专家评分)。⑥肝功能异常持续时间不超过3个月。⑦排除病毒性肝炎、酒精及非酒精性脂肪性肝病、自身免疫性肝病所致肝功能异常。⑧无严重的心、肺、脑、肾、胃肠道及全身系统性疾病。
1.2 治疗方法
两组药物在外观、颜色、澄明度等方面一致,符合双盲试验要求。
1.2.1试验组用药异甘草酸镁注射液,剂量200 mg/d。用法为4支异甘草酸镁注射液(江苏正大天晴药业股份有限公司生产,规格10 ml∶50 mg,批号0910311)和2支生理盐水(2 ml)加入10%葡萄糖溶液或生理盐水250 ml中静脉滴注,每日1次,疗程2周。
1.2.2对照组用药硫普罗宁注射液,剂量200 mg/d。用法为2支硫普罗宁注射液(济南利民制药有限责任公司生产,规格2 ml∶100 mg,批号09060613)和4支生理盐水(10 ml)加入10%葡萄糖溶液或生理盐水250 ml中静脉滴注,每日1次,疗程2周。
1.3 观察与随访
1.3.1病史资料获取研究前记录患者基本资料,包括性别、年龄、职业、体质指数(body mass index,BMI)、既往疾病史、过敏史、既往治疗史、病程、饮酒史(饮酒年限、种类、饮酒量)、合并用药等。同时记录应用可疑药物的资料,包括可疑药物名称、剂量、用法用量、分类、开始及结束用药时间、是否再次用药(包括再次开始及结束用药时间),可疑药物既往是否有引发肝损的报道,研究中是否停用或降低可疑药物的剂量等。
1.3.2实验室检查患者治疗前进行血常规、尿常规、肝功能〔ALT、AST、γ -谷氨酰转肽酶(γ -glutamyl transpeptidase,GGT)、TBIL、结合胆红素(direct bilirubin,DBIL)、总蛋白(total protein,TP)、清蛋白(albumin,ALB)、AKP〕、肾功能、电解质、心电图、腹部B超检查,治疗1周末检查肝功能,治疗2周末进行血常规、尿常规、肝功能、肾功能、电解质、心电图复查。期间同时记录肝功能异常与一次或再次用可疑药物的关系(用药开始至实验室检查异常出现时间、停药至实验室检查异常出现时间、停药至实验室检查恢复正常时间)。治疗期间询问并记录不良反应及合并用药。
1.4 药品编盲与揭盲
本试验为随机、双盲、阳性药物平行对照的临床试验。随机双盲分配表利用SAS软件生成,112例患者随机分入试验组或对照组。由本次临床试验无关人员完成药品分装,其中药品经随机编盲后的药物编号即为患者随机号。分药结束后,盲底一式二份分别密封存放。研究结束后数据全部录入并锁定,由保存盲底人员第1次揭盲,并将数据库交统计分析人员进行统计分析。完成统计分析后,进行第2次揭盲,由统计分析人员写出统计分析报告,交本课题组。
1.5 疗效判断标准
2周治疗完成后,对试验组和对照组进行以下疗效比较。
1.5.1单项疗效对治疗前异常的单项肝功能指标(ALT、AST、TBIL、AKP)分别计算复常率,并按下列标准进行判断,以评估各单项指标的疗效。显效:治疗后肝功能指标复常;有效:治疗后肝功能指标较基线下降≥50%,但未恢复正常;无效:无明显变化或改善未达到以上显效和有效标准者。
1.5.2综合疗效对治疗前异常的肝功能指标(ALT、AST、TBIL、AKP)按下列标准进行判断,以评估综合疗效。显效:治疗前异常的肝功能指标全部复常;有效:治疗前异常的肝功能指标虽未全部复常,但至少有2个指标较基线下降≥50%;无效:无明显变化或改善未达到以上显效和有效标准者。总有效率=(显效例数+有效例数)/总例数×100%(注:对治疗前仅1项肝功能指标异常的患者,不适用上述综合疗效判断标准,以单项疗效代替综合疗效)。
1.6 统计分析
两组均衡性分析包括人口学特征、一般情况及基线情况的比较,计量资料进行t检验,等级资料用Wilcoxon检验,分类资料用χ2检验或精确概率法统计。疗效等级比较用Wilcoxon秩和检验,有效率比较用Fisher确切概率法。安全性评价主要采用描述性统计分析,发生率较高(>10%)的不良事件和不良反应的比较用χ2检验或Fisher确切概率法统计,发生率较低的不良事件和不良反应仅用描述性分析。实验室检查数据主要采用统计描述分析治疗前后的变化情况。所有假设检验采用双侧检验(two-side test)。取α =0.05,P<0.05为有统计学差异。数据管理采用EpiData2.0,采用双份独立输入,核对无误后进行统计分析。统计分析采用SAS9.1.3软件编程分析。
2 结果
2.1 依从性评估
研究共纳入112例合格受试者,按3∶1比例随机分入试验组和对照组。异甘草酸镁注射液试验组(200 mg/d)84例,对照组(硫普罗宁注射液,200 mg/d)28例。失访7例,剔除1例,共完成104例,试验组、对照组失访率(包含剔除)分别为4.76%和14.29%(χ2= 2.872,P=0.09)。试验组平均用药天数为(13.17±1.99)d,对照组为(13.18±2.07)d;两者比较,t=0.027,P=0.979。
2.2 患者基线比较
试验组84例患者中,男51例、女33例,平均年龄( 32.99±12.89)岁;对照组患者28例中,男16例、女12例,平均年龄( 34.71±13.35)岁。饮酒史病例试验组42例(50.00%),对照组15例(53.57%)。用药至发病中位时间试验组为26 d,对照组为12.5 d。两组年龄、性别、饮酒史、既往肝损病史、用药至发病时间均无显著性差异(表1)。
2.3 异甘草酸镁注射液疗效指标评价
2.3.1综合疗效治疗结束时试验组显效、有效、无效百分比分别为46.25%、31.25%、22.50%,对照组结束时显效、有效、无效百分比分别为 16.67%、25.00%、58.33%,两组间χ2=12.044,P=0.002;试验组和对照组总有效率分别为75.00%、35.71%,χ2=11.128,P=0.001(图1)。两组症状和体征改善情况比较无统计学意义。
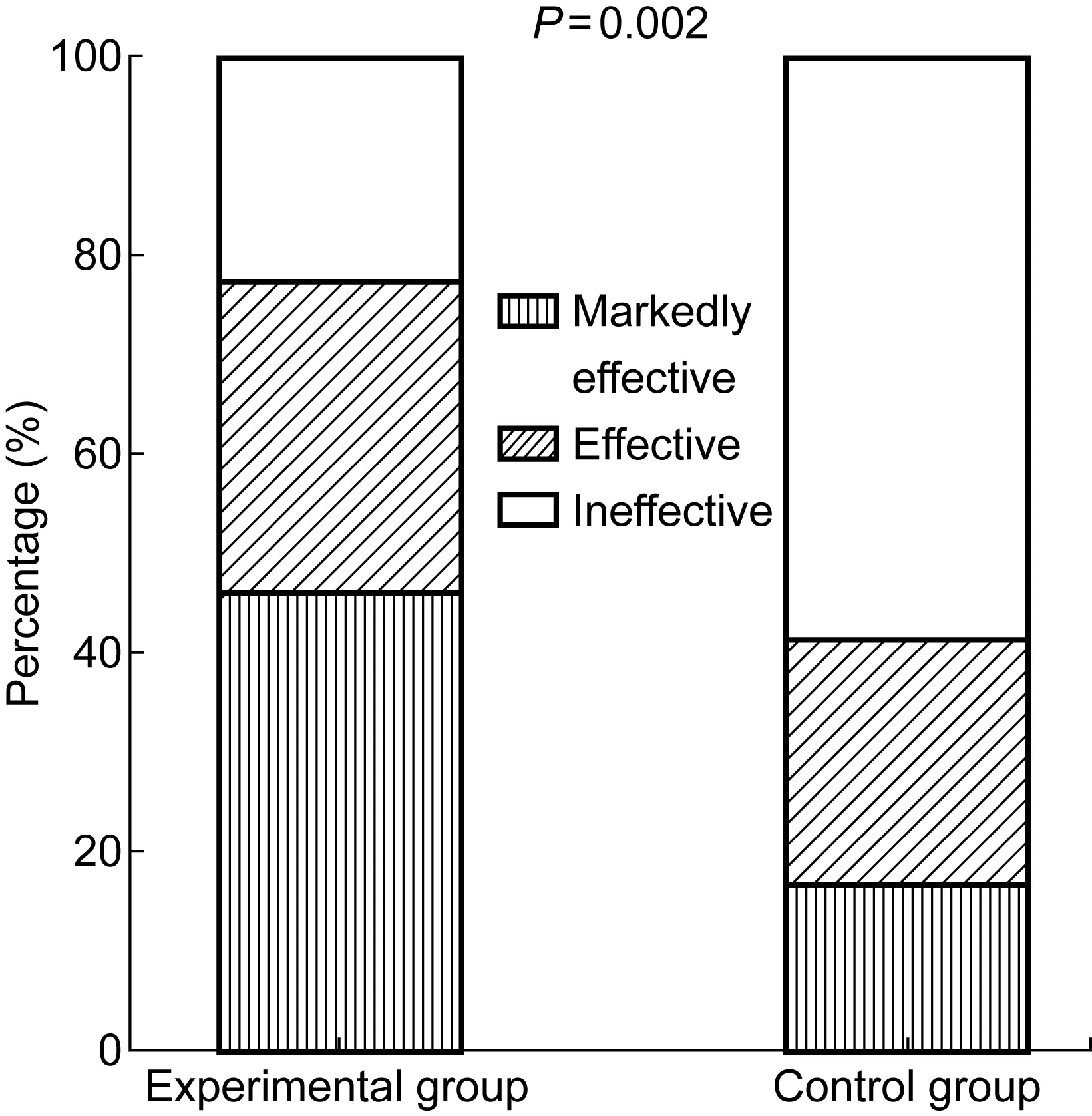
图1异甘草酸镁注射液试验组与对照组疗效比较
Fig.1 Comparison of therapeutic effect between the experimental group and control group
2.3.2单项疗效单项疗效指主要肝功能指标治疗前后的变化情况。试验组治疗后的肝功能指标ALT、AST水平较治疗前显著下降,也比对照组治疗后的相应指标好转更显著,均显示出统计学差异(表2)。
表1异甘草酸镁注射液试验组与对照组疗效相关数据基线比较
Tab.1 Comparison of baseline data between the experimental group and control group

Experimental group (n=84)Control group (n=28)P valueAge (year)32.99±12.8934.71±13.350.544Gender Male51 (60.71%)16 (57.14%)0.739 Female33 (39.29%)12 (42.86%)BMI <2027 (32.14%)7 (25.00%)0.167 20-2550 (59.52%)15 (53.57%) >257 (8.33%)6 (21.43%)History of alcohol and drinking42 (50.00%)15 (53.57%)0.743History of liver disease3 (3.57%)1 (3.57%)1.000Median time between medication and onset (d) 26.00 12.500.208
表2异甘草酸镁注射液试验组与对照组主要肝功能指标治疗前后的变化情况(mean±SD)
Tab.2 Comparison of liver function index between the experimental group and control group (mean±SD)

ALTASTTBILAKPExperimental groupBefore treatment114.00±100.3789.00±80.1710.83±5.5785.00±43.22After treatment38.00±36.27∗∗△△26.00±49.74∗∗△10.80±4.4678.00±32.55∗Control groupBefore treatment131.50±104.2693.50±135.4711.54±10.0080.00±33.24After treatment78.50±131.8843.00±63.9810.80±6.7177.00±38.26
*P<0.05,**P<0.01 compared with before treatment;△P<0.05,△△P<0.01 compared with control.
治疗前后ALT变化:试验组ALT的中位数从治疗前 的114.00 U/L下降至结束时的38.00 U/L,下降中位数为76.00 U/L(t=9.006,P<0.01)。对照组ALT的中位数从治疗前的131.50 U/L下降至结束时的78.50 U/L,下降中位数为53.00 U/L(t=2.073,P=0.048)。试验组与对照组下降中位数比较,t=2.024,P=0.046。两组ALT单项变化:治疗结束时试验组显效、有效、无效百分比分别为 53.25%、20.78%、25.97%,对照组结束时显效、有效、无效百分比分别为25.00%、12.50%、62.50%,两组间χ2=10.848,P=0.004。治疗结束时试验组、对照组总有效率分别为74.03%、37.5%(χ2=10.780,P=0.001)。
治疗前后AST变化:试验组AST的中位数从治疗前的89.00 U/L下降至结束时的26.00 U/L,下降中位数为63.00 U/L(t=7.485,P<0.01)。对照组AST的中位数从治疗前的93.50 U/L下降至结束时的43.00 U/L,下降中位数为50.50 U/L(t=2.876,P=0.009)。试验组与对照组下降中位数比较,t=2.513,P=0.014。两组AST单项变化:治疗结束时试验组显效、有效、无效百分比分别为76.32%、6.58%、17.10%,对照组结束时显效、有效、无效百分比分别为45.45%、13.64%、40.91%,两组间χ2=7.689,P=0.021。治疗结束时试验组、对照组总有效率分别为 82.89%、59.09%(χ2=5.553,P=0.018)。
治疗前后TBIL变化:试验组TBIL的中位数从治疗前的10.83 U/L下降至结束时的10.80 U/L,下降中位数为 0.03 U/L(t= 1.079,P= 0.284)。对照组BILT的中位数从治疗前的11.54 U/L下降至结束时的10.80 U/L,下降中位数为0.74 U/L(t=0.370,P=0.715)。试验组、对照组下降中位数比较,t=0.062,P=0.95。
治疗前后AKP变化:试验组AKP的中位数从治疗前的85.00 U/L下降至结束时的78.00 U/L,下降中位数为7.00 U/L(t=2.346,P=0.022)。对照组AKP的中位数从治疗前的80.00 U/L下降至结束时的77.00 U/L,下降中位数为3.00 U/L(t=1.169,P=0.257)。试验组与对照组下降中位数比较,t=1.152,P=0.258。
2.4 异甘草酸镁注射液安全性评估
试验组、对照组的不良事件发生率分别为5.00%、4.17%(χ2=0,P=1)。两组均未发生严重不良事件。
3 讨论
抗结核药物所致肝损害是指在抗结核药物使用过程中,由于药物或其代谢产物引起的肝细胞毒性损害或肝脏对药物及代谢产物的变态反应所致的疾病,可表现为无症状短暂性ALT升高的肝脏适应性反应,也可出现明显消化道症状的急性肝细胞损害,甚至发生暴发性肝细胞坏死[7,8]。世界各地报道的抗结核药物所致肝损害的发生率为3%~8%,我国1996~2005年报道的抗结核药物所致肝损害的发生率平均高达11.9%,因此备受关注[9]。
WHO推荐的第1~5组抗结核药物引起肝损害的频率不同。肝损害频率发生多的药物有异烟肼、利福平、吡嗪酰胺、丙硫异烟胺、对氨基水杨酸等,肝损害频率发生少的药物有乙胺丁醇和氟喹诺酮类等[2,3]。多种抗结核药物合用肝损害发生率明显高于单药应用。一项纳入3 007例肺结核患者的研究发现,利福平+异烟肼治疗的患者肝损害的发生率为0.8%,加吡嗪酰胺后增至2.8%,提示利福平+异烟肼+吡嗪酰胺三联用药可增加肝损害的发生风险[10]。国内对1996~2005年发表的抗结核治疗不良反应的117篇文献综合分析发现,近10年来抗结核药物引起的不良反应中肝损害的发生率最高,合计为11.9%,发生时间多在用药后1周~3个月,分别在1~2周和2个月左右出现高峰期[9]。本研究中结核用药至发病中位时间试验组为26.00 d,对照组为12.50 d,与上述数据相符。
目前常用的一线抗结核药中以异烟肼、利福平等药物性肝脏损害最常见,因为利福平为肝药酶诱导剂,异烟肼在肝内转变为乙酰肼而加重肝损害。同时利福平本身也导致肝细胞损害[11]。治疗抗结核药物所致肝损害的原则是停用该药、抗感染、降酶、退黄等综合治疗。异甘草酸镁具有较强的抗感染、保护肝细胞及改善肝功能的作用;其药理学研究表明对四氯化碳、D-氨基半乳糖及硫代乙酰胺引起的血清ALT、AST升高具有明显的降低作用,还能显著减轻D-氨基半乳糖对肝脏的形态损伤和改善免疫因子对肝脏形态的慢性损伤。
本研究中异甘草酸镁注射液对抗结核药物引发的肝损害主要疗效指标(肝功能综合疗效指标)显示,治疗结束时试验组显效、有效、无效百分比及总有效率均明显优于对照组。试验组治疗后的ALT、AST水平较治疗前显著下降,同时也比对照组治疗后的相应肝功能指标好转更显著,均显示出统计学差异。结果提示,异甘草酸镁注射液对抗结核药物引发的肝损害有明显改善作用。
本研究尚存在一定局限性。虽然所有患者均采用DOTS方案治疗,但部分患者存在个别药物停药的情况;同时发现肝损害时不同药物的使用时间有一定差异,各药物的DDW评分在不同患者间有差异,这些因素都可能导致患者抗结核治疗的异质性。因样本量所限,尚难以做到根据发生肝损害前抗结核治疗的具体情况进行亚组分析,也难以评价停药与异甘草酸镁注射液治疗以及两者联合对肝功能恢复的疗效比较。此外,本研究未纳入重症肝损害患者,因此该结论应用于抗结核药物所致严重肝损害的患者需谨慎,仍需进一步研究。
综上所述,异甘草酸镁注射液对抗结核药物引发的肝损害有明显改善作用,且未发生明显不良反应。针对肺结核患者治疗过程中发现的肝功能损害,早期使用异甘草酸镁注射液保肝能迅速恢复肝功能,减少不良反应所致的停药或放弃治疗,有助于保证抗结核治疗的疗效。
[1] WHO. World Health Organization Global tuberculosis report 2012 [R/OL]. http://www.who.int/tb/publications/ global_report/en/.
[2] 唐神结,高文. 临床结核病学[M]. 北京:人民卫生出版社,2011,191-200.
[3] 肖东楼,马玙,朱莉贞. 抗结核药品不良反应诊疗手册[M]. 北京:人民卫生出版社,2010,14-62.
[4] Tostmann A, Boeree MJ, Aarnoutse RE, de Lange WC, van der Ven AJ, Dekhuijzen R. Antituberculosis drug-induced hepatotoxicity: concise up-to-date review [J]. J Gastroenterol Hepatol, 2008, 23(2):192-202.
[5] 李艳丽,张建英,吴爽.异甘草酸镁注射液的临床应用[J]. 实用药物与临床, 2011,14(6):521-522.
[6] 中华医学会结核病学分会. 肺结核诊断和治疗指南[J]. 中华结核和呼吸杂志, 2001, 24(2): 70-74.
[7] Saukkonen JJ, Cohn DL, Jasmer RM, Schenker S, Jereb JA, Nolan CM, Peloquin CA, Gordin FM, Nunes D, Strader DB, Bernardo J, Venkataramanan R, Sterling TR, ATS (American Thoracic Society) Hepatotoxicity of Antituberculosis Therapy Subcommittee. An official ATS statement: hepatotoxicity of antituberculosis therapy [J]. Am J Respir Crit Care Med, 2006, 174(8): 935-952.
[8] Devarbhavi H, Dierkhising R, Kremers WK, Sandeep MS, Karanth D, Adarsh CK. Single-center experience with drug-induced liver injury from India: causes, outcome, prognosis, and predictors of mortality [J]. Am J Gastroenterol, 2010, 105(11): 2396-2404.
[9] 夏愔愔,詹思廷. 国内抗结核药物不良反应发生率的综合分析[J]. 中华结核和呼吸杂志, 2007, 30(6): 419-423.
[10] Chang KC, Leung CC, Yew WW, Lau TY, Tam CM. Hepatotoxicity of pyrazinamide: cohort and case-control analyses [J]. Am J Respir Crit Care Med, 2008, 177(12): 1391-1396.
[11] 施毅, 宋勇. 现代肺部感染学[M].北京:人民军医出版社,1996, 530-531.
