肾病患者免疫球蛋白、补体、白蛋白、血脂与肾脏病理的关系
2013-01-07吴春林
吴春林
(广西壮族自治区南溪山医院肾内科,广西桂林 541002)
大多数肾小球肾炎中,体液免疫介导的损伤主要是由于肾小球内不同部位形成免疫复合物沉积,包括免疫球蛋白(Ig)、补体和其他蛋白,与肾小球疾病密切相关。Ig与补体参与的肾脏损伤的体液免疫机制已得到公认,因此这些指标的测定对于肾脏疾病的诊断、治疗和预后评估具有重要指导意义。我们通过探讨肾病患者血清免疫球蛋白(IgG、IgA)、补体(C3、C4)、白蛋白(Alb)、24 h尿蛋白定量、血脂等临床指标与肾脏病理学的关联性,为今后提高肾病的诊治水平提供更多的循证医学证据。
材料和方法
一、研究对象
随机抽取2006年至2012年南溪山医院肾活检患者251例,其中男160例、女91例,年龄13~81岁。病理诊断包括IgA肾病(IgAN)106例、膜性肾病(MN)19例、局灶节段性肾小球硬化(FSGS)14例、微小病变性肾病(MCD)7例、狼疮性肾炎(LN)7例、乙型肝炎病毒相关性肾炎(HBV-GN)5例、高血压肾损伤8例。患者的Alb水平为39.40(33.80~42.60)g/L,尿蛋白为0.79(0.41~2.48)g/24 h,总胆固醇(TC)为4.61(3.90~5.81)mmol/L,甘油三酯(TG)为 1.74(1.25~2.75)mmol/L,血清肌酐(SCr)为82.40(65.20~112.20)μmol/L。健康对照组56名均选自广西壮族自治区南溪山医院门诊健康体检者,其中男23名、女33名,年龄14~79岁。
二、评分标准
沉积在肾脏组织中的IgG、IgA、C3免疫荧光强度评分标准:0分,无;1分,弱;2分,中;3分,强。
肾小球系膜增生程度评分(简称系膜增生评分)标准:0级,无;1级,轻度;2级,中度;3级,重度。
三、方法
采用免疫透射比浊法测定 IgG、IgA、C3、C4、尿蛋白;采用溴甲酚绿法测定Alb,采用苦味酸法测定SCr,采用氧化酶法测定TC、TG。仪器为德国Roche MODULAR P800全自动生化分析仪,均使用配套试剂。
将所有患者的血清 IgG、IgA、C3、C4、系膜增生评分与 Alb、24 h尿蛋白定量、TC、TG、SCr及IgG、IgA、C3免疫荧光强度评分进行相关性分析。对健康对照组及各肾病组的IgG、IgA、C3、C4水平进行比较。
三、统计学方法
应用SPSS18.0统计软件进行分析。偏态分布的计量资料用中位数(四分位数)表示。相关性分析用非参数检验的Spearman相关系数计算。健康对照组及各肾病组血清IgG、IgA、补体C3、C4的比较用秩和检验。P<0.05表示差异有统计学意义。
结 果
一、相关性分析
血清IgG、IgA与Alb及IgA、C3免疫荧光强度呈正相关(P<0.05),与24 h尿蛋白定量、TC呈负相关(P<0.05);血清C3、C4与TC、TG呈正相关(P<0.05),与IgG、IgA、C3免疫荧光强度呈负相关(P<0.05);系膜增生评分与血清IgA、TG及IgA、C3免疫荧光强度呈正相关(P<0.05),与血清C3呈负相关(P<0.05)。见表1。
二、各肾病组及健康对照组 IgG、IgA、C3、C4水平比较
MCD组血清IgG水平最低,与IgAN组、FSGS组、LN组、HBV-GN组、高血压肾损伤组及健康对照组比较差异均有统计学意义(P<0.05),但与MN比较差异无统计学意义(P>0.05)。IgAN组血清IgA水平最高,与MN组、FSGS组、MCD组及健康对照组比较差异均有统计学意义(P<0.05),但与LN组、HBV-GN组、高血压肾损伤组比较差异无统计学意义(P>0.05)。LN组血清C3、C4水平最低,与其余各组比较差异均有统计学意义(P<0.01)。见表2。
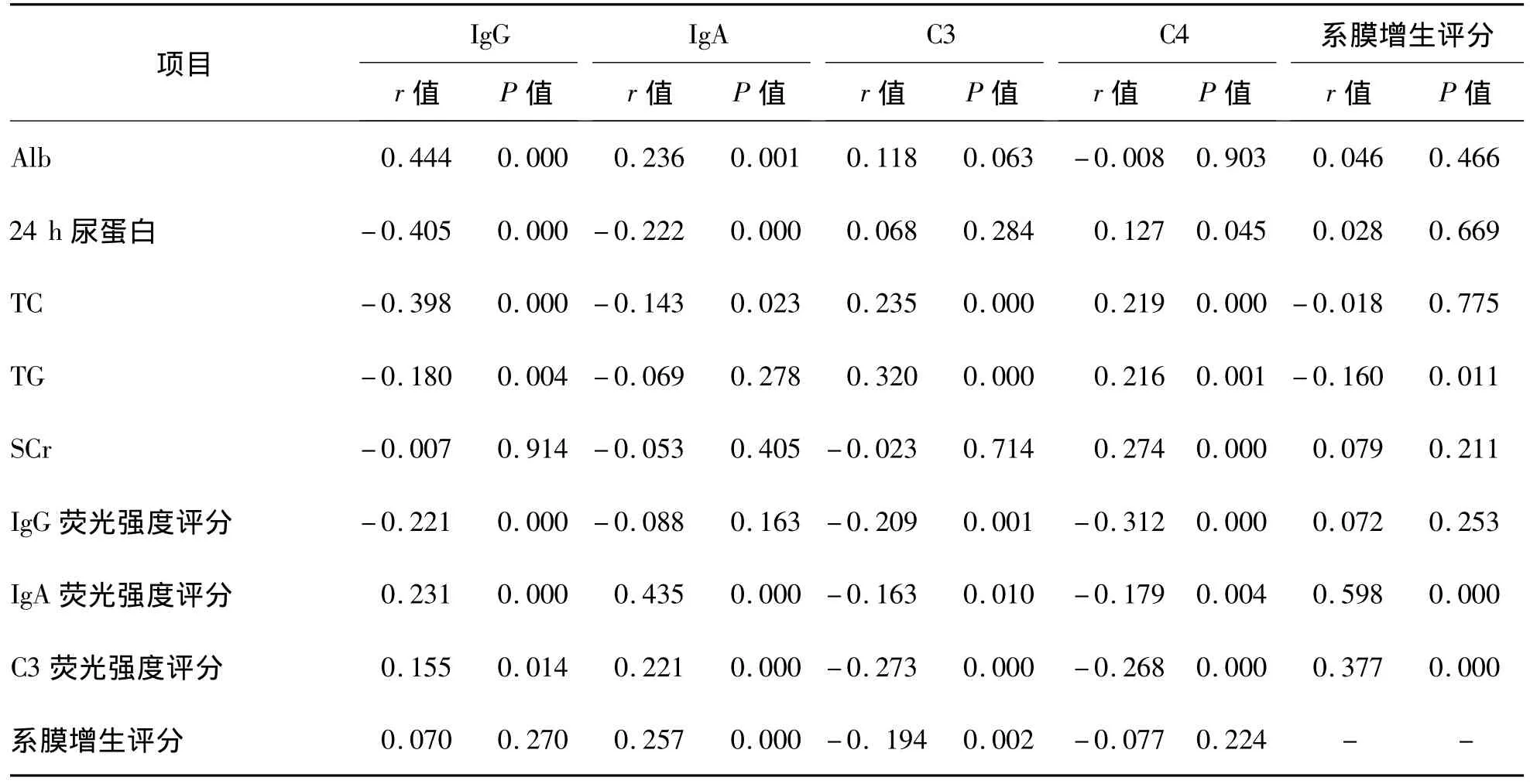
表1 血清IgG、IgA、C3、C4、系膜增生评分与Alb、24 h尿蛋白定量、血脂、SCr及IgG、IgA、C3免疫荧光强度评分的相关性分析

表2 各肾病组及健康对照组IgG、IgA、C3、C4水平比较 (g/L)
讨 论
血清Ig是检查机体体液免疫功能的一项重要指标。人类的 Ig可分为 IgG、IgA、IgM、IgD、IgE。Ig多克隆增高主要见于感染、淋巴瘤、自身免疫性疾病、肝病等;Ig单克隆增高主要见于多发性骨髓瘤、巨球蛋白血症等;Ig水平降低常见于各类先天性或获得性免疫缺陷病、肾病综合征等。补体系统广泛参与机体的抗感染防御反应、介导细胞溶解、调理吞噬、免疫黏附、参与炎症反应引起机体免疫损伤等。补体C3降低常见于急性肾炎、LN、膜增殖性肾小球肾炎、HBV-GN、感染、肝病等;补体C4降低主要见于LN、感染、肝病等[1]。
30%~50%的IgAN患者可有血清IgA水平升高[2]。本研究中IgAN患者的血清IgA水平在各肾病组中是最高的,但与LN组、HBV-GN组、高血压肾损害组比较差异无统计学意义(P>0.05)。血清IgA水平升高,提示IgAN、LN、HBVGN等可能性相对较大。患者血清IgA水平越高,血清补体C3水平越低、肾脏沉积的IgA和C3就越多,患者的肾小球系膜增生程度就越严重。对转基因小鼠的研究发现IgA与有膜结合力的CD89形成可溶性CD89-IgA复合物后,系膜区出现大量IgA沉积。IgAN患者的血清中大分子IgA水平增加,可能与IgA-O-糖基化结构缺陷有关,促使其更容易在系膜区滞留[3]。IgA单独沉积也足以触发肾小球损伤,充分说明IgA有刺激系膜细胞增生及活化炎症反应的作用[1]。迄今为止,尚无一种方法能改变IgA在系膜区的沉积,只能在发病机制的后续过程通过改变炎症反应及炎症状态来减少肾小球硬化。
本研究显示血清 C3、C4水平与肾脏 IgG、IgA、C3免疫荧光强度评分均呈负相关,说明肾小球内免疫复合物沉积会消耗大量血清补体。血清补体水平越低,提示体内补体系统激活,肾小球内的免疫反应就越剧烈,对肾脏的损伤也越严重。LN组的血清C3、C4水平在各肾病组中是最低的,与其余各组比较差异均有统计学意义(P<0.01)。说明LN患者体内的自身免疫反应较其他肾病更剧烈,故补体C3、C4水平对于LN的鉴别诊断、判断活动性、指导治疗具有重要价值。在与免疫有关的肾小球肾炎发病过程中,阻断补体的作用能缓解组织损伤。补体抑制剂的发展为炎性疾病的治疗提供了新途径,但临床补体抑制剂的临床应用仍面临诸多问题,还需今后深入研究[4]。
本研究还显示血清IgG、IgA水平与Alb呈正相关,与24 h尿蛋白定量呈负相关,说明大量蛋白尿可导致体内Alb大量流失,进而可出现低Ig血症。MCD患者的血清IgG水平最低,其次是MN患者。究其原因,是因为MCD患者的临床表现就是低 Alb血症的肾病综合征,MN患者约80%表现为肾病综合征。低Ig血症,尤其是低IgG血症易出现免疫功能紊乱,诱发感染,这是肾病综合征易并发感染的重要原因之一。高脂血症可促进系膜细胞增生、基质增多、肾小球硬化和肾小管-间质病变的发生,促进肾脏病变的慢性进展[2,5]。本研究中 TG 与系膜增生评分、C3、C4 均呈正相关也反映出高脂血症的危害。Ruan等[6]通过炎症介质对肾脏胆固醇代谢的影响,认为脂质与炎症协同导致肾毒性,炎症可破坏系膜细胞胆固醇的动态平衡,系膜细胞对脂质的摄取增加,排出减少,从而导致肾脏的脂质沉积。另外,已有相关文献[7-8]报道高脂血症患者血清C3、C4水平均升高。由此可看出,通过降低24 h尿蛋白定量水平以减少体内Alb的流失,改善高脂血症,均可调节体内Ig及补体水平,减轻肾脏病理损伤,减少感染等并发症。
综上所述,Ig、补体、尿蛋白、Alb、血脂对于肾脏疾病的诊断、治疗和预后评估具有重要指导意义。但需注意这些指标可能会存在较多的影响因素,如感染、肿瘤、肝病等均会使患者Ig及补体水平发生明显变化。故不能仅凭某一种或几种指标的变化进行肾病的诊治,而应在参考有无影响因素的情况下,结合更多的临床指标和肾脏病理进行综合判断。
[1] 黎磊石,刘志红.中国肾脏病学[M].北京:人民军医出版社,2008:89-464.
[2] 陆再英,钟南山.内科学[M].北京:人民卫生出版社,2010:513-525.
[3]Launay P,Grossetête B,Arcos-Fajardo M,et al.Fcalpha receptor(CD89)mediates the development of immunoglobulin A(IgA)nephropathy(Berger's disease).Evidence for pathogenic soluble receptor-Iga complexes in patients and CD89 transgenic mice[J].J Exp Med,2000,191(11):1999-2009.
[4]崔 敏,朱学军.补体抑制剂及其在肾脏疾病治疗中的应用[J].肾脏病与透析肾移植杂志,2003,12(6):568-570.
[5]王海燕.肾脏病学[M].北京:人民卫生出版社,2009:785-795.
[6]Ruan XZ,Varghese Z,Moorhead JF.Inflammation modifies lipid-mediated renal injury[J].Nephrol Dial Transplant,2003,18(1):27-32.
[7]Sampietro T,Bigazzi F,Dal Pino B,et al.Up regulation of C3,C4,and soluble intercellular adhesion molecule-1 co-expresses with high sensitivity C reactive protein in familial hypoalphalipoproteinaemia:further evidence of inflammatory activation[J].Heart,2004,90(12):1438-1442.
[8]Meijssen S,van Dijk H,Verseyden C,et al.Delayed and exaggerated postprandial complement component 3 response in familial combined hyperlipidemia[J].Arterioscler Thromb Vasc Biol,2002,22(5):811-816.
