黑曲霉改良株C112产β-葡萄糖苷酶的诱导及条件优化
2013-01-05先天敏陈介南
先天敏,陈介南,张 林
(中南林业科技大学 国家林业局生物乙醇研究中心,生物环境科学与技术研究所,湖南 长沙 410004)
黑曲霉改良株C112产β-葡萄糖苷酶的诱导及条件优化
先天敏,陈介南,张 林
(中南林业科技大学 国家林业局生物乙醇研究中心,生物环境科学与技术研究所,湖南 长沙 410004)
利用单因素实验及均匀设计法研究了黑曲霉C112发酵产β- 葡萄糖苷酶的发酵条件。结果表明:黑曲霉
C112发酵产β- 葡萄糖苷酶的影响因素很多,包括接种方式(菌株活力)、接种量、碳氮源种类与浓度、发酵温度时间、初始pH值等。研究发现,通过种子接种改善菌株活力能有效提高产酶活力。碳源粒径也是影响诱导产酶效果的重要条件之一,当玉米芯粒径高于0.180 mm时产酶效果最佳。该菌株最适宜产酶条件为:玉米芯与麦芽浸粉(7:3)6 g/L、初始pH值4.87、30 ℃下发酵120 h,所得酶活力最大可达12.925 U/mL,较优化前提高了79.0 %。
黑曲霉;发酵 β-葡萄糖苷酶;条件优化;麦芽浸粉
生物燃料乙醇可以替代石油等化石能源,是发展低碳经济的重要新能源[1]。以纤维素为原料生产燃料乙醇具有低污染、可再生、农林纤维素资源广泛等优点,前景可观[2]。目前,生物乙醇的生产方式是通过纤维素酶复合酶系降解纤维素成为葡萄糖单体。β-葡萄糖苷酶,编号EC3.2.1.21,英文名β-glucosidase,是纤维素酶复合酶系的重要组成部分[3]。其功能是水解纤维二糖和短链的纤维寡糖生成葡萄糖,解除中间产物纤维二糖对纤维素酶复合酶系中内切葡聚糖水解酶和外切葡聚糖水解酶的抑制。内切葡聚糖水解酶和外切葡聚糖水解酶必须与β-葡萄糖苷酶充分协同才能完成纤维素的有效降解。
目前所报道的木霉属纤维素酶生产菌株普遍呈现出低β-葡萄糖苷酶活的特点[4]。刘杰凤[5]等曾报道一株纤维素高产菌株,其最优产酶结果如下:β-葡萄糖苷酶酶活324 U/g, FPA(滤纸酶活)1 227 U/g,两者比率仅为0.264。而Gupta[6]等曾报道,在滤纸酶中添加9.0 IU /g的β-葡萄糖苷酶,能使纤维类物质的酶解糖化效率最高。本实验室的研究[7-8]也显示,通过优化调整β-葡萄糖苷酶与滤纸酶的比为1.39时,酶解糖化率最高。因此,在木霉属纤维素酶中额外添加β-葡萄糖苷酶是提高纤维素酶系降解能力的重要途径之一[9-10]。此外,β-葡萄糖苷酶在食品[11]、酿酒[12]、化学工业[13-14]等大量领域都有所运用。
目前,β-葡萄糖苷酶主要源于黑曲霉等菌种的发酵。黑曲霉是公认安全(GRAS)的微生物,生长快,发酵周期短,其生产所得酶制剂安全,可靠,无毒素。黑曲霉C112是本实验室由黑曲霉30786原始菌株(购于中国农业微生物菌种保藏中心)诱变而来,具有相当的产酶潜力,已知的最大酶活为7.220 U/mL[15]。
本文通过单因素实验和均匀实验[16]对黑曲霉C112产β-葡萄糖苷酶的液体发酵产酶条件进行优化,试图降低生产成本,获得高产量的β-葡萄糖苷酶。
1 材料与方法
1.1 实验材料
1.1.1 菌种
黑曲霉Aspergillus niger C112,是本实验室诱变选育的β-葡萄糖苷酶高产菌株[11]。
1.1.2 培养基
固体平板培养基:PDA培养基[17]。种子培养基:马铃薯培养基[13]。发酵基础培养基[11]:麸皮10 g/L,酵母粉 5 g/L,硫酸铵 2.8g/L,KH2(PO4) 4 g/L,MgSO4·7H2O0.9 g/L,CaCl20.9 g/L,吐温2滴/瓶,起始pH 5.0。
1.1.3 主要的仪器设备
岛津UV-5420紫外分光光度计,Hirayama高 压 灭 菌 锅HVE-50,Mettler Toledo pH计,Eppendorf单道移液器,单人超净工作台,制冰机,101-1AB型电热鼓风干燥箱,SPX-250B生化培养箱,760R恒温摇床等。
1.2 实验方法
1.2.1 菌株的基础培养方法
平板培养:28 ℃培养5 d。
发酵培养[11]:从黑曲霉固体平板培养基上挑取一环孢子,接种于装液100 mL的产酶培养基的250 mL摇瓶中,28 ℃、200 r/min条件下培养5 d。所有摇瓶实验均为3个平行。
1.2.2 粗酶液制备
发酵培养液在4 500 r /min离心7 min,取上清液为粗酶液。
1.2.3 β-葡萄糖苷酶的活力测定
采用国际通用的方法测定β-葡萄糖苷酶的活力[18-19]:取0.1 mL稀释了适当倍数的粗酶液(空白管不加),加入1 mLpH4.8的0.05 mol/L柠檬酸缓冲溶液,于50℃水浴预热10 min;加入已预热10 min的0.9 mL5 mmol/L p-NPG溶液,计时,10 min后立即加入1 mL 1 mol/LNa2CO3溶液终止反应;加入蒸馏水定容到25 mL;室温放置5 min,于410 nm处测吸光度值A。在上述条件下,1 mL酶液1 min水解产生1 μmol的对硝基苯酚的酶活力,定义为一个酶活单位。
β-葡萄糖苷酶活力按式1计算。

式中:Y1为样品的β-葡萄糖苷酶活力,U/mL·min;A 为根据吸光度在标准曲线上查得的对硝基苯酚量,μmol;N 为粗酶液的稀释倍数,本实验中,该值为1(未稀释);1/(0.1 mL×10 min) —换算成酶液1 mL反应1 min。
对硝基苯酚标准曲线制备:配制10 mmol/L对硝基苯酚母液,分别吸取0.025, 0.050, 0.075, 0.100,0.125, 0.150 mL母液,加入1 mL 1 mol/L Na2CO3溶液显色加入蒸馏水定容到25 mL,于410 nm处测吸光度值A。其分别对应的对硝基苯酚的量为0.25,0.50,0.75,1.00,1.25,1.50 μmol。标准曲线见图1。

图1 对硝基苯酚的标准曲线Fig.1 Standard curve of p-nitrophenol
1.3 单因素实验
1.3.1 种子接种对产酶的影响
挑取一环孢子,接种于100 mL的种子培养基,28 ℃,200 r/min,培养60 h得菌丝体种子液。以孢子接种产酶作为对照组,实验组种子液接种量分别为1%,2%,3%,4%,5%,6%,7%,8%,9%。在28 ℃,200 r/min,培养5 d ,进行β-葡萄糖苷酶的活力测定。
1.3.2 种子培养时间对产酶的影响
挑取一环孢子,接种于100 mL的种子培养基,28℃,200 r/min, 分 别 培 养 24、36、48、60、72、84、96 h得菌丝体种子液,均以5%的接种量接种于发酵基础培养基,在28 ℃,200 r/min,培养5 d,进行β-葡萄糖苷酶的活力测定。
1.3.3 碳源对产酶的影响
以发酵基础培养基为对照。在去掉麸皮的发酵基础培养基中分别添加10 g/L的9种不同碳源,包括麸皮、稻草粉、甘蔗渣、糠、美国松、玉米芯、工业纤维素、可溶性淀粉、蔗糖;在28 ℃,200 r/min,培养5 d,进行β-葡萄糖苷酶的活力测定。
1.3.4 碳源粒径对产酶的影响
将适度粉碎后的玉米芯依次过18目(1.00 mm)和80目(0.180 mm)筛。不能通过18目筛的玉米芯颗粒为1号样本,通过18目筛但不能通过80目筛的为2号样本,通过50目筛的为3号样本。将适度粉碎的后的稻草粉依次过18目和80目筛,同样由大粒径至小粒径依次编为4号样本,5号样本,6号样本。在去掉麸皮的发酵基础培养基中分别添加10 g/L的6种碳源样本,在28 ℃,200 r/min,培养5 d ,进行β-葡萄糖苷酶的活力测定。
1.3.5 附加碳源种类对产酶的影响
在去掉麸皮的发酵基础培养基中加入7 g/L的玉米芯作为基础碳源。以3 g/L的量分别加入12种有机物作为附加碳源,包括麦芽浸粉、工业纤维素、淀粉、麸皮、稻草粉、葡萄糖、米糠、木糖、甘蔗渣、蔗糖、麦芽糖、乳糖。在28 ℃,200 r/min,培养5 d,进行β-葡萄糖苷酶的活力测定。
1.3.6 碳源浓度对产酶的影响
在去掉麸皮的发酵基础培养基中分别加入5,10,15,20,25 g/L的玉米芯与麦芽浸粉(7:3)的混合碳源,在28 ℃,200 r/min,培养5 d ,进行β-葡萄糖苷酶的活力测定。
1.3.7 不同氮源对产酶的影响
在去掉氮源的产酶基础培养基中分别加入2.8 g/L的不同氮源,包括硫酸铵、硝酸铵、蛋白胨、尿素、硫酸铵与硝酸钠(1:1)、硫酸铵与尿素(1:1)、硫酸铵与蛋白胨(1:1)。于28 ℃,200 r/min,培养5 d,进行β-葡萄糖苷酶的活力测定。
1.3.8 产酶温度及时长对产酶的影响
保持培养基成分不变,接种产酶培养基后分别在26,28,30 ℃下培养144 h,每个温度条件下3个平行。所有样品均在72,96,120,144 h进行取样,进行β-葡萄糖苷酶的活力测定。
1.3.9 pH对产酶的影响
保持培养基成分不变,使用1 mol/L的HCl溶液和1 mol/L 的NaOH溶液将培养基的初始pH值分别调成4、4.5、5、5.5、6、6.5、7。发酵温度28℃,摇床转数200 r/min,发酵120 h后测定β-葡萄糖苷酶活。
1.4 均匀实验[12]
本实验选了对发酵结果影响较大的五个因素:接种量、碳源浓度、初始pH值、发酵温度、装液量作为考察对象。其中接种量和碳源浓度,设置10个水平;发酵料初始pH值、发酵温度和装液量各设置5个水平。具体试验设计见表1。

表1 黑曲霉C112发酵配方的优化试验因素水平分配方案Table 1 Optimization test factors allocation plan for fermented recipes of Aspergillus niger C112
选取U*10 ( 108) 均匀设计表,根据其使用表的规定,选择表中的第1列、第2列、第4列、第5列、第7列,用拟水平法构造。再把每列的水平代码换成相应因素的水平值,即得到试验方案,试验的安排见表2。

表2 试验方案与结果Table 2 Testing program and results
按实验安排表进行发酵产酶,测定β-葡萄糖苷酶的活力。
2 结果与分析
2.1 单因素实验
2.1.1 种子接种对产酶的影响
种子接种对产酶的影响见图2。由图2可知,随着接种量的增加,β-葡萄糖苷酶活力先升高再下降。当黑曲霉C112以6 %的种子液进行接种时,β-葡萄糖苷酶活力达到7.305 U/mL,而对照组β-葡萄糖苷酶活力仅为3.759 U/mL。可知种子接种法效果优于孢子接种法。因此,本文选择了6%的接种量进行后续研究。

图2 种子接种对产酶的影响Fig. 2 Effects of inoculation of seeds on enzyme production
2.1.2 种子培养时间对产酶的影响
种子培养时间通过影响接种时的菌体活性强弱,最终影响产酶量。种子培养时间对黑曲霉C112产β-葡萄糖苷酶活力的影响见图3,随着种子培养时间的延长,β-葡萄糖苷酶活力先升高再下降,符合黑曲霉的菌体生长规律。黑曲霉当种子培养达到60 h时,β-葡萄糖苷酶活力最高,为7.957 U/mL。
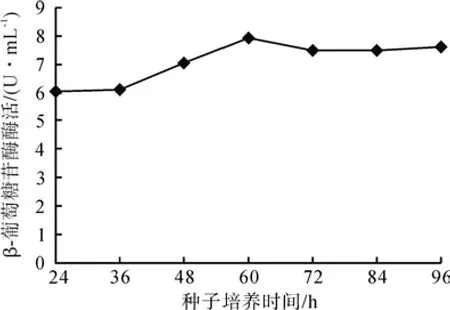
图3 种子培养时间对产酶的影响Fig. 3 Effects of seed culture on enzyme production
2.1.3 碳源对产酶的影响
β-葡萄糖苷酶属于诱导酶类,碳源通常是该酶合成的诱导物质[3]。不同碳源诱导黑曲霉合成β-葡萄糖苷酶的能力不同。碳源种类对产酶的影响见图4。由图4可知,麸皮、稻草粉、甘蔗渣、玉米芯、工业纤维素等纤维性碳源的诱导产酶能力高于可溶性淀粉、蔗糖等可溶性碳源。尤其在玉米芯中产β-葡萄糖苷酶的活力最高。

图4 碳源对产酶的影响Fig. 4 Effects of carbon sources on enzyme production
2.1.4 碳源粒径对产酶的影响
黑曲霉C112对不同种类粒径的碳源具有不同的吸收能力,从而影响产酶效果。碳源粒径对产酶的影响见图5。由图5可知,当玉米芯粒径大于0.180 mm时,粒径变化对产酶活性影响有限。当玉米芯粒径小于0.180 mm时,诱导产酶的能力大幅度降低,仅达4.32 U/mL。其原因可能是粒径过低导致的菌体与颗粒接触不良。而稻草粉则由于长径比较大,产酶能力在试验范围内随粒径的减小而增加,在粒径小于0.180 mm时,达到最大产酶活力6.069 U/mL。其原因可能是在低粒径下,稻草中的长纤维束被切割为较短的纤维束,更容易被菌体分解。因此,本文选择了1号样本进行后续研究。
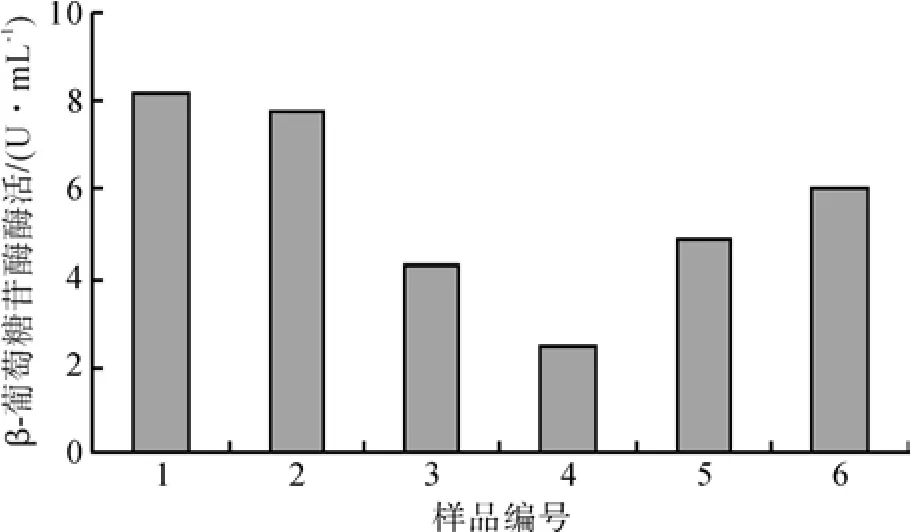
图5 碳源粒径对产酶的影响Fig. 5 Effects of carbon sources grain diameter on enzyme production
2.1.5 附加碳源对产酶的影响
附加碳源对产酶的影响见图6。由图6可知,麸皮、麦芽浸粉作为附加碳源,能有效提高酶活,分别可达10.517 U/mL和10.786 U/mL。麦芽浸粉对产酶的诱导作用可能是由于其富含的多种单糖、低聚糖及生长因子引起的,更有利于菌体的利用。而淀粉、蔗糖等可溶性附加碳源对β-葡萄糖苷酶的合成存在一定的抑制作用。工业纤维素引起的酶活降低则可能是由纤维聚合度过高不利于菌体利用引起的[20]。因此,本文选择了7 g/L玉米芯,3 g/L麦芽浸粉做为碳源进行后续研究。

图6 附加碳源对产酶的影响Fig.6 Effects of additional carbon sources on enzyme production
2.1.6 碳源浓度对产酶的影响
碳源含量影响菌体的生长情况及产酶量。碳源浓度对产酶的影响见图7,β-葡萄糖苷酶酶活力随着碳源浓度的升高而升高,当碳源浓度为25 g/L时,β-葡萄糖苷酶酶活最高,为10.910 U/mL。同的吸收能力,从而影响产酶效果。不同氮源对产酶的影响见图8。由图8可知,无机氮源的产酶能力优于有机氮源,单一氮源的产酶能力优于复合氮源。菌株在硫酸铵中产出的β-葡萄糖苷酶活力最强。

图7 碳源浓度对产酶的影响Fig.7 Effects of carbon sources concentration on enzyme production

图8 氮源对产酶的影响Fig. 8 Effects of nitrogen source on enzyme production
2.1.7 不同氮源对产酶的影响
黑曲霉C112对不同种类、性质的氮源具有不
2.1.8 产酶温度及时长对产酶的影响
时间温度对产酶的影响见图9。由图9可知,随着培养时间的延长,β-葡萄糖苷酶活力普遍先上升后下降。酶活的下降可能与代谢废物的积累有关。菌株在28 ℃下在不同时间测定的酶活值均高于其他温度,是黑曲霉C112的较适产酶温度。在该温度下发酵120 h达到酶活最高值,为10.566 U/mL。
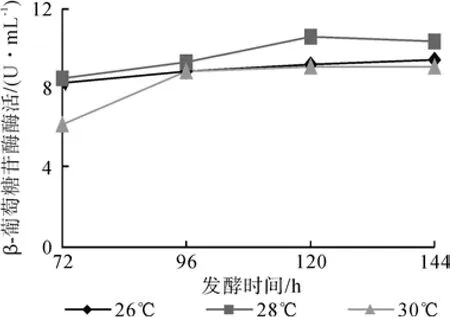
图9 温度时间对产酶的影响Fig.9 Effects of temperature and time on enzyme production
2.1.8 pH值对产酶的影响
pH值对产酶的影响见图10。由图10可知,随着发酵初始pH值的升高,β-葡萄糖苷酶活力普遍先上升后下降。当初始pH为5时,β-葡萄糖苷酶活力最高,达到8.564 U/mL。该现象的原因可能是不适宜的pH值抑制菌体内某些酶的活性, 使菌的新陈代谢受阻。极端pH条件也有可能导致分泌至胞外的β-葡萄糖苷酶失活。

图10 初始pH值对产酶的影响Fig.10 Effects of initial pH values on enzyme production
2.2 均匀实验
2.2.1 均匀实验结果见表3。
2.2.2 数据分析及模型建立
采用直观分析法,由表3可以看出,最好的条件是实验组中第5号。结果为11.297 U/mL。

表3 均匀试验方案与结果Table 3 Uniform test program and results
采用回归分析对均匀设计结果进行深入分析。参数估计如下:试验次数n=10,因素数m= 5。 用最小二乘法求出五元线性回归方程:
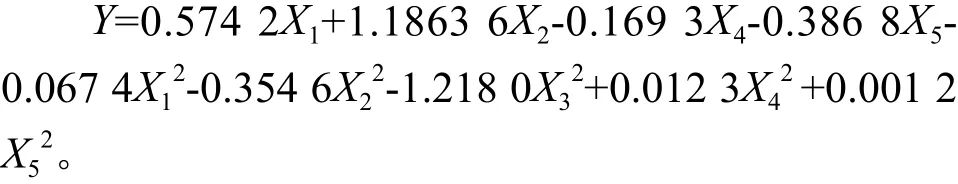
式中:X1为接种量,X2为碳源浓度,X3为初始pH,X4为发酵温度,X5为装液量,Y为酶活。
进行方程的显著性检验(F检验):F=MSR/MSe=7.869 服从自由度为(5,4)的F分布,在给定的显著性水平a=0.05下,查表可得,F0.05(5,4)=6.26。F>F0.05( 5,4)。根据F检验,方程有显著的线性关系。
拟合效果检验( R 检验)。R2=0.987,说明该多元线性模型在99.95%的水平下拟合的很好,方程的总体线性关系是显著的。方差分析见表4。

表4 方差分析Table 4 Variance analysis
对回归方程局部求最优解,得到在接种量4.26 %,碳源浓度27.5 g/L,pH4.87,30 ℃,装液量60 ml时可能产生较高酶活。
对回归方程中的一次项系数进行比较,可知各因素对β-葡萄糖苷酶活力的影响主次性顺序为:碳源浓度>接种量>发酵温度>装液量>初始pH。
由于β-葡萄糖苷酶活力随碳源浓度的增加而增加,为了得到更好的结果,可以对上述工艺条件做进一步改良。在验证试验中可以适当增加碳源浓度。
2.3 验证结果
为了验证黑曲霉产β-葡萄糖苷酶的模型的适用性,在4.26 %的接种量,27.5 g/L碳源,pH值4.87,30℃,装液量60 mL时进行验证试验,重复6次,得出β-葡萄糖苷酶的平均酶活为11.417 U/mL。
适当增加碳源浓度,验证后结果如下:当碳源浓度分别为50.0 g/L及60.0 g/L时,β-葡萄糖苷酶酶活为11.852 U/mL及12.925 U/mL,较未优化前实验室的最优水平7.220 U/ml提高了79.0%。
3 结 论
目前,国内外大多利用木霉属所产纤维素酶分解木质纤维生产生物燃料乙醇。但木霉属产β-葡萄糖苷酶活性普遍偏低,限制了总体纤维素酶的酶解效率。通过向木霉属所产纤维素酶中添加额外的β-葡萄糖苷酶可以有效提高总纤维素酶系的活性。本实验对黑曲霉C112产β-葡萄糖苷酶的工艺进行了一系列的优化,试图降低该酶的生产成本。
由接种方式、种子培养时间、碳源种类及粒径、附加碳源等单因素实验的优化结果可知:以6%的菌丝体种子液对产酶培养基进行接种能有效提高黑曲霉C112产β-葡萄糖苷酶活力。使用玉米芯做碳源并控制其粒径大于0.180 mm时产酶效果最佳。麦芽浸粉和麸皮作为附加碳源均对黑曲霉C112产β-葡萄糖苷酶均具有一定诱导作用。
均匀设计法可快速有效地确定多因子系统的优化条件。由分析得出产β-葡萄糖苷酶的最佳条件:接种量4.26 %,碳源浓度27.5 g/L,初始pH4.87,30 ℃,装液量60 ml。在此产酶条件下,β-葡萄糖苷酶的平均酶活为11.417 U/mL。提高碳源浓度到60 g/L,即玉米芯42 g/L,麦芽浸粉18 g/L时,β-葡萄糖苷酶活力可达12.925 U/mL,较初始值7.220 U/mL提高了79 %。已报道的液体发酵较高酶活水平(采用相同的酶活测定方法)如下:刘长江[21]等利用一株β-葡萄糖苷酶基因工程菌,发酵产酶能力最高达到147.8 U/L;许晓鹏[22]等经X射线诱变一株黑曲霉,发酵产β-葡萄糖苷酶所得最大酶活为59.86 U/mL·h。本实验所得的β-葡萄糖苷酶生产工艺处于较优水平。在实际生产方案中可以考虑消耗和成本,来适当调整碳源浓度的取值。若考虑产酶过程中的时间温度分段控制,则能进一步缩短产酶时间,降低生产成本。
[1] 丁声俊.生物能源:开拓低碳经济之新路[J].国家行政学院学报,2010,(3):11-15.
[2] Elliott C, David B. Biomass energy: the scale of the potential resource[J]. Trends in Ecology & Evolution,2008,23: 65-72.
[3] Flavio H, Cesar V, Jose C, et al. Purification and biochemical characterization of a mycelial glucose- and xylose-stimulated β-glucosidase from the thermophilic fungus Humicola insolens[J]. Process Biochemistry, 2010, 45: 272-278.
[4] Reeta R, Rajeev K, Kuni P, et al. Properties of a major β-glucosidase-BGL1 from Aspergillus niger NII-08121 expressed differentially in response to carbon sources[J]. Process Biochemistry, 2011, 46: 1521-1524.
[5] 刘杰凤,尹爱国等.里氏木霉和黑曲霉降解香蕉秆产可发酵糖的研究[J].可再生能源, 2012, 30(7): 93-97.
[6] Gupta R, Sharma K, Kuhad R. Separate hydrolysis and fermentation (SHF) of Prosopis juliflora, a woody substrate, for the production of cellulosic ethanol by Saccharom yces cerevisiae and Pichia stipitis NCIM 3498[J]. Bioresource Technology,2009, 100(3) : 1214-1220.
[7] 李 辉.里氏木霉产高活力纤维素酶诱导性物质的筛选和过程优化[D]. 2011.
[8] 王璀璨,王义强,等. 混合纤维素酶对杨木酶解的研究[J].可再生能源,2010,28(6):57-62.
[9] Garcia O, Segura M, Rodriguez P. Effect of media composition and growth conditions on production of bate-glucosidase by Aspergilllus niger C26[J]. Appl Biochem Biotechnol, 2005, 121-124: 347-360.
[10] Gutierrez M, Portal L, Moreno P, et al. Mixed culture solid substrate fermentation of Trichoderma reesei with Aspergillus niger on sugar cane bagasse[J]. Bioresour Technology, 1999, 68:173-178.
[11] 田长城,任茂生等.β-葡萄糖苷酶的制备及其在食品工业中的应用[J].中国酿造,2012,(1):31.
[12] Bioquímica C, Sección E. A novel extracellular β-glucosidase from Issatchenkia terricola: Isolation, immobilization and application for aroma enhancement of white Muscat wine[J].Process Biochemistry, 2011, 46: 385-389.
[13] 韦斌如,刘端玉,韩双艳,等.棘孢曲霉β-葡萄糖苷酶Ⅰ在毕赤酵母中的表达及烷基糖苷的催化合成[J].高等学校化学学报,2012,(07):1498-1504.
[14] Jingyuan S, Hiroyuki I, Koreyoshi I, et al. Development of a highly efficient indigo dyeing method using indican with an immobilized β-glucosidase from Aspergillus niger[J]. Journal of Bioscience and Bioengineering, 2010, 110(3): 281-287.
[15] 石彩蕊. 黑曲霉诱变育种产β-葡萄糖苷酶研究[D].长沙:中南林业科技大学,2011.
[16] 王 兵,王晓春.均匀设计直观分析法优化PCR条件[J].检验医学,2007,22(5): 620-622.
[17] 谢宝贵,黄志龙,江玉姬.草菇杂交研究初报—不正常类型单孢菌株之间的交配[J].食用菌学报,1997,4(2): 5-10.
[18] Mi-Ri H, Yeong-Su K, Chang-Su Park, et al. Characterization of a recombinant β-glucosidase from the thermophilic bacterium Caldicellulosiruptor saccharolyticus[J]. Journal of Bioscience and Bioengineering, 2009, 108(1): 36-40.
[19] Kubicek, C. β-Glucosidase excretion by Trichoderma pseudokoningii: Correlation with cell wall bound β-1.3-glucanase activities[J]. Archives of microbiology, 1982, 132(4): 349-354.
[20] 刘 敏,欧阳嘉,勇 强,等.黑曲霉液体发酵制备β-葡萄糖苷酶的研究[J].生物质化学工程, 2008,(1):42.
[21] 刘长江,梁 爽,郑 艳,等.β-葡萄糖苷酶基因工程菌发酵工艺优化[J].食品科学, 2010, 31(11): 173-177.
[22] 许晓鹏,袁士芳,刘立明. 突变黑曲霉高产β-葡萄糖苷酶的培养基优化[J].食品与生物技术学报, 2008, 27(2): 124-127.
[23] 郭 璐,黎继烈,王 卫,等.GL-7-ACA酰化酶的固定化工艺条件的优化[J].中南林业科技大学学报,2013,33(5):96-100.
[24] 王 挥,张 蕾,黎继烈,等.响应面法优化黑曲霉发酵产单宁酶的条件[J].中南林业科技大学学报,2011,31(10):122-126.[25] 范 超,黎继烈,吴 浩,等.重组巨大芽孢杆菌产青霉素G酰化酶发酵条件研究[J].中南林业科技大学学报,2011,31(7):124-129.
[26] 陆 晨,陈介南,王义强,等.一株产纤维素酶真菌的筛选及产酶条件优化[J].中南林业科技大学学报,2012,32(6):118-122.
Induction and optimization of conditions for producing β-glucosidase by the improved strain Aspergillus niger C112
XIAN Tian-min, CHEN Jie-nan, ZHANG Lin
(Bio-ethanol Research Center of State Administration of Forestry, Institute of Biological and Environmental Science & Technology,Central South University of Forestry & Technology, Changsha 410004, Hunan, China)
∶ Single factor experiment method and uniform design methodology were applied to optimize the fermentation of Aspergillus niger C112 for β-glucosidase. Many factors affected the fermentation of β-glucosidase, including the inoculation method (the vitality of strains), inoculum concentration, type and concentration of carbon and nitrogen sources, fermentation time and temperature, and initial pH, et al. The results show that the seed inoculation effectively improved the strains vitality and thus raising the enzyme production capacity; One of important factors which affected the enzyme production was the carbon particle size; Higher β-glucosidase activity was obtained when corn-core particle diameter was greater than 0.180 mm; The optimal fermentation conditions were as follows: corncore 42 g/L, malt extract 18 g/L, initial pH 4.87, cultivation for 120 hours under the temperature of 30 ℃. With the optimal fermentation conditions, the ultimate β-glucosidase activity reached to 12.925 U/mL,increasing by 79.0 % than before.
∶ Aspergillus niger; fermentation β-glucosidase; optimal conditions; malt extract
S718.43;S718.52+1.3
A
1673-923X(2013)11-0154-08
2013-08-16
国家948项目“高活性纤维素酶菌株产酶优化技术引进”(2012-4-10);湖南省科技厅重点项目“木质纤维转化燃料乙醇高活性纤维素酶技术引进”(2011WK2001);国家公益性行业科研专项 “新型木本生物质能源资源培育及开发利用研究”(201004001);常德市科技局项目“木质纤维转化燃料醇高活性纤维酶技术引进”(2011GK06)
先天敏(1988-),女,四川成都人,硕士研究生,研究方向细胞生物学;E-mail:296790953@qq.com
陈介南(1961-),男,湖南安化人,教授,博士生导师,研究方向为生物能源、生物环境、生物纳米的研究;E-mail:chenjnx@gmail.com
[本文编校:吴 毅]
