四倍体泡桐对盐胁迫生理响应的差异
2013-01-05邓敏捷张晓申范国强赵振利董焱鹏
邓敏捷 ,张晓申 ,2,范国强 ,赵振利 ,董焱鹏 ,魏 振
(1. 河南农业大学 泡桐研究所,河南 郑州 450002; 2. 郑州市农林科学研究所,河南 郑州 450005)
四倍体泡桐对盐胁迫生理响应的差异
邓敏捷1,张晓申1,2,范国强1,赵振利1,董焱鹏1,魏 振1
(1. 河南农业大学 泡桐研究所,河南 郑州 450002; 2. 郑州市农林科学研究所,河南 郑州 450005)
在不同Nacl浓度(0,0.2%,0.4%,0.6%)下研究二倍体毛泡桐(T2)和二倍体豫杂一号泡桐(TF2)及其四倍体泡桐T4和TF4的生理生态响应特征,并比较四倍体泡桐及其二倍体泡桐的耐盐性。结果表明:随着盐胁迫浓度的增加,2种四倍体泡桐与其二倍体泡桐的生理生化指标变化规律一致,叶片相对含水量和叶绿素含量随盐胁迫浓度的升高呈下降趋势,四倍体泡桐的叶片相对含水量和叶绿素含量均高于其二倍体;相对电导率和丙二醛含量随盐浓度增大呈升高趋势,四倍体泡桐的相对电导率和丙二醛含量均小于其二倍体;SOD活性和可溶性蛋白质含量随盐胁迫的加强先升高后下降;可溶性糖含量和脯氨酸含量随盐浓度的增大呈升高趋势,并且四倍体泡桐高于其二倍体泡桐;对0.6%盐浓度胁迫下四倍体泡桐及其二倍体泡桐的各项生理指标利用模糊隶属函数进行抗盐性评价,抗盐性从强到弱排列为TF4>T4>TF2>T2。
四倍体泡桐;盐胁迫;生理响应
目前,全球盐碱地面积已达9.5×108hm2,我国的盐碱地面积约3.47×107hm2,并且面积还在不断扩大,严重影响了国土生态安全,已经成为重要的环境问题之一[1]。在盐胁迫下,多数植物会通过形态和生理生化等代谢途径的改变来适应该逆境条件,维持或部分维持其生理活动,保证其生长发育[2-6]。研究表明,多倍体植物对自然环境的适应能力强,四倍体植物比其二倍体植物抗逆性强[7-14]。泡桐Paulownia spp.是中国重要的速生用材和绿化树种之一,大力发展泡桐对缓解我国木材供求矛盾、改善生态环境和提高人民生活水平等具有重要的生态、经济和社会意义[15],但现有种(品种)不能在含盐量大于0.05%(pH值>8. 0)的土壤上正常生长[16]。近年来,国内外科技工作者利用理化诱变和基因工程等方法获得了猕猴桃[17]、高羊茅[18]、烟草[19]、枸杞[20]和杨树[21-26]等植物的耐盐突变体或耐盐细胞系,经选育部分植物突变体已在生产中推广应用。对泡桐来说,只是获得了豫杂一号泡桐耐盐突变体组培苗[27],至目前国内外未见其它有关泡桐盐胁迫的研究报道。为丰富泡桐种质资源,扩大其遗传背景,笔者成功创制了四倍体泡桐新种质[28-33],一方面扩大了泡桐的遗传背景,另一方面也为筛选泡桐耐盐新品种提供了材料。本文中采用盆栽法对2种四倍体及其二倍体泡桐幼苗进行盐胁迫试验研究,旨在研究2种四倍体及其二倍体泡桐对盐胁迫的生理响应差异,为四倍体泡桐大面积推广奠定坚实基础。
1 材料与方法
1.1 材料及处理
以河南农业大学泡桐研究所诱导的四倍体毛泡桐Paulownia tomentosa(T4)、四倍体豫杂一号泡桐Paulownia tomentosa × Paulownia fortunei(TF4)及其二倍体T2、TF2为试验材料,于2012年4月25日将培养30 d的T4、TF4、T2、和TF2试管苗移栽于温室内的营养钵内,30 d后将成活的幼苗栽植于直径为 30 cm、装有普通园土的营养盆内(每盆装土量一致),每盆1株。7月中旬选择生长一致的泡桐幼苗进行浓度为0(对照)、0.2%、0.4%和0.6%的NaCl胁迫试验,试验用土壤NaCl含量为0.11%(土壤NaCl重量占土壤干重的百分数)。将NaCl溶于水,分3次将盐施入盆土中,每3 d浇1次,盆底垫有托盘,渗出的水分别重新倒入其盆里。当盐水全部施入盆土后开始计时,以后每2 d浇1次水,保持盆土含水量为田间持水量的70%左右,胁迫15 d后,采集不同浓度盐处理植株新梢顶端第2对叶片,测量各项生理指标,3 次重复,取其平均值。
1.2 试验方法
泡桐叶片相对含水量测定分别参考文献[3],相对电导率和超氧化物歧化酶活性、丙二醛(MDA)、可溶性蛋白质含量、可溶性糖含量、脯氨酸含量、叶绿素含量等测定参考文献[34]。
1.3 数据处理
试验数据在SPSS16.0处理软件中进行,2种四倍体及其二倍体泡桐抗盐能力综合评定采用模糊隶属函数法[35]。
2 结果与分析
2.1 NaCl胁迫处理对泡桐叶片相对含水量和叶绿素含量的影响
由NaCl处理泡桐后泡桐叶片相对含水量和叶绿素含量的测定结果(见图1和图2)可以看出,四倍体及其二倍体泡桐叶片相对含水量和叶绿素含量均随盐胁迫程度加重而逐渐降低。此外,四倍体泡桐叶片相对含水量和叶绿素含量均大于其二倍体泡桐。在0.6%盐浓度胁迫下,泡洞叶片相对含水量和叶绿素含量最大的分别为T4(75.17%)和 TF4(3.16 mg·g-1),最小的则为 TF2(72.89%)和 T2(2.85 mg·g-1)。

图 1 盐胁迫对叶片相对含水量的影响Fig.1 Effects of salt stress on leaf relative water content

图 2 盐胁迫对叶片叶绿素含量的影响Fig.2 Effects of salt stress on leaf chlorophyll content
2.2 NaCl胁迫处理对叶片相对电导率和丙二醛含量的影响
NaCl胁迫处理对2种不同倍性泡桐叶片相对电导率和丙二醛含量影响结果(见图3和图4)表明,T2和T4及TF2和TF4叶片相对电导率和丙二醛含量均随NaCl浓度增大而增大,并且在不同NaCl浓度胁迫下,2种四倍体泡桐叶片相对电导率和丙二醛含量均小于其二倍体泡桐。在0.6%盐浓度胁迫下,叶片相对电导率和丙二醛含量最大的分别是 T2为(38.97%)和 T2(7.19 µmol·g-1),最小的则分别是 T4(37.83%)和 TF4(7.02 µmol·g-1)。

图3 盐胁迫对叶片相对电导率的影响Fig.3 Effects of salt stress on leaf conductivity
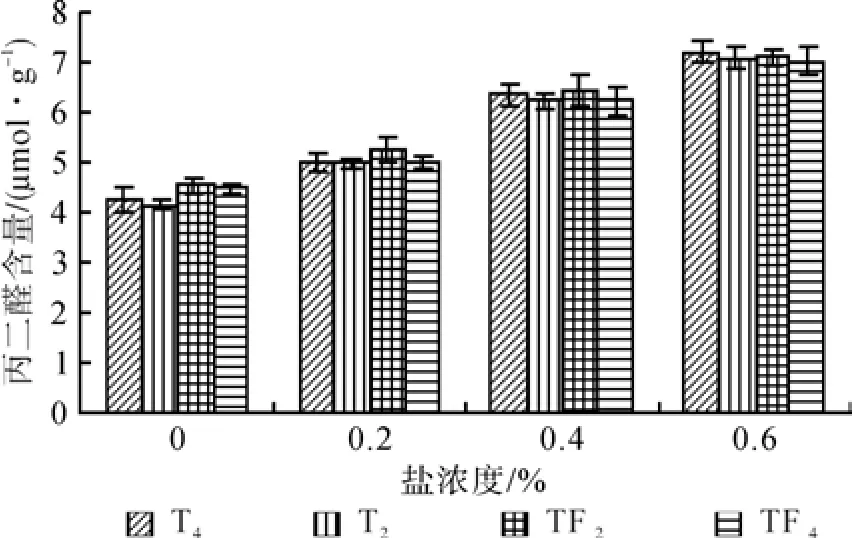
图4 盐胁迫对叶片丙二醛含量的影响Fig.4 Effects of salt stress on leaf content of MDA
2.3 NaCl胁迫处理对叶片SOD活性和可溶性蛋白质含量的影响
由NaCl胁迫处理对泡桐叶片SOD活性和可溶性蛋白质含量影响结果(见图5和图6)可以看出,随着NaCl浓度的增加,2种不同倍性泡桐叶片SOD活性和可溶性蛋白质含量均呈现先升后降的趋势。在不同NaCl浓度胁迫下,四倍体泡桐叶片SOD活性和可溶性蛋白质含量皆大于其二倍体泡桐。当NaCl浓度为0.2%时,2种不同倍性泡桐叶片SOD活性和可溶性蛋白质含量与CK相比上升幅度较小;当NaCl浓度为0.4%时,其上升幅度较大,SOD活性和可溶性蛋白质含量增幅最大的分别是TF4(80.08%)和TF4(45.18%);当NaCl浓度为0.6%时,SOD活性和可溶性蛋白质含量均有所下降,但仍分别高于CK。
2.4 NaCl胁迫处理对泡桐叶片可溶性糖和脯氨酸含量的影响
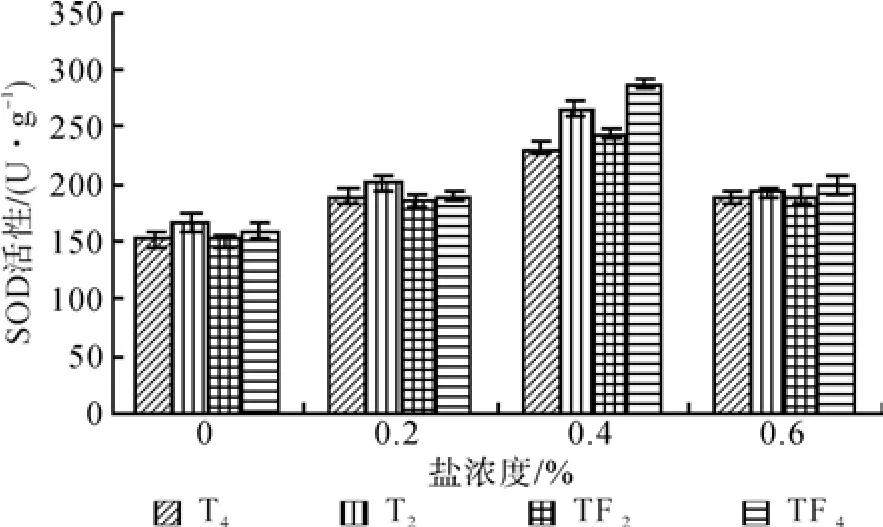
图5 盐胁迫对叶片SOD活性的影响Fig.5 Effects of salt stress on leaf SOD activity

图6 盐胁迫对叶片可溶性蛋白质含量的影响Fig.6 Effects of salt stress on content of leaf soluble protein
NaCl胁迫处理2种不同倍性泡桐叶片可溶性糖和脯氨酸含量测定结果(见图7和图8)表明,随着NaCl浓度的增大,2种四倍体及其二倍体泡桐叶片可溶性糖含量和脯氨酸含量逐渐升高,在不同浓度胁迫下,四倍体泡桐可溶性糖和脯氨酸含量均大于其二倍体泡桐。在0.6%浓度胁迫下,可溶性糖和脯氨酸含量最高的分别是T4(8.34 mg·g-1)和 T4(119.7 µg·g-1),最小的则分别是TF2(7.95 mg·g-1)和 T2(111.2 µg·g-1)。
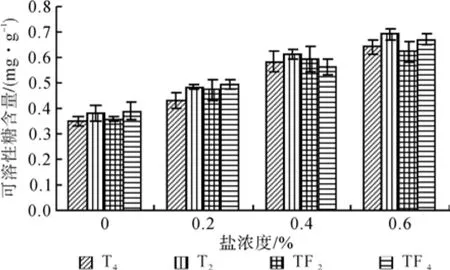
图7 盐胁迫对叶片可溶性糖含量的影响Fig.7 Effects of salt stress on content of leaf soluble sugar
2.5 四倍体泡桐耐NaCl的综合评价

图8 盐胁迫对叶片脯氨酸含量的影响Fig.8 Effects of salt stress on leaf content of proline
用0.6% NaCl处理的2种四倍体及其二倍体泡桐叶片相对含水量、质膜相对透性和SOD活性等8项指标的测定结果(见表1)进行模糊隶属函数分析,并对其耐盐性进行综合评价。结果表明,2种四倍体及其二倍体泡桐耐盐性从强到弱为TF4>T4>TF2>T2,说明四倍体泡桐耐盐性均大于其二倍体,并且TF4的耐盐性最强,T2的耐盐性最弱。
3 讨 论
盐胁迫通过改变细胞膜透性及抗氧化酶活性,增加MDA及渗透调节物含量影响植物的生长发育。高强度盐胁迫条件下,植物细胞内自由基产生与消除的平衡遭到破坏,膜脂过氧化作用增强,膜结构破坏,导致相对电导率和MDA含量升高[3-4,36-39]、含水量和叶绿素含量下降[4,40],最终导致植物的死亡。然而,通常情况下,植物会通过提高细胞内脯氨酸、可溶性蛋白质和糖含量及SOD活性维持其较低的渗透势,减轻盐胁迫对细胞的伤害,维持正常的生理代谢活动[41-42]。不同植物对盐胁迫的生理响应有一定差异[2-6],四倍体植物比其二倍体植物抗逆性强[7-14]。本试验中,2种二倍体及其四倍体泡桐对盐胁迫的响应变化趋势与前人在其它植物上取得的结果一致[43-47],但不同泡桐种耐盐的程度不同,并且同种、倍性不同的泡桐对同一浓度NaCl处理后的生理响应也存在一定差异。造成四倍体泡桐较其二倍体耐盐性强的原因,一方面可能与四倍体泡桐的基因剂量效应[9,48]和核质不平衡[49-50]有关;另一方面也可能与四倍体泡桐核DNA发生表观遗传变化有关。同时,也不排除与四倍体泡桐叶片结构的特殊性[51]有一定联系的可能性。至于四倍体泡桐较其二倍体抗旱能力的分子机理我们将在以后的文章中给予报道。

表1 四倍体及其二倍体泡桐耐盐性综合评价Table 1 Comprehensive evaluation of salt stress of tetraploid and diploid Paulownia plants
[1] 张建锋.盐碱地生态修复原理与技术[M].北京:中国林业出版社,2008.
[2] 石福臣,鲍 芳.盐和温度对外来种互花米草生理生态特性的影响[J].生态学报,2007,27(7):2733-2741.
[3] 陈健妙,郑青松,刘兆普,等.两种麻疯树苗对盐胁迫的生理生态响应[J].生态学报,2010,30(4):944-940.
[4] 张露婷,吴 江,梅 丽,等.喜树种源耐盐能力评价及耐盐指标筛选[J].林业科学,2011,47(11):66-72.
[5] Mittler R. Abiotic stress, the field environment and stress combination[J]. Trends Plant Sci., 2006,11:15-19.
[6] Pasternak T, Rudas V, Geert P, et al. Morphogenic effects of abiotic stress: reorientation of growth in Arabidopsis thaliana seedlings[J].Environmental and Experimental Botany, 2005,53: 299-314.
[7] 张 怡,沈应柏,罗晓芳.水分胁迫对四倍体刺槐苗生长和光合作用的影响[J].林业科学研究,2008,23(4):920-923.
[8] 孟凡娟,王秋玉,王建中,等.四倍体刺槐的抗盐性[J].植物生态学报,2008,32(3):654-663.
[9] Chandra A, Dubey A.Effect of ploidy levels on the activities of△1-pyrroline-5-carboxylate synthetase, superoxide dismutase and peroxidase in Cenchrus species grown under water stress[J].Plant Physiol. Biochem.,2010,48:27-34.
[10] Li W L, Berlyn G P, Ashton P S. Polyploids and their structural and physiological characteristics relative to water deficit in Betula papyrifera (Betulaceae)[J].Am. J. Bot.,1996,83:15-20.
[11] Liu S Y, Chen S M, Chen Y, et al. In vitro induced tetraploid of Dendranthema nankingense(Nakai) Tzvel.shows an improved level of abiotic stress tolerance[J].Scientia Horticulturae,2011,127:411-419.
[12] Meng H B, Jiang S S, Hua S J, et al. Comparison between a tetraploid Turnip and its diploid Progenitor (Brassica rapa L.):the adaptation to salinity stress[J].Agricultural Sciences in China,2011, 10(3):363-375.
[13] Pustovoitova T N, Eremin G V, Rassvetaeva E G, et al. Drought resistance, recovery capacity,and phytohormone content in polyploid Plum Meave[J]. Russ. J. Plant Physiol., 1996,43:232-235.
[14] Saleh B, Allarto T, Dambier D, et al. Tetraploid citrus rootstocks are more tolerant to salt stress than diploid[J]. C.R.Biologies,2008,331(9):703-710.
[15] 范国强,王安亭,王国周,等.接干和施肥对不同初植苗高泡桐幼树主干生长影响的研究[J].林业科学研究,2000,13(6):628-633.
[16] 刘元本,刘玉萃.河南森林[M].北京:中国林业出版社,2000: 210.
[17] 周立名,王 飞,王 佳.EMS诱变处理定向筛选猕猴桃耐盐突变体研究[J].西北农业学报,2009,18 (5):330-335.
[18] 韩晓光,薛哲勇,支大英,等.高羊茅胚性愈伤组织的高效诱导及其耐盐突变体筛选[J].草业学报,2005,14(6):112-118.
[19] Nabors M W,Gibbs S E,Bernstein C S.NaCl tolerant tobacco plants from culture cell[J].Z. Pflanzen physiol.,1980,97:13-17.
[20] 毛桂莲,许 兴.枸杞耐盐突变体的筛选及生理生化分析[J].西北植物学报,2005,(2):275-280.
[21] 李 玲,韩一凡.杨树耐盐突变体体筛选的研究[J].林业科学,1990,26(4):359-362.
[22] 李周歧,周志华,郭军战,等.河北杨体细胞抗盐性突变体离体筛选的研究[J].西北林学院学报,1995,10(3):1-7.
[23] 陈 丽,董举文,唐 寅,等.EMS诱变处理定向筛选杨树耐盐突变体研究[J].上海农业学报,2007,23(3):86-91.
[24] 张学彬,夏秀英,毕晓颖,等.欧美杨107耐盐转基因植株的试验[J].沈阳农业大学学报,2006,37(5):712-715.
[25] 杨春霞,李火根,程 强,等.南林895杨抗旱耐盐基因DREB1C的转化[J].林业科学,2009,45(2):17-21.
[26] Fung L E, Wang S S, ALTMAN A, et al. Effect of NaCl on growth,photosynthesis, ion and water relations of four poplar genotypes[J].Forest Ecology and Management, 1998,107:135-146.
[27] 张延召,刘 飞,范国强,等.豫杂一号泡桐耐盐突变体诱导及SSR分析[J].河南农业大学学报,2012,46(2):147-151.
[28] 范国强,曹艳春,赵振利,等.白花泡桐同源四倍体的诱导[J].林业科学,2007,43(4):30-36.
[29] 范国强,杨志清,曹艳春,等.毛泡桐同源四倍体的诱导[J].植物生理学通讯,2007,43(1):109-111.
[30] 范国强,魏真真,杨志清.南方泡桐同源四倍体的诱导及其体外植株再生研究[J].西北农林科技大学学报:自然科学版,2009, 37(10):83-90.
[31] 范国强,杨志清,曹艳春,等.秋水仙素诱导兰考泡桐同源四倍体[J].核农学报,2006,20(6):473-476.
[32] 范国强,翟晓巧,魏真真,等.豫杂一号泡桐体细胞同源四倍体诱导及其体外植株再生[J].东北林业大学学报,2010,38(12): 22-26.
[33] 赵振利,何 佳,赵晓改,等.泡桐9501体外植株再生体系的建立及体细胞同源四倍体诱导[J].河南农业大学学报,2011,45(1): 59-65.
[34] 李合生.植物生理生化试验原理和技术[M].北京:高等教育出版社,2000:134-263.
[35] 武 香,倪建伟,张华新,等.盐胁迫对3种白刺渗透调节物质的影响[J].东北林业大学学报,2012,42(1):44-47,69.
[36] 黄 鹏.盐分胁迫对香椿幼苗生长的影响[J].甘肃农业大学学报,2006,41(4): 60-63.
[37] Mittova V, Tal M, Volokita M, et al. Salt stress induces upregulation of an efficient chloroplast antioxidant system in the salttolerant wild tomato species Lycopersion pennellii but not in the cultivated species[J]. Physiol. Plant, 2002,115:393-400.
[38] Navrot N, Rouhier N, Gelhaye E, et al. Reactive oxygen species generation and antioxidant systems in plant mitochondria[J].Physiologia Plantarum,2007,129:185-195.
[39] Sreenivasulu N, Grimm B, Wobus U, et al. Differential response of antioxidant compounds to salinity stress in salt-tolerant and salt sensitive seedlings of foxtail millet (Setaria italica)[J].Physiologia Plantarum, 2000,109(4):435-442.
[40] 廖 岩,陈桂珠.三种红树植物对盐胁迫的生理适应[J].生态学报,2007,27(6):2208-2214.
[41] 汤章城.逆境条件下植物游离脯氨酸的累积及其可能的意义[J].植物生理学通讯,1984,(4):27-32.
[42] Greenway H, Munne R. Mechanisms of salt tolerance in nonhalophytes [J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1980, 31:149-190.
[43] 刘 斌,张文辉,马 闯,等.不同能源柳无性系对NaCl胁迫的生理响应[J].生态学报,2010,30(4):895-904.
[44] 王 斌,巨 波,赵慧娟,等.不同盐梯度处理下沼泽小叶桦的生理特征及叶片结构[J].林业科学,2011,47(10):29-36.
[45] 汪贵斌,曹福亮.盐胁迫对落羽杉生理及生长的影响[J].南京林业大学学报: 自然科学版,2003,27(3):11-14.
[46] 黄有军,王正加,郑炳松,等.盐胁迫下罗汉松生长和生理变化的研究[J].中南林业科技大学学报,2007,27(5):58-61.
[47] 孙孟超,尹赜鹏,马晓蕾,等.盐胁迫对欧李幼苗生理响应及离子含量的影响[J].经济林研究,2012,30(2):33-37.
[48] Niwa Y, Sasaki Y. Plant self-defense mechanisms against oxidative injury and protection of the forest by planting trees of triploids and tetraploids[J].Ecotoxicol Environ Saf,2003,55:70-81.
[49] Comai L.The advantages and disadvantages of being polyploidy [J].Nature,2005,6:836-846.
[50] Chen Z J. Molecular mechanisms of polyploidy and hybrid vigor[J].Trends Plant Sci., 2010,15:57-71.
[51] 张晓申,翟晓巧,范国强,等.四倍体泡桐叶片显微结构观察及其抗逆性分析[J].河南农业大学学报,2012,46(6):646-650.
Comparative studies on physiological responses to salt stress in tetraploid Paulownia plants
DENG Min-jie1, ZHANG Xiao-shen1,2, FAN Guo-qiang1, ZHAO Zhen-li1, DONG Yan-peng1, WEI Zhen1
(1.Institute of Paulownia, Henan Agricultural University, Zhengzhou 450002, Henan, China; 2.Zhengzhou Institute of Agricultural and Forestry Sciences, Zhengzhou 450005, Henan, China)
∶ The different physiological responses were studied by comparing their tolerances to 0, 0.2%, 0.4% and 0.6% NaCl concentrations in diploid Paulownia tomentosa (T2), Paulownia tomentosa × Paulownia fortunei (TF2) and tetraploid Paulownia T4and TF4plants. The results show that the changing trends of physiological and biochemical indexes of the leaves were consistent on the tetraploids and their dipoids with different salt concentrations; The leaf water and chlorophyll content went down with the increase of salt concentration, and the leaf water and chlorophyll content of the tetraploid Paulownia were higher than those of the diploid Paulownia; The relative conductivity and MDA content increased with the increase of salt concentration, and the tetraploids were less than the diploids; The SOD activity and soluble protein content increased first and decreased later; The soluble sugar and praline contents increased with the increase of salt concentrations, and the tetraploids were higher than the diploids; The salt resistance of Paulownia was comprehensively evaluated by subordinate function method based on the relationship between physiological-biochemical indices and salt resistance in the soil with 0.6% NaCl; The salt resistance order as followings: TF4>T4>TF2>T2.
∶ tetraploid Paulownia; salt stress; physiological response
S718.43
A
1673-923X(2013)11-0042-05
2013-04-20
河南省杰出人才基金项目(122101110700);郑州市科技创新团队资金(121PCXTD515)
邓敏捷(1980-),女,讲师,博士,主要从事立木生物技术方面的研究
范国强(1964-),男,教授,博士,主要从事立木生物技术方面的研究
[本文编校:谢荣秀]
