砷与农药草甘膦、敌敌畏对秀丽隐杆线虫的联合毒性
2013-01-03王云彪李润琴邓茗芩李铸衡徐镜波
王云彪,李润琴,邓茗芩,李铸衡,徐镜波
1.中国科学院东北地理与农业生态研究所 湿地生态与环境重点实验室,长春130102
2.吉林省电力科学研究院有限公司,长春130021
3.东北师范大学环境科学与工程系,长春130024
砷(As)是常见的致癌污染物之一,砷的毒理作用会随环境介质改变而发生变化[1]。环境中污染物的种类和数量不断增加,使得在许多类型的生态系统中以更大概率存在着一种以上的污染物[2]。随着农用化学品的大量使用,自然生态系统中存在无机污染物和农药复合污染的风险[3],土壤及地下水中由砷污染引发的环境问题已经引起人们的广泛关注,而在农田土壤和受面源污染的水体中,砷污染并非独立存在,常常伴随着砷与典型农药的复合污染[4]。农药与无机污染物的复合污染效应包括农药与无机物之间复杂的交互作用和联合毒性[5-6],其生物学响应是一个矢量[7],复合污染研究是当下环境毒理学和污染生态学研究领域的热点。
有机磷农药(organophosphate,简称Ops)是当今农药中的主要类别[8]。草甘膦(GPS)为广谱性有机磷除草剂,是世界上应用最广,产量最大的农药品种[9-10]。敌敌畏(DDVP)是一种应用最为广泛的有机磷杀虫剂,已被确认为外源性扰乱内分泌化学物质[11-12]。目前研究较多的是砷与敌敌畏的环境化学行为和单一污染毒性,已在基因和蛋白水平进行了生物标志物筛选;而草甘膦的生态风险尚待揭示[4,13]。污染物的联合暴露毒性研究从无机物之间、有机物之间的研究,扩展到现实环境中有机-无机物联合暴露毒性评价,而秀丽隐杆线虫因其遗传背景、信号转导通路清楚,行为和分子指标丰富,以及具有实践前景等优势,被越来越广泛地应用到污染物的联合暴露毒性评价研究中[14]。线虫被广泛用作环境污染的指示生物[8,15]。而秀丽隐杆线虫(Caenorhabditis elegans)已被广泛用作模式生物进行毒理学研究[16-17]。
本研究利用模式生物秀丽隐杆线虫探讨砷与典型农药复合污染的毒理作用模式,为深入和细致探讨典型无机-有机复合胁迫的毒理效应和相互作用模式,提供了模式材料和判定方法参考。
1 材料与方法(Materials and methods)
1.1 实验材料
野生型秀丽隐杆线虫(C.elegans)N2 株由美国线虫种质中心提供,使用涂有大肠杆菌(Escherichia coli OP50)的NGM 培养基,在20℃下的生化培养箱中同步化培养。用KCl 和0.051 mol·L-1NaCl)作为母液配制合理浓度的亚砷酸钠(NaAsO2,分析纯,Sigma 生产)、草甘膦(质量分数为41%的草甘膦异丙胺盐水剂,安徽丰乐农化有限责任公司生产)和敌敌畏(体积分数为77.5%的敌敌畏乳油溶液),湖南南天实业股份有限公司生产)染毒液,加于24 孔板中待用,每孔0.5 mL,每组3个平行。
1.2 LC50的计算
将秀丽隐杆线虫年轻成虫在不同浓度的染毒液中培养24 h 后计算死亡数,根据各个浓度的存活率,以直线内插法推导做出回归曲线,并计算出该毒物对秀丽隐杆线虫的24 h 半数致死浓度LC50。再按经验公式求出安全浓度:农药安全浓度=24 h-LC50×0.1。敌敌畏密度为1.415 g·L-1(25℃)。
1.3 复合胁迫方式判定
根据获得的每种毒物24 h-LC50值,将亚砷酸钠、草甘膦和敌敌畏胁迫强度分别设置为LC50值的1/5(1/5 LC50),LC50值的1/2(1/2 LC50),LC50值,作为各种毒物的浓度,计算2 种物质所需的浓度和体积配成等毒性溶液,进行亚砷酸钠与草甘膦,亚砷酸钠与敌敌畏的联合毒性效应实验;同时设置空白对照组,每个胁迫强度设置3 个重复,每一胁迫强度下放置10 条处于壮年(young adult)阶段线虫,染毒24 h 后在显微镜下观察每组线虫死亡数。综合等效应线图法、相加指数法和Finney 法[18-19],若2 种毒物单一胁迫下秀丽隐杆线虫死亡率之和大于联合毒性,即为拮抗效应;若2 种毒物单一毒性之和小于联合毒性,即为协同效应;若2 种毒物单一毒性之和等于联合毒性,则为相加作用。
1.4 数据处理
实验数据应用SPSS 12 软件分析,以平均数±标准差来表示。LC50计算中,先将胁迫浓度转换为对数值进行毒力回归分析,并统计标准偏差和变异系数。
2 结果与分析(Results and analysis)
2.1 3 种污染物对秀丽隐杆线虫单一毒性
单一胁迫下,砷、草甘膦及敌敌畏对野生型秀丽隐杆线虫N2 株的24 h 毒性分析如表1 所示。研究结果表明,这3 种毒物对秀丽隐杆线虫都表现出较强的毒性。As 表现出重金属的毒性特征,其对秀丽隐杆线虫24 h-LC50值与Pb、Cr 相近[15]。敌敌畏作为典型杀虫剂,对秀丽隐杆线虫表现出极强的毒性作用,其安全 浓度为0.47 μg·L-1,而中国(GHZB1—1999)地表水环境质量标准(I、II、III 类水域)规定敌敌畏浓度上限为0.1 μg·L-1。特别指出的是,草甘膦作为一种有机磷除草剂,对秀丽隐杆线虫的24 h-LC50为18.5 mg·L-1,表现出较强的毒性作用。在较低浓度(1.85 mg·L-1)的草甘膦胁迫下,秀丽隐杆线虫即表现出异常的行为反应。
2.2 砷与草甘膦对秀丽隐杆线虫的联合毒性
根据等毒性效应,砷与草甘膦浓度设置为1/5 LC50、1/2 LC50和LC50,观测砷与草甘膦复合胁迫对秀丽隐杆线虫的毒性效应。如果秀丽隐杆线虫实测死亡率高于理论死亡率,则表明胁迫因子的复合作用为协同效应。如图1 所示,不同浓度的砷与浓度为1/5 LC50的草甘膦联合作用下,实测秀丽隐杆线虫死亡率高于理论值,表明砷与低浓度草甘膦的联合毒性为协同作用,浓度为1/2 LC50和LC50的砷与1/5 LC50草甘膦的协同效应显著高于1/5 LC50砷与1/5 LC50草甘膦的协同效应,表明低剂量的草甘膦即可显著增强较高含量砷的毒性。中等胁迫强度的1/2 LC50草甘膦与砷的联合毒性表现出相似的规律(图2),即草甘膦与高浓度砷的协同作用大于与低浓度砷的协同作用。而在浓度为LC50的高强度草甘膦协同作用下,秀丽隐杆线虫在浓度为1/5 LC50的低强度砷染毒液中,24 h 时全部死亡(图3)。结果表明,低浓度的砷与低浓度的草甘膦协同作用不显著,低浓度的砷与高浓度的草甘膦表现出极强的协同作用,草甘膦对较高浓度的砷毒性协同作用明显。
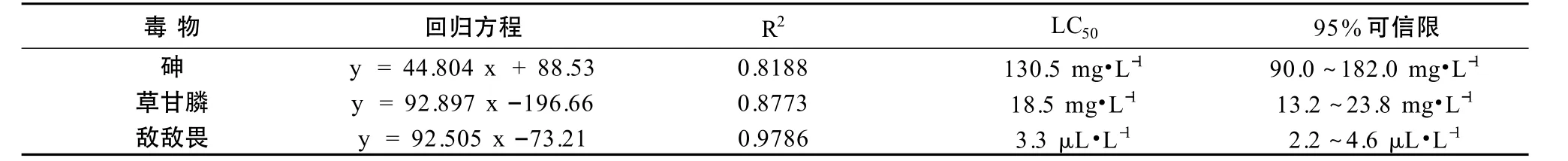
表1 砷、草甘膦及敌敌畏对秀丽隐杆线虫24 h-LC50值及其回归方程Table 1 Regression equations and 24 h-LC50 values of arsenic,glyphosate and dichlorvos to C.elegans

图1 砷与浓度为1/5 LC50的草甘膦对秀丽隐杆线虫的联合毒性Fig.1 Joint toxicity of arsenic at different concentrations and glyphosate at concentration of 1/5 LC50 to C.elegans
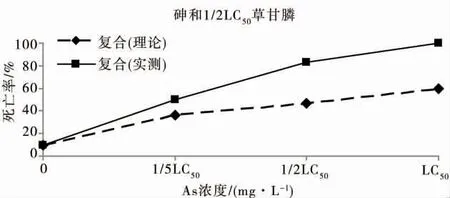
图2 砷与浓度为1/2 LC50的草甘膦对秀丽隐杆线虫的联合毒性Fig.2 Joint toxicity of arsenic at different concentrations and glyphosate at concentration of 1/2 LC50 to C.elegans
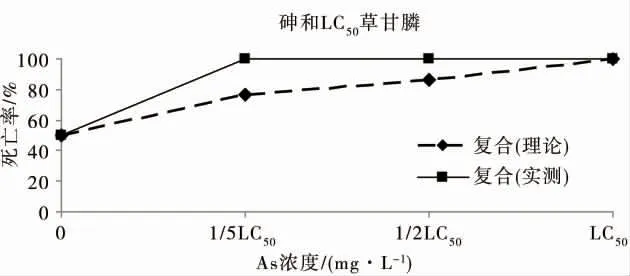
图3 砷与浓度为LC50的草甘膦对秀丽隐杆线虫的联合毒性Fig.3 Joint toxicity of arsenic at different concentrations and glyphosate at concentration of LC50 to C.elegans
2.3 砷与敌敌畏对秀丽隐杆线虫的联合毒性
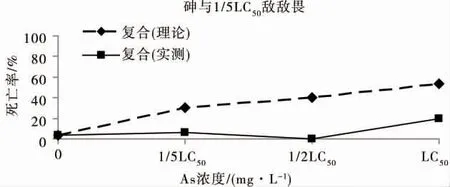
图4 砷与浓度为1/5 LC50的敌敌畏对秀丽隐杆线虫的联合毒性Fig.4 Joint toxicity of arsenic at different concentrations and dichlorvos at concentration of 1/5 LC50 to C.elegans
如图4 所示,不同浓度的砷与浓度为1/5 LC50的敌敌畏24 h 联合毒性实验中,秀丽隐杆线虫死亡率明显低于理论值,浓度为1/5 LC50的砷与1/5 LC50的复合胁迫下秀丽隐杆线虫死亡率,与浓度为1/5 LC50的敌敌畏单一胁迫下秀丽隐杆线虫死亡率相同;浓度为1/2 LC50的砷与浓度为1/5 LC50的敌敌畏联合作用下,秀丽隐杆线虫死亡率接近为零,即浓度为1/5 LC50的敌敌畏可抵消浓度为1/2 LC50的砷对秀丽隐杆线虫的毒性作用;而浓度为1/5 LC50的敌敌畏,可使浓度为LC50的砷对秀丽隐杆线虫的单一致死率由50%降低至20%。浓度为1/2 LC50的敌敌畏与砷联合作用下,对秀丽隐杆线虫的24 h 致死率维持在约20%的水平(图5),表明砷对浓度为1/2 LC50的敌敌畏的联合毒性作用接近为零;需要指出的是,浓度为1/2 LC50的砷与敌敌畏的联合作用效应略低于浓度为1/5 LC50的砷联合作用效应。如图6 所示,1/5 LC50的砷与浓度为LC50的敌敌畏对秀丽隐杆线虫的联合致死率为28%,浓度为1/2 LC50的砷与浓度为LC50的敌敌畏对秀丽隐杆线虫的联合致死率为20%,浓度为LC50的砷与浓度为LC50的敌敌畏联合作用下,对秀丽隐杆线虫的24 h 致死率约为50%,等效于敌敌畏或砷的单一毒性。
综上,砷与敌敌畏的联合毒性效应表现为拮抗作用,相同砷浓度下,这种拮抗效应随敌敌畏浓度增加而减弱;浓度为1/2 LC50的砷对敌敌畏的拮抗作用尤为显著。浓度为1/5 LC50的砷与浓度为1/2 LC50敌敌畏,浓度为1/5 LC50的砷与浓度为LC50敌敌畏,浓度为LC50的砷与浓度为1/5 LC50的敌敌畏,浓度为LC50的砷与浓度为1/5 LC50的敌敌畏,这4 个复合胁迫强度对秀丽隐杆线虫的致死率极为接近。
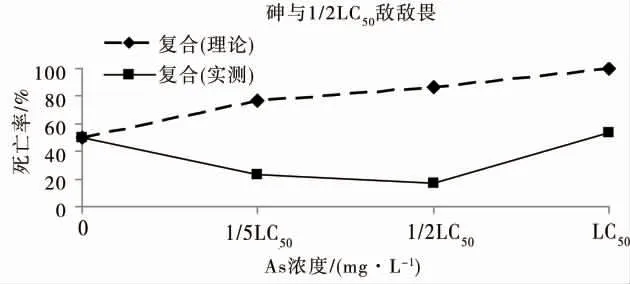
图5 砷与浓度为1/2 LC50的敌敌畏对秀丽隐杆线虫的联合毒性Fig.5 Joint toxicity of arsenic at different concentrations and dichlorvos at concentrations of 1/2 LC50 to C.elegans

图6 砷与浓度为LC50的敌敌畏对秀丽隐杆线虫的联合毒性Fig.6 Joint toxicity of arsenic at different concentrations and dichlorvos at concentration of LC50 to C.elegans
3 讨论(Discussion)
24 h 单一毒性是实验结果表明,3 种毒物对秀丽隐杆线虫的急性毒性大小排序为,砷<草甘膦<敌敌畏。尚没有证据证明砷是生命必需元素,有研究发现低剂量下砷具有兴奋作用,如砒霜作为中药的疗效作用,而在细菌中也发现了As 可具有替代必须元素(P)的生物学作用[20]。砷对秀丽隐杆线虫半数致死浓度与铅、铬相近,敌敌畏对秀丽隐杆线虫的毒性与其他生物的胁迫响应相近,表现为剧毒;而本研究结果表明,草甘膦对秀丽隐杆线虫的急性毒性大于砷,这说明草甘膦对土壤中的非靶动物存在一定的生态风险[10]。
污染物的复合作用方式和途径多种多样,包括在机体外的化学反应,在生命体内的综合作用等[6]。联合毒性实验结果表明,砷与不同有机磷农药的复合作用模式都不同,不同浓度组合的联合毒性效应和作用程度都有所差异[21]。砷与草甘膦对秀丽隐杆线虫的联合毒性表现为协同效应,草甘膦与砷并不发生直接的化学作用,但在生物体内,草甘膦对机体的胁迫压力可能会使生命体对砷的耐受性减弱,从而表现出砷的毒性作用增强。作为2 种典型有机磷农药的草甘膦和敌敌畏的生物毒理作用机制各不相同[22-23],如草甘膦可能是通过生殖相关的信号转导通路,而敌敌畏具有神经毒性。砷与敌敌畏可能发生复杂的化学作用,包括络合作用、氧化还原等[11]。梁继东和周启星[7]发现有机农药对重金属有腐蚀作用,而铜可与甲胺磷的部分功能团发生络合,其复合毒性表现为拮抗作用。三价砷被氧化或还原后毒性作用会降低,同时由于二甲基磷酸酯官能团被破坏,也使得其毒性大为减弱。敌敌畏浓度为1/2 LC50和LC50时,分别与浓度为1/5 LC50的砷的联合毒性相近,表明敌敌畏浓度变化,并不影响与砷的拮抗作用;砷浓度为LC50时,分别与浓度为1/5 LC50和1/2 LC50的敌敌畏的联合毒性作用相近,表明较低浓度的敌敌畏可显著减低较高浓度砷对秀丽隐杆线虫的毒性作用。
自然环境中往往多种毒物并存,不同污染物间的联合作用,如重金属易与有机物形成稳定的络合物,以及相同种类污染物的不同浓度组合,都会使污染物毒性较其单一毒性发生很大变化。这种联合毒性效应的判定方法有多种,本文所用的等效毒性相加法,不需复杂公式的计算,可直观有效地判定2 种毒物的复合作用模式,并且通过理论与实测曲线对比图,可大体判定2 种毒物的复合胁迫作用程度。秀丽隐杆线虫作为生命科学领域的典型模式生物,用其作为毒物联合毒性模式判定的实验材料,具有操作简易、结论精确和端点丰富的优势[7-8]。应用秀丽隐杆线虫进行复合污染模式判断,操作简单,易于观测,结果清晰可信。而线虫类群是自然界数量最丰富、分布最广的生物,已被广泛用作污染生态学领域研究的指示生物,这使得利用秀丽隐杆线虫作为环境毒理学材料,更加具有实践意义[24]。室内模拟实验和野外定位观测相结合,将是应用线虫这一自然界数量最丰富的类群进行污染物的生物监测和生态风险评价的必经途径。
[1] Christopher States J,Barchowsky A,Cartwright I L,et al.Arsenic toxicology:Translating between experimental models and human pathology[J].Environmental Health Perspectives,2011,119(10):1356-1363
[2] Wang Y,Xu J,Sheng L,et al.Field and laboratory investigations of the thermal influence on tissue-specific Hsp70 levels in common carp(Cyprinus carpio)[J].Comparative Biochemistry and Physiology Part A:Molecular&Integrative Physiology,2007,148(4):821-827
[3] Cassee F R,Groten J P,van Bladeren P J,et al.Toxicological evaluation and risk assessment of chemical mixtures[J].Critical Reviews in Toxicology,1998,28(1):73-101
[4] Hughes M F,Beck D B,Chen Y,et al.Arsenic exposure and toxicology:A historical perspective[J].Toxicology Science,2011,123(2):305-332
[5] Junghans M,Backhaus T,Faust M,et al.Application and validation of approaches for the predictive hazard assessment of realistic pesticide mixtures[J].Aquatic Toxicology,2006,76(2):93-110
[6] Spurgeon D J,Jones O A H,Dorne J C M,et al.Systems toxicology approaches for understanding the joint effects of environmental chemical mixtures[J].Science of the Total Environment,2010,408(18):3725-3734
[7] 梁继东,周启星.甲胺磷、乙草胺和铜单一与复合污染对黑土环境安全的胁迫研究[J].环境科学学报,2004,24(3):474-481 Liang J D,Zhou Q X.Single and combined pollution of methamidophos,acetochlor and copper in phaiozem and its environmental safety significance[J].Acta Scientiae Circumstantiae,2004,24(3):474-481(in Chinese)
[8] Anbalagan C,Lafayette I,Antoniou-Kourounioti M,et al.Use of transgenic GFP reporter strains of the nematode Caenorhabditis elegans to investigate the patterns of stress responses induced by pesticides and by organic extracts from agricultural soils [J].Ecotoxicology,2013,22(1):72-85
[9] 张哲,王江涛,谭丽菊.草甘膦对旋链角毛藻和盐生杜氏藻的毒性兴奋效应[J].生态毒理学报,2010,5(5):658-691 Zhang Z,Wang J T,Tan L J.Stimulation effect of glyphosate on Chaetoceros curvisetus and Dunallelia salina[J].Asian Journal of Ecotoxicology,2010,5(5):658 -691(in Chinese)
[10] Negga R,Rudd D A,Davis N S,et al.Exposure to Mn/Zn ethylene-bis-dithiocarbamate and glyphosate pesticides leads to neurodegeneration in Caenorhabditis elegans[J].NeuroToxicology,2011,32(3):331-341
[11] Ural M S,Calta M.Acute toxicity of dichlorvos(DDVP)to fingerling mirror carp,Cyprinus carpio L.[J].Bulletin of Environmental Contamination and Toxicology,2005,75(2):368-373
[12] 韩庆莉,赵志瑞,白志辉,等.敌敌畏对鲫鱼的急性毒性及类球红细菌的解毒作用[J].生态毒理学报,2009,4(6):847-853 Han Q L,Zhao Z R,Bai Z H,et al.Acute toxicity of dichlorvos to Carassius auratus and the detoxification by Rhodobacter sphaeroides[J].Asian Journal of Ecotoxicology,2009,4(6):847 -853(in Chinese)
[13] Lewis J A,Szilagyi M,Gehman E,et al.Distinct patterns of gene and protein expression elicited by organophosphorus pesticides in Caenorhabditis elegans [J].BMC Genomics,2009,10:202 -222
[14] Martinez-Finley E J,Aschner M.Revelations from the nematode Caenorhabditis elegans on the complex interplay of metal toxicological mechanisms[J].Journal of Toxicology,2011:Article ID 895-236
[15] Wilson M,Kakouli-Duarte T.Nematodes as Environmental Bioindicators[M].Wallingford:Centre for Agricultural Bioscience International UK,2009:8-26
[16] Hoss S,Jansch S,Moser T,et al.Assessing the toxicity of contaminated soils using the nematode Caenorhabditis elegans as test organism[J].Ecotoxicology and Environmental Safety,2009,72(7):1811 -1818
[17] Wang Y,Gao J,Wu D.Effects of temperature on copper resistance in daf-21 mutant and Hsp90 expression of Caenorhabditis elegans[J].Paddy Water Environment,2013,11(1-4):249 -254
[18] Tallarida R J,Porreca F,Cowan A.Statistical analysis of drug-drug and site-site interactions with isobolograms[J].Life Sciences,1989,45(11):947-961
[19] Finnery D J.Probit Analysis[M].3rd ed.London:Cambridge University,1987:22-38
[20] Wolfe-Simon F,Switzer Blum J,Kulp T R,et al.A bacterium that can grow by using arsenic instead of phosphorus[J].Science,2011,332(6034):1163-1166
[21] Evangelou M W H,Ebel M,Schaeffer A.Chelate assisted phytoextraction of heavy metals from soil:Effect,mechanism,toxicity,and fate of chelating agents[J].Chemosphere,2007,68(6):989-1003
[22] 王玉军,周东美,孙瑞娟,等.土壤中草甘膦与镉的交互作用对3 种土壤酶活性的影响[J].生态毒理学报,2006,1(1):58-63 Wang Y J,Zhou D M,Sun R J,et al.Effects of glyphosate and Cd interaction on the activities of several soil enzymes[J].Asian Journal of Ecotoxicology,2006,1(1):58-63(in Chinese)
[23] 简慧敏,姚庆祯,臧维玲,等.铜、镉、敌敌畏和甲胺磷对南美白对虾的亚急性毒性作用[J].生态毒理学报,2007,2(2):237-242 Jian H M,Yao Q Z,Zhang W L,et al.Studies on the subacute toxic effects of copper,cadmium,dichlorvos and methamidophos on Penaeus vannamei[J].Asian Journal of Ecotoxicology,2007,2(2):237 -242(in Chinese)
[24] Šalamún P,Renˇco M,Kucanová E,et al.Nematodes as bioindicators of soil degradation due to heavy metals[J].Ecotoxicology,2012,21(8):2319-2330
