活性氧损伤对园林植物幼苗叶绿素的降解效应
2012-12-29李运生
张 杰,李运生
(河南工程学院,河南 郑州 451191)
活性氧损伤对园林植物幼苗叶绿素的降解效应
张 杰,李运生
(河南工程学院,河南 郑州 451191)
以抗旱性较弱的河南海棠和抗旱性较强的山荆子的种子为试验材料,用20%聚乙二醇(PEG-6000)溶液模拟水分胁迫处理,探讨了水分胁迫下活性氧损伤对苹果幼苗叶绿素降解的效应。结果显示:(1)在水分胁迫下,·、H2O2、MDA、PMP含量均随着处理时间的延长,呈现不同程度的提高。(2)水分胁迫下,对H2O2、MDA、PMP的响应幅度为,河南海棠>山荆子。(3)、H2O2、MDA、PMP与叶绿素含量间均呈显著负相关。(4)水分胁迫下, 两种试材幼苗叶绿素含量降低,与活性氧损伤密切相关。
园林植物;水分胁迫;活性氧;叶绿素降解
水分胁迫是影响全球农业生产的重要因素之一,它也是植物在逆境条件下所发生的最为普遍的形式[1]。在发生水分胁迫的环境下,植物会随之发生相应的生理和形态变化,导致植物体内的细胞失水以及代谢失调,进而加速其衰老进程。在植物体衰老进程中,最明显的特征是叶绿素逐步降解[2]。相关研究显示,在水分胁迫、低温、高温、SO2以及衰老的进程中,叶绿素的降解与活性氧代谢有关[3]。水分胁迫条件下,由于叶绿素的降解可导致苹果属植物的衰老,但这种衰老是否也与活性氧的氧化有有关,尚未见报道。本实验以抗旱性较弱的河南海棠和抗旱性较强的山荆子的营养液水培苗为试材,进行PEG模拟干旱实验,探讨水分胁迫诱导苹果属植物衰老的生理机制。
1 材料与方法
1.1 材 料
选取河南海棠Malus honanensis(抗旱性较弱)和山荆子Malus baccata(抗旱性较强)的种子,采后经筛选和消毒后4 ℃层积处理。精选长势一致的幼苗于温室内培养[4]。当幼苗出现4片真叶时至于1/2Hoagland营养液培养一周,然后用Hoagland全营养液培养。试验期间营养液pH调至6.0,每周更换一次;温室温度白天23~28℃,夜间 18 ~ 22℃;照度 400 μmol·m-2s-1,每天恒定光照约14 h。
1.2 供试处理
实验采用20%聚乙二醇(PEG-6000,上海化学试剂一厂)溶液模拟水分胁迫处理。70 d龄幼苗移入20%PEG6000的营养液中胁迫处理,对照(CK)用不含20%PEG6000的Hoagland全营养液进行培养。
1.3 外源活性氧清除剂和促进·OH形成的预处理
在胁迫处理前1d分别用配置的下述溶液对河南海棠和山荆子 幼苗进行浸根处理,对照(CK)为dd H2O。溶液:10 mmol/L Vit E,10 mmol/L ASA,10 mmol/L甘 露 醇,10 mmol/L H2O2,10 mmol/L FeSO4,10 mmol/L H2O2+10 mmol/L FeSO4。
1.4 测定方法
取样每隔2d进行1次,早晨8:00取样,叶片取自幼苗顶端第3~5片叶[5-6];每次测定重复5次。
(1)叶绿素含量(Chl)的测定按文献[7]的方法进行。(2) O2-·含量的测定按文献[8]的方法进行。(3)H2O2含量的测定参照文献[9]的方法进行。(4)MDA含量测定按文献[10]的方法进行。(5)PMP的测定按文献[11]的方法进行。
2 结果与分析
2.1 水分胁迫对河南海棠和山荆子幼苗叶片叶绿素含量(Chl)的影响
如图1所示,不含20%PEG6000的Hoagland全营养液培养的两种试材的对照Chl含量变化幅度较为平稳。经过20%PEG6000的Hoagland营养液培养的两种试材的Chl含量呈现不同的变化。河南海棠在胁迫处理前3d, Chl含量变化平稳,在地5 d时下降幅度较大,比CK降低12.1%,到第11d时,下降幅度更大,比CK降低67.2%。而山荆子 Chl含量下降幅度较为缓慢,在胁迫的第5d和第11d分别比CK降低了7.9%和52.8%。
2.2 水分胁迫下对河南海棠和山荆子叶片·含量的影响
如图2所示,在不含20%PEG6000的Hoagland全营养液培养的两种试材的·含量差异并不十分明显。而在20%PEG6000的Hoagland全营养液培养的两种试材变化并不一致。逆境条件下,河南海棠的·含量随胁迫时间的延长呈现出逐渐上升的趋势,在处理第3d,·含量比 CK 增加了33.1%,在第11d的含量竟达到CK的1.7倍。山荆子·含量的上升幅度较为缓慢,在处理的第5 d,·含量才有一个小幅提升,比CK提高了约18.9%,在胁迫第11d的·含量是 CK 的 1.1倍。
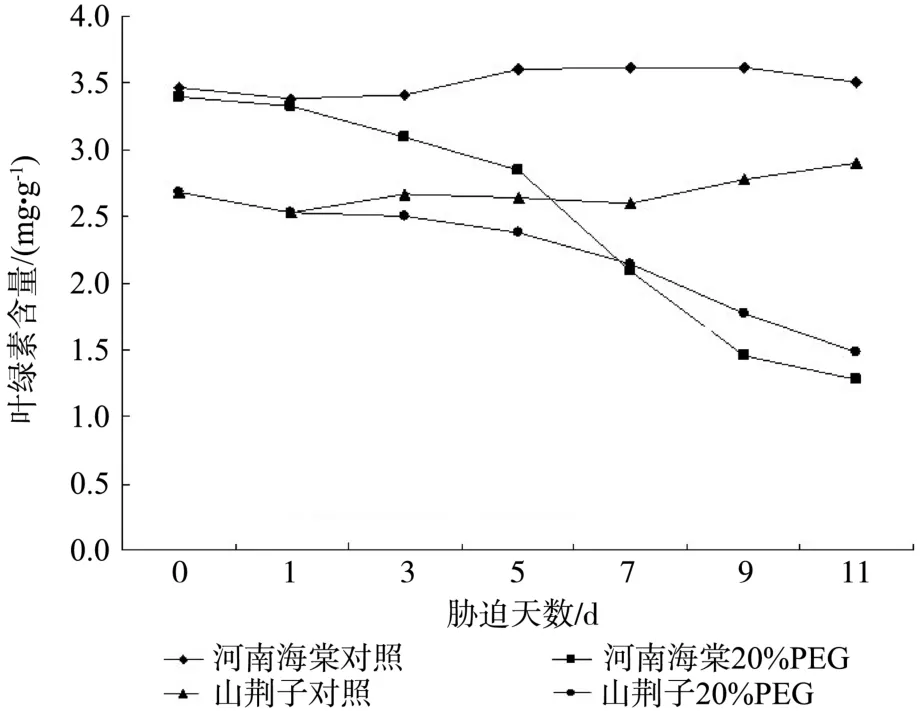
图1 水分胁迫对河南海棠和山荆子幼苗叶绿素含量的影响Fig.1Effects of water stress on chlorophyll contents of M. honanensis and M. baccata seedlings
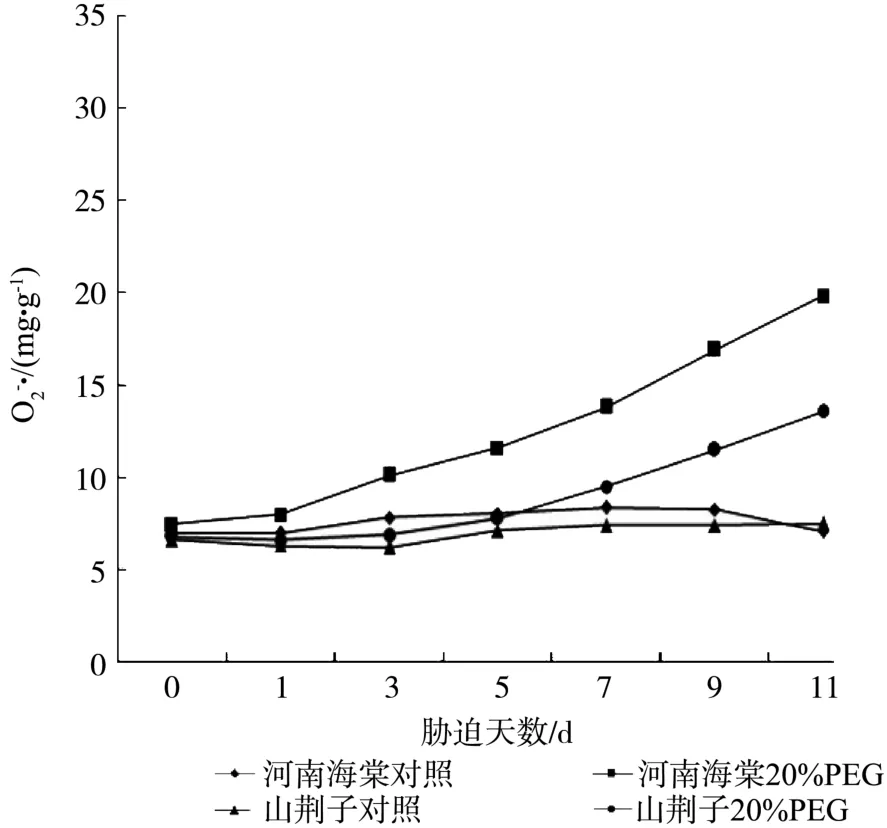
图2 水分胁迫对河南海棠和山荆子幼苗·含量的影响Fig.2Effects of water stress on · contents of M. honanensis and M. baccata seedlings
2.3 水分胁迫下河南海棠和山荆子叶片H2O2含量的变化
在不含20%PEG6000的Hoagland全营养液培养的两种试材的H2O2含量差异并不十分明显(图3)。水分胁迫下,河南海棠的H2O2含量在胁迫第5 d后,呈现大幅上升趋势,在胁迫的第5 d和第11d,分别比对照提高了43.9%和122.8%;山荆子 的H2O2含量到了胁迫第7 d,才有上升相对明显。它在胁迫的第5 d和第11d,分别比对照提高了24.9%和91.2%。
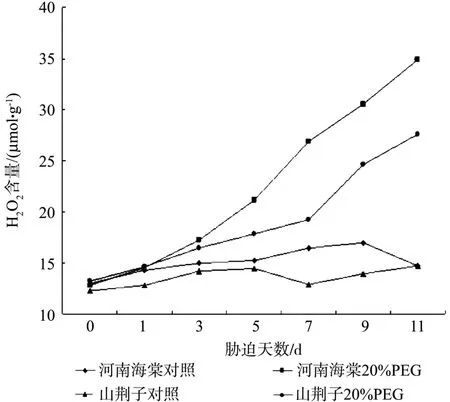
图3 水分胁迫对河南海棠和山荆子幼苗H2O2含量的影响Fig.3Effects of water stress on H2O2 contents of M. honanensis and M. baccata seedlings
2.4 水分胁迫下河南海棠和山荆子 叶片MDA含量的变化
不含20%PEG6000的Hoagland全营养液培养的两种试材的MDA含量变化幅度不明显(图4)。而在20%PEG6000的Hoagland全营养液培养的两种试材变化幅度不同。河南海棠在处理第7 d后开始大幅上升,而山荆子 到第9 d才上升明显;在胁迫的第7 d和第11d,河南海棠和山荆子 的MDA含量分别相对于CK提高了45.1%、149.2%和26.9%、103.8%。
2.5 水分胁迫对河南海棠和山荆子叶片PMP的影响
如图5所示,不含20%PEG6000的Hoagland全营养液培养的两种试材的PMP含量变化不大。水分胁迫下的河南海棠,在处理的第7 d,其叶片内PMP含量就有大幅上升,在胁迫的第7 d和第11d的PMP含量,分别比CK提高了54.9%和176.8%。山荆子 的PMP含量上升幅度不是很快,其在处理的第9 d,PMP含量才有明显提高,在胁迫的第7 d和第11d的PMP含量,分别比CK提高了36.1%和102.0%。
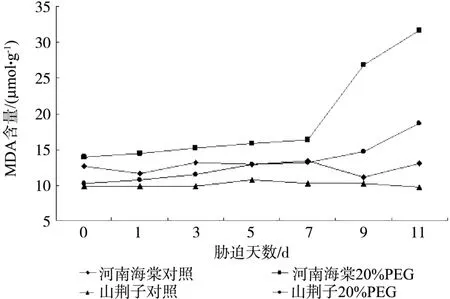
图4 水分胁迫对河南海棠和山荆子幼苗MDA含量的影响Fig.4 Effects of water stress on MDA contents of M. honanensis and M. baccata seedlings
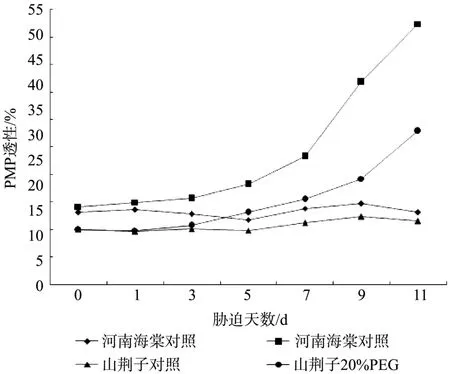
图5 水分胁迫对河南海棠和山荆子幼苗脂膜相对透性的影响Fig.5 Effects of water stress on relative permeability of lipid membranes in M. honanensis and M. baccata seedlings
2.6 叶绿素含量与·、H2O2、MDA、PMP 间的相关回归分析
由上文分析得知,各测试指标含量均随着胁迫的加剧,呈现上升的趋势。而表1显示,在水分胁迫下,·、H2O2、MDA、PMP 的含量与 Chl含量呈显著的负相关。这说明在水分胁迫环境下,叶绿素含量降低机制与活性氧的代谢失调所引发的自由基伤害机理有关[9]。
表1 水分胁迫下河南海棠和山荆子叶片·、H2O2、DA、PMP与叶绿素含量间的相关回归分析Table 1Correlation and regression analysis between O2-, H2O2, MDA, PMP and chlorophyll in M. honanensis and M. baccata leaves under water stress
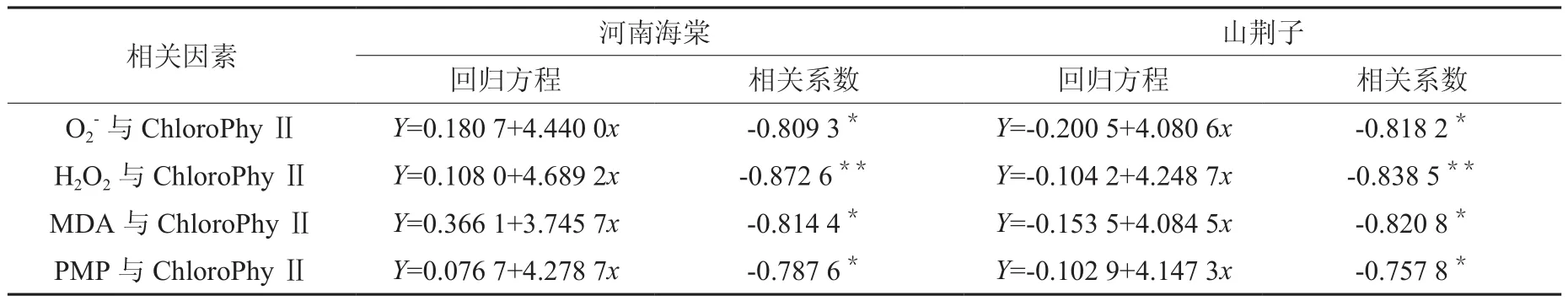
表1 水分胁迫下河南海棠和山荆子叶片·、H2O2、DA、PMP与叶绿素含量间的相关回归分析Table 1Correlation and regression analysis between O2-, H2O2, MDA, PMP and chlorophyll in M. honanensis and M. baccata leaves under water stress
相关因素 河南海棠 山荆子回归方程 相关系数 回归方程 相关系数O2-与ChloroPhyⅡ Y=0.180 7+4.440 0x -0.809 3*Y=-0.200 5+4.080 6x -0.818 2*H2O2与ChloroPhyⅡ Y=0.108 0+4.689 2x -0.8726**Y=-0.104 2+4.248 7x -0.838 5**MDA与ChloroPhyⅡ Y=0.366 1+3.745 7x -0.814 4*Y=-0.1535+4.084 5x -0.820 8*PMP与ChloroPhyⅡ Y=0.076 7+4.278 7x -0.787 6*Y=-0.1029+4.147 3x -0.757 8*
2.7 外源活性氧清除剂Vit E、ASA及甘露醇对水分胁迫两种试材MDA相对含量及叶绿素相对含量的影响
图6和图7显示:水分胁迫下,MDA含量的增加与活性氧清除剂的抑制相关联,与此同时对叶绿素的破坏也进行了抑制。因而可知,水分胁迫下叶绿素的降低与活性氧的作用有关。由图可见,MDA含量下降幅度以及叶绿素抑制程度,河南海棠>山荆子 。

图6 VitE、ASA和甘露醇对水分胁迫处理二天后河南海棠和山荆子幼苗MDA相对含量的影响Fig.6 Effects of VitE,ASA and mannite on MDA contents in M. honanensis and M. baccata seedlings after two day’s water stress treatment
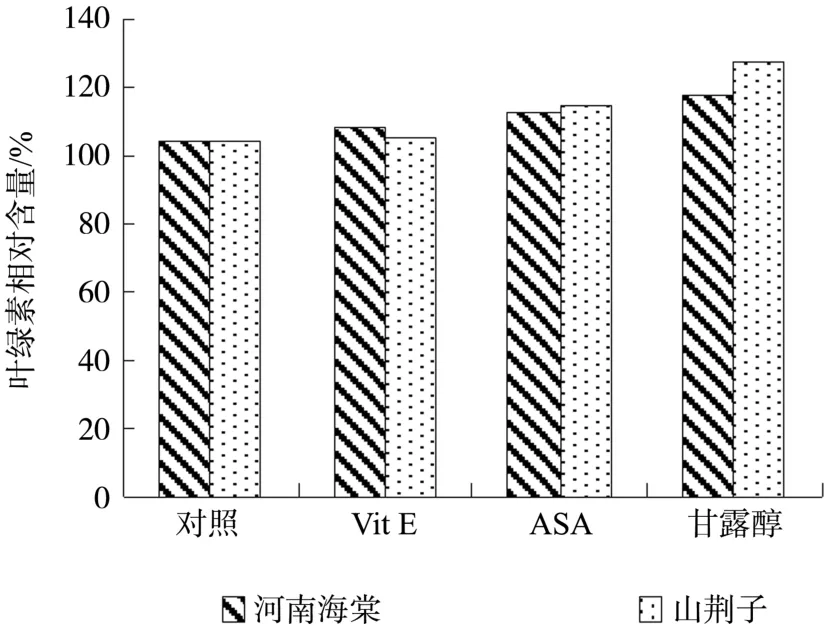
图7 VitE、ASA和甘露醇对水分胁迫处理二天后河南海棠和山荆子幼苗叶绿素相对含量的影响Fig.7 Effects of VitE,ASA and mannite on chlorophyll contents in M. honanensis and M. baccata seedlings after two day’s water stress treatment
2.8 Fe2+、H2O2和Fenton反应对水分胁迫下两种试材幼苗MDA含量和叶绿素含量的影响
文章对水分胁迫下处理的两种试材进行了预处理,外加了Fe2+、H2O2和Fenton反应。表2显示:Fe2+、H2O2都能对MDA的增加其促进作用,Fe2+的促进作用更大一些。Fe2+、H2O2的协同作用可累积更多的MDA。进而说明在水分胁迫环境下两种试材均发生了Fenton反应,从而引起叶绿素含量明显降低,其中河南海棠降幅远远高于山荆子 。
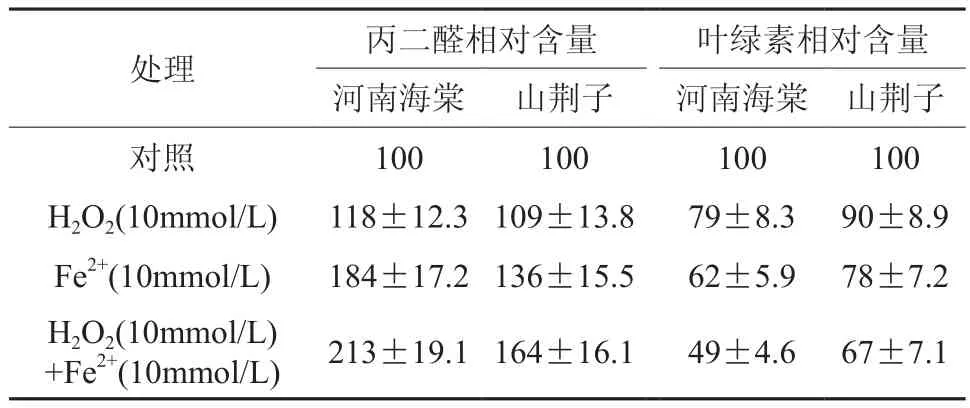
表2 H2O2、Fe2+和Fenton反应对水分胁迫二天后河南海棠和山荆子幼苗MDA和叶绿素相对含量的影响Table 2Effects of H2O2, Fe2+ and Fenton reaction on chlorophyll contents and MDA in M.honanensis and M. baccata seedlings after two day’s water stress treatment
3 讨 论
植物衰老的原发过程和真正标志那就是叶绿素的分解[12],水分胁迫环境条件下,由于氧自由基的不断增加,导致植物叶片叶绿素含量降低和衰老。而相对于生长旺盛的叶片而言,由于其本身就具有保护酶系统,例如SOD、POD、CAT等,具有较为活跃的活跃的清除活性氧的机制,通常情况下,活性氧处于一种动态平衡中。然而,在逆境环境条件下,这种平衡就会被打破,导致活性氧的累积,进而导致叶片衰老、脱落和死亡[13-14]。本实验表明,干旱条件下,·含量随胁迫时间的延长呈现出逐渐上升的趋势。河南海棠在处理第3d,·含量就快速升高,山荆子含量的上升幅度较为缓慢,在处理的第5 d,才有一个小幅提升。两种试材的H2O2含量的幅度上升的胁迫时间要比·出现的晚,河南海棠的H2O2含量在胁迫第5 d后,呈现大幅上升趋势,山荆子 的H2O2含量到了胁迫第7d,才有上升相对明显。该现象表明,在水分胁迫条件下,叶片内SOD酶活性水平随着·含量的增加而增加,而·的歧化反应就是由于SOD酶活性水平提高所诱导,这与前人研究结果相一致[15]。
[1] 王有年,杜 方,于同泉,等. 水分胁迫对桃叶片碳水化合物及其相关酶活性的影响[J]. 北京农学院学报, 2001,(4):12-15 .[2] 于同泉,秦 岭,王有年. 渗透胁迫板栗苗可溶性糖的积累及组分变化的研究[J]. 北京农学院学报, 1996,(1):21-22.
[3] 韩蕊莲,李丽霞,梁宗锁. 干旱胁迫下沙棘叶片细胞膜透性与渗透调节物质研究[J]. 西北植物学报, 2003,(1):34-36 .
[4] 米海莉,许 兴,李树华,等. 干旱胁迫下牛心朴子幼苗相对含水量、质膜透性及保护酶活性变化[J]. 西北植物学报,2003, (11):6-8.
[6] 陶大立,何兴元. 国内植物环境胁迫研究应注意的几个基本问题[J]. 生态学杂志, 2009,(1):7-9.
[7] 胡晓立,李彦慧,陈东亮,等. 3种李属彩叶植物对NaCl胁迫的生理响应[J]. 西北植物学报,2010,(2):17-18.
[8] 郑爱珍. 镉胁迫对芥蓝根系质膜过氧化及ATPase活性的影响[J]. 生态学报,2012,(2):15-17.
[9] 谢志玉,张文辉,刘新成. 干旱胁迫对文冠果幼苗生长和生理生化特征的影响[J]. 西北植物学报, 2010,(5):21-23.
[10] 常二梅,史胜青,刘建锋,等. 古侧柏种子活力与树龄的关系研究[J]. 西北植物学报, 2012,(1):7-9.
[11] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[12] 李彩凤,赵丽影, 陈业婷,等. 高等植物脂氧合酶研究进展[J]. 东北农业大学学报,2010,(10):44-46.
[13] Wang R, M Kato, F Nishikawa, et al. Initiation of senescence and metabolic changes in broccoli florets by wounding of harvested broccoli stem tissue:VII.Involvement of ethylene in senescence of harvested broccoli florets[J]. J. Japan Soc. Hort.Sci.,2001,70(2):464.
[14] 莱谢姆Y. Y等著.植物衰老过程与调控[M].沈阳:辽宁科学技术出版社,1990.
[15] Barry J Pogson, Stephen C Morris. Consequences of cool storage of broccoli on physiological and biochemical changes and subsequent Senescence at 20℃[J]. J. Amer. Soc. Hoft, Sci.,1997, 122(4):553-558.
[16] Irving D e, Baird V M. Heat production and respiration by broccoli fl orets during senescence at 20℃[J]. New Zealand Journal of Crop and Horticultural Science, 1996,24:199-202.
[17] 侯向阳. 硅对干旱胁迫下草坪草生长及抗旱性影响的研究[D].兰州:甘肃农业大学,2010.
[18] 陈少瑜,郎南军,贾利强,等.干旱胁迫对坡柳等抗旱树种幼苗膜脂过氧化及保护酶活性的影响[J].植物研究,2006,26(1):17-18.
[19] Takeuchi Y, Kubo H, Kasahara H, et a1.Adaptive alteratiosns in the actives of scavengers of active oxygen in cucumber cotyledons irradiated with UV-B[J]. Physiol,1996,147:589-592.
[20] Bowler C,Van Montagu M,Inze D.Superoxide dismutase and stress tolerance.Annual Review of Plant[J].Physiology and Plant Molecular Biology,1992,43:83-116.
[21] Nicholas S S,Quinton J C.Hydroxyl radicalscav enging activity of compatible solutes[J].Phytochemistry,1989,28:1057-1060.
[22] Zhao F Y Guo S L,Wang Z L, et a1.Recent advances in study on transgenic plants for salt tolerance[J].Journal of Plant Physiology and Molecular Biology,2003,29:171-178.
Degradation effects of active oxygen damage on garden plant seedling chlorophyll
ZHANG Jie, LI Yun-sheng
(Henan Institute of Engineering, Zhengzhou 451191, Henan, China)
With the weak drought resistance Malus honanensis and strong drought resistance Malus baccata seeds as the test materials, using 20% polyethylene glycol ( PEG-6000) solution to simulate water stress treatment, the degradation effects of active oxygen damage active oxygen damage on garden plant seedling chlorophyll have been studied. The results show that (1) under water stress, O2-·, H2O2, MDA, PMP content increased in varying degrees as the duration of treatment prolonged; (2) under water stress, the response amplitude of Henan begonia to O2-·, H2O2, MDA, PMP were larger than Malus baccata; (3) there were signif i cant negative correlation between O2-·, H2O2, MDA, PMP and chlorophyll contents; (4) under water stress, the decrease of two kinds of test materials chlorophyll content was closely related to the active oxygen damage.
landscape plants; water stress; reactive oxygen; chlorophyll degradation
S718.43
A
1673-923X(2012)09-0073-05
2012-07-10
河南省教育厅重点项目(12B220001);河南省教育厅项目(2011B220001)
张 杰(1975-),男,讲师,研究方向为园林教学与科研;E-mail:zhangjie8785@163.com
[本文编校:吴 毅]
