芝麻过敏原PCR检测方法
2012-12-28张文举许庆金邓志瑞
张文举 许庆金 邓志瑞 陈 沁
(上海大学生命科学学院,上海 200444)
芝麻过敏原PCR检测方法
张文举 许庆金 邓志瑞 陈 沁
(上海大学生命科学学院,上海 200444)
芝麻是重要的食品过敏原之一,微小剂量即可引起严重的过敏反应。针对芝麻过敏蛋白-2S白蛋白的基因序列设计PCR扩增引物,建立并优化芝麻过敏原检测的普通聚合酶链式反应(PCR)和实时荧光定量聚合酶链式反应(Realtime PCR)方法。结果表明,两种方法的最低检测限分别为0.1,0.01ng DNA,该方法特异性良好,成本较低,具有一定的应用价值。
芝麻;过敏原;聚合酶链式反应;实时荧光定量聚合酶链式反应;2S白蛋白
食物过敏(food allergy)是食物刺激有机体产生的变态反应,严重者可在几分钟内引起多种器官出现过敏反应,甚至导致个体休克或死亡[1]。发达国家每年有超过3%的成年人,6%~8%的儿童受各种过敏性疾病的困扰[2]。芝麻是常见的食物过敏原之一[3,4]。芝麻中含有多种过敏蛋白,比较重要的是:缺少硫元素的2S白蛋白(Ses i 1),富含硫元素的2S白蛋白(Ses i 2),7S球蛋白(Ses i 3)[5,6],2种油质蛋白(Ses i 4和Ses i 5)[7]以及2种11S球蛋白(Ses i 6 和 Ses i 7)[8]等。其中2S白蛋白是最主要的致敏成分[9]。
芝麻过敏已引起世界各国的关注,日本、澳大利亚和西方国家要求含有芝麻成分的食品包装上必须含有芝麻过敏标示,以防止有芝麻过敏体质的人群误食[9],因此,快速有效地检测食品中可能含有的芝麻成分是防止芝麻过敏的有效手段。目前主要检测芝麻过敏原的方法有SDS-PAGE、HPLC和HPLC-MS等[10]。这些方法直接检测过敏蛋白,但食品加工易导致蛋白质空间构象的破坏,影响检测准确性;同时有研究[11,12]证实变性后的部分蛋白可与抗体结合引起假阳性,此外,上述方法存在检测周期较长,不稳定性因素多,工作量大等缺点[13]。而食品中存在的基因组DNA更稳定且不易受食品加工的影响,因此基于基因组DNA开发的PCR技术在食品检测中的成功应用在一定程度上可解决上述问题。鉴于此,本试验针对芝麻中的主要过敏原-2S白蛋白的基因序列设计引物,建立了用于芝麻过敏原检测的PCR方法。
1 材料和方法
1.1 材料与仪器
1.1.1 材料与试剂
芝麻、花生、黄豆、黑豆、红豆、绿豆、白豆、豌豆、大麦、小麦、荞麦、燕麦、大米、小米、红米、玉米、榛子:均购自上海某超市;
dNTPs、Taq酶,10×反应缓冲液(含 Mg2+)和荧光定量反应混合液:天根生物科技(北京)有限责任公司;
乙醇、三氯甲烷:分析纯,国药集团化学试剂有限公司;
异丙醇:分析纯,中国医药集团上海化学试剂公司;
异戊醇:分析纯,上海化学试剂有限公司
氯化钠:99.9%,上海生工生物工程有限公司;
琼脂糖 VI:AB0045-100C,上海生工生物工程有限公司;
十六烷基三甲基溴化胺(CTAB),十二烷基硫酸钠(SDS):99.0%,上海生工生物工程有限公司;
三(羟甲基)氨基甲烷(Tris):99.9%,上海生工生物工程有限公司;
乙二胺四乙酸、乙酸:分析纯,上海豪申化学试剂有限公司。
1.1.2 主要仪器
电泳仪:Tanon EPS 300A,上海天能科技有限公司;
凝胶成像系统:Tanon 3500,上海天能科技有限公司;
电子天平:PB602-N,梅特勒-托利多集团;
离心机:Pico 17,德国贺利氏有限公司;
聚合酶链式反应仪:S1000Thermal Cycler,伯乐实验设备公司;
实时荧光定量聚合酶链式反应仪:ICycler Thermal Cycler(iQ5),伯乐实验设备公司。
1.2 试验方法
引物由上海生工生物工程有限公司合成;TES溶液:Tris溶液(100mM,pH=8.0),EDTA 溶液(10mM),2%SDS溶液;SEVGA溶液(氯仿∶异戊醇=24∶1);其他试剂按常规方法配制。
1.2.1 DNA的提取 芝麻DNA的提取方法参照Chen[14],Moller[15]等的方法并稍作修改:
(1)液氮中研磨种子,取0.1g于1.5mL Eppendorf管中,加入500μL TES溶液和7μL Proteinase K溶液(0.01mg/μL)混匀,置于55℃水浴锅中,水浴60~120min,期间混匀几次;
(2)取出水浴后的上述溶液,调节其盐浓度至1.4M,加入1/10体积的CTAB溶液(10%),置于65℃水浴10min;
(3)待水浴后,取出,加入等体积SEVGA温和混匀,12 000r/min离心10min,取上清;
(4)加入3μL RNase A于上清液中,37℃水浴30min;
(5)取出水浴后的溶液,加入等体积-20℃预冷的异丙醇,-20℃放置40min以上,13 000r/min离心15min,弃上清;
(6)向得到的沉淀中加入500μL 70%乙醇,悬浮洗涤后12 000r/min离心5min,去上清;
(7)加入200μL 70%乙醇于得到的上述沉淀,去上清;
(8)向得到的沉淀中加50μL双蒸水溶解,测DNA浓度和纯度,分装,低温(-20℃)保存备用。
1.2.2 引物设计 针对芝麻2S白蛋白的基因序列(FJ222624.1),运用软件Primer Primier5.0设计引物Ses F/Ses R(表1),预计PCR扩增的目的条带大小为126bp,该引物可用于普通PCR和Real-time PCR检测体系。
1.2.3 PCR反应体系和条件 普通PCR扩增总体系20μL,含 2μL PCR buffer(Mg2+plus),3.2μL dNTPs(2.5mM),2μL DNA模板,2μL引物(each 3μM),0.4μL Taq酶(2.5U/mL),10.4μL双蒸水;PCR反应条件:94℃30s,54.6 ℃ 30s,72 ℃ 15s,30个循环。扩增产物经1.5%琼脂糖凝胶电泳后,在凝胶成像系统上分析结果。
Real-timePCR扩增体系如下:2μL DNA模板,2μL引物(1.5μM),9μL荧光定量反应混合液,加双蒸水至20μL;实时荧光定量聚合酶链式反应仪反应条件:94℃ 10s,54.6℃20s,72℃20s,40个循环。试验结果由实时荧光定量聚合酶链式反应仪自带软件分析。

表1 引物序列Table 1 Primer sequences
2 结果与分析
2.1 DNA浓度对PCR扩增的影响
设定不同DNA浓度进行PCR扩增,结果见图1。由图1可知,随着DNA浓度的降低,目的条带强度越来越弱;当DNA用量为10ng时,条带亮度适中,清晰度较好;但小于10ng时,目的条带较弱。因此选定10ng作为后续试验DNA的用量。

图1 DNA含量对PCR扩增的影响Figure 1 Effect of DNA concentrations on PCR amplification
2.2 引物浓度、退火温度及循环数对PCR扩增的影响
引物浓度、循环数及退火温度对PCR扩增的影响见图2。
由图2(a)可知,随着引物浓度的降低,目的条带的强度越来越弱,在0.25μM时目的条带已经相对较弱。为保证电泳结果的清晰度,选择0.5μM作为后续试验的引物浓度。
由图2(b)可知,当循环数为25时,目的条带强度较弱;而当循环数为35时,其目的条带强度与循环数为30时相差不大。对于一般PCR扩增而言,循环数较高时相对更容易出现非特异性扩增,因此选择循环数30开展后续的试验。
由图2(c)可知,当退火温度低于54.6℃时,目的条带强度相对较强。而对于一般PCR扩增来说,相对较低的退火温度更易出现非特异性扩增。为保证扩增条带的亮度和特异性,本试验选择54.6℃作为后续试验的退火温度。
2.3 PCR扩增的特异性及灵敏度检验
以芝麻基因组DNA为阳性对照,选取其他16种常见的食品提取DNA并进行PCR扩增。由图3(a)可知,只有以芝麻DNA为模板的PCR扩增出现目的条带,其他均未出现目的条带,表明该引物具有良好的特异性。
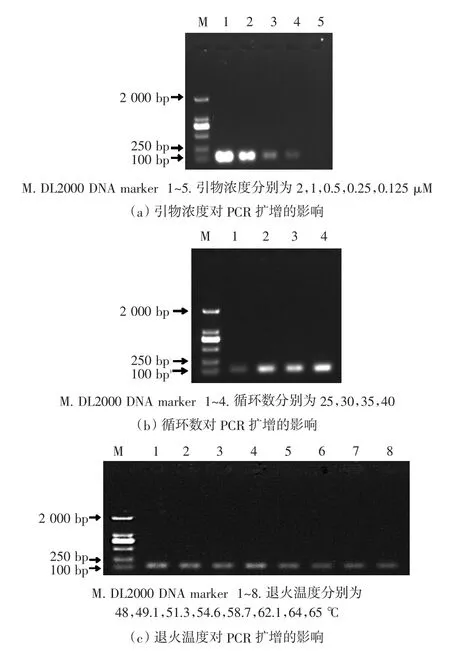
图2 引物浓度、循环数及退火温度对PCR扩增的影响Figure 2 Effect of primer concentrations,cycles and annealing temperatures on PCR amplification

图3 PCR方法的特异性及灵敏度Figure 3 Specificity and sensitivity of PCR method
在PCR扩增体系中,对10ng DNA依次进行10倍稀释,再进行PCR扩增。由图3(b)可知,随着DNA用量的降低目的条带越来越弱;大于0.1ng时均有明显的目的条带出现;而小于0.1ng时则没有清晰的目的条带。因此,本试验建立的普通PCR方法的最低检测限是0.1ng DNA。
2.4 Real-time PCR扩增体系的建立
以芝麻基因组DNA作为阳性对照,提取其他16种常见食品的DNA并进行Real-time PCR扩增。由图4(a)可知,只有芝麻基因组DNA出现了荧光扩增信号,而其他未出现荧光信号,表明该引物扩增特异性良好,适合Real-time PCR方法检测芝麻过敏原。
使用10倍稀释的芝麻 DNA(100,10,1,10-1,10-2,10-3,10-4ng)进行 Real-time PCR扩增并建立标准曲线。由图4(b)可知,在DNA含量大于0.01ng时,扩增结果具有较好的重复性,且不同浓度DNA的扩增结果线性良好,得到标准曲线的定量关系式:

式中:
y——Ct值;
x——DNA质量的自然对数值。
而当DNA含量低于0.01ng时,扩增不能得到良好的重复性,而且不能与前述结果形成良好的线性。因此,该Real-time PCR体系的检测限为0.01ng芝麻基因组DNA。
2.5 实际商品检验
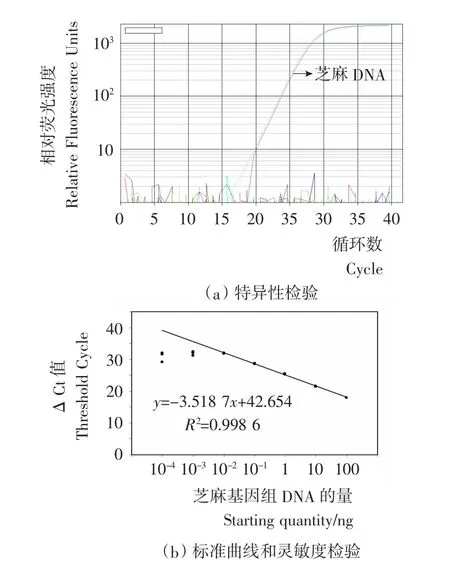
图4 芝麻DNA Real-time PCR检测体系的建立Figure 4 Establishment of the Real-time PCR method to detect sesame DNA
在优化条件后,以芝麻基因组DNA为阳性对照,提取17种市售商品的DNA并进行普通PCR和Real-time PCR扩增。由表2可知,对于标示中可能含有芝麻成分的3种饼干类食品(C1,C3,C4),普通 PCR和 Real-time PCR方法检测结果均为阳性,与标示相符;而对于所有未标示含有芝麻成分的巧克力类(C7~C12)和酱类食品(C13~C17)检测结果均为阴性,亦与标示相符。此外,在一种未标示含有芝麻成分的饼干类食品(C5)中,两种PCR方法的检测结果均为阳性,表明其含有芝麻过敏原成分,而标签中未表明这点。

表2 实际商品中芝麻过敏原的检测+Table 2 Detection of sesame allergen in commodities
3 讨论
影响PCR扩增的因素很多,本试验针对其中4个主要参数(模板DNA用量,引物浓度,循环数和退火温度)进行了优化。只有适宜的模板DNA用量和引物浓度才能得到理想的扩增条带,而过低的模板量和引物浓度会使得扩增效率低下;模板DNA过量时引物会过早耗尽,可能导致出现弥散状背景[16];过高的引物浓度倾向于形成非特异性产物,同时形成大量引物二聚体。在本试验中,当DNA用量为10ng,引物浓度为0.5μM时PCR扩增条带单一,亮度适中,可用于后续试验。退火温度对于PCR扩增的特异性和效率具有重要影响,试验结果表明在一定的温度范围内(48~65℃),扩增效果良好,而当退火温度低于54.6℃时,目的条带强度相对较强,同时考虑到较低的退火温度容易引起非特异性扩增,为了保证目的条带的亮度和PCR的特异性,选择54.6℃作为最终的退火温度。循环数对于PCR扩增的影响较为明显,本试验中,当循环数高于一定的值(大于30)时,目的条带强度差别不大,且较高的循环数更易出现非特异性扩增,综合考虑,选择30作为最终的循环数。
在运用PCR方法检测芝麻过敏原时,特异性和灵敏度是两个最重要的指标。PCR方法的特异性主要体现在引物与靶基因的专一结合,本试验所用的引物在普通PCR和Real-time PCR的特异性检验中特异性均良好,不与其他常见食品发生交叉反应,可用于芝麻过敏原的检测。由于微小剂量的芝麻过敏原即可引起患者强烈的过敏反应,因此过敏原的检测需要有较高的灵敏度[9]。本试验建立的普通PCR和Real-time PCR的检测限分别达到了0.10,0.01ng芝麻基因组DNA。较高的灵敏度使得检测食品中可能含有的极低剂量的芝麻过敏原成为了可能。在实际商品的检测中,发现大多数的检测结果与标签相符,但是在一种未标示含有芝麻成分的饼干类食品中,两种PCR方法均检测出其含有芝麻过敏原,与商品食品标签不符。因此,建立的两种PCR方法均可在日常商品的检测中有效应用。
在实际的检验工作中,可根据试验要求选择不同的方法,如对灵敏度要求相对较低则可选用价格便宜,设备要求较低的普通PCR方法,而当灵敏度要求较高时,建议使用成本相对较高的Real-time PCR方法。
1 Johansson S G,Bieber T,Dahl R,et al.Revised nomenclature for allergy for global use:report of the nomenclature review committee of the world allergy organization,October 2003[J].J.Allergy Clin.Immunol,2004,113(5):832~836.
2 Wesley B,Barbara K,Ballmer W.Food allergy[J].Mol.Nutr.Food.Res.,2006,50(7):595~603.
3 Dalal I,Binson I,Reifen R,et al.Food allergy is a matter of geography after all:sesame as a major cause of severe IgE-mediated food allergic reactions among infants and young children in Israel[J].Allergy,2002:57(4):362~365.
4 Kanny G,Hauteclocque D,Moneret-Vautrin C,et al.Sesame seed and sesame seed oil contain masked allergens of growing importance[J].Allergy,1996,51(12):952~957.
5 Krska R,Welzig E,Baumgartner S.Immunoanalytical detection of allergenic proteins in food[J].Anal.Bioanal.Chem.,2004,378(1):63~65.
6 Holzhauser T,Vieths S.Indirect competitive ELISA for determination of traces of peanut(Arachis hypogaea L.)protein in complex food matrices[J].J.Agric.Food Chem.,1999,47(2):603~611.
7 Stephan O,Vieths S.Development of a real-time PCR and a sandwich ELISA for detection of potentially allergenic trace amounts of peanut(Arachis hypogaea)in processed foods[J].J.Agric.Food Chem.,2004,52(12):3 754~3 760.
8 Kiening M,Niessner R,Drs E,et al.Sandwich immunoassays for the determination of peanut and hazelnut traces in foods[J].J.Agric.Food Chem.,2005,53(9):3 321~3 327.
9 王国政,徐彦渊.食品过敏原的安全管理[J].食品科学,2007,28(4):355~359.
10 Elide A Pastorello,Elena Varin,Laura Farioli,et al.The major allergen of sesame seeds(Sesamum indicum)is a 2Salbumin[J].Journal of Chromatography B,2001,756(1~2):85~93.
11 Kleber N,Maier S,Hinrichs J.Antigenic response of bovineβlactoglobulin influenced by ultra-high pressure treatment and temperature[J].Innovative Food Science and Emerging Technologies,2007,8(1):39~45.
12 Bugyi Z,Nagy J,TÖrÖk K,et al.Towards development of incurred materials for quality assurance purposes in the analysis of food allergens[J].Analytica Chimica Acta.,2010,672(1):25~29.
13 Arjon J van Hengel.Food allergen detection method sand the challenge to protect food-allergic consumers[J].Analytical and Bioanalytical Chemistry,2007,389(1):111~118.
14 Chen Q,Wei S S,Deng Z R,et al.Optimization of DNA extraction from seeds of sorghum sudanense(piper)stapf[J].Not.Bot.Hort.Agrobot.Cluj,2009,37(1):256~260.
15 Moller E M,Bahnweg G,Sandermann H,et al.A simple and efficient protocol for isolation of high molecular weight DNA from filamentous fungi,fruit bodies,and infected plant tissues[J].Nucleic Acids Research,1992,20(22):6 115~6 116.
16 Lahiff S,Glennon M,Lyng J,et al.Real-time polymerase chain reaction detection of bovine dna in meat and bone meal samples[J].Journal of Food Protein,2002,65(7):1 158~1 165.
Establishment of PCR method for detecting sesame allergen
ZHANG Wen-ju XU Qing-jin DENG Zhi-ruiCHEN Qin
(School of Life Sciences,Shanghai University,Shanghai200444,China)
Sesame is an important food allergen;low-level doses can cause severe allergic reactions.In this paper,PCR primers were designed based on sesame allergy protein(2Salbumin)gene sequence,and conventional PCR and Real-time PCR were established and optimized.The lowest DNA content that can be detected for conventional PCR was 0.1ng and 0.01ng for real-time PCR,respectively.The specificity of the methods is good and can be widely used.
sesame;allergen;PCR;Real-time PCR;2Salbumin
10.3969/j.issn.1003-5788.2012.02.013
张文举(1981-),男,上海大学讲师,博士。E-mail:shu_wenjuzhang@yahoo.com.cn
陈沁
2011-12-16
