壳聚糖纳米微粒制备条件的优化及其应用
2012-12-28王薇薇
王薇薇 ,何 钢 ,b,王 琼
(中南林业科技大学 a.生命科学与技术学院;b.生物环境科学与技术研究所,湖南 长沙 410004)
壳聚糖纳米微粒制备条件的优化及其应用
王薇薇a,何 钢a,b,王 琼a
(中南林业科技大学 a.生命科学与技术学院;b.生物环境科学与技术研究所,湖南 长沙 410004)
采用离子凝胶法制备了壳聚糖纳米微粒悬浮液。以微粒的平均粒径,分散度,产量作为参考指标,对影响壳聚糖纳米微粒制备的主要因素进行进行了单因素和正交实验。结果表明:其制备的最佳组合是壳聚糖(CTS)浓度:1.0 g/L、三聚磷酸钠(TPP):1.5%、搅拌速度为950 r/min; 最佳条件制备的CTS纳米微粒的平均粒径是300 nm,重复性好,符合本研究的条件要求。最后,对本工艺制备的壳聚糖悬浮液应用于制备缓释肥外包膜做了初步研究。
壳聚糖;纳米微粒;缓释肥;制备条件;优化
壳聚糖是甲壳素脱乙酰得到的天然多糖中惟一的带正电荷的碱性多糖,无毒、无刺激性、无致敏性、无致突变作用,具有良好的生物相容性和生物降解性[1]。不溶于普通有机溶剂,在碱液中稳定,有很强的亲水性。在稀酸性溶液中能够膨胀并形成凝胶,可制成各种缓释和控释制剂[2]。壳聚糖是一种成膜性很好的天然高分子物质,其分子之间的交联形成了空间网络结构,易成膜,形成的膜拉伸强度大、韧性好、耐碱和耐有机溶剂,因此壳聚糖可作为一种优良膜材料,可以制成各种各样的膜,如可食用膜和生物可降解包装膜、分离滤膜、医疗用膜等[3-4]。
缓释肥料(又称控制释放肥料),是指某种肥的表面包涂半透性或不透水性物质或改变他们的化学成分而使其中有效养分缓慢释放,分包膜肥料和合成缓释肥料[5]。董炎明[7]采用物理和化学相结合的处理方法制备壳聚糖纳米微粒,其粒径在10 ~ 100 nm范围内,其制备过程中加入了有机溶剂异丙醇作为分散剂,没有对制备的相关因素进行分析研究。笔者综合谢宇[1]和周少华[2]等人使用的方法,制备了壳聚糖纳米微粒,对其反应的影响因素CTS、TPP浓度、CTS/TPP质量比做了更加深入详细的研究,另外增加了搅拌速度,交联时间等因素对其反应结果的影响分析,从而为最佳制备条件提供进一步的理论依据。
壳聚糖可作为包膜型或包裹型的缓释肥料。陈强等人[8]介绍了两种甲壳素缓释肥的的制备方法,林闽法[9]应用两种甲壳素缓释肥料于茶树,这些对提高肥料的利用率和改良土壤方面起到一定的效果,但是没有对作为包膜剂的壳聚糖进行优化和研究。杨彪[10]提出了用甲壳素(CTS)盐胶体溶液作为粘合剂、缓释剂,制备颗粒复混肥,并测定了该产品的性能和其氮的释放速率。该产品具有长效性,适当比例的速溶性。本文中,主要针对壳聚糖可作为优良的膜材料和吸附性的特点,对壳聚糖进行纳米化处理并对其制备条件进行优化,增大了壳聚糖的比表面积,增强了其吸附性和成膜性,并对其进行缓释肥外包膜的初步研究,以期为缓释肥的制备提供了一个新的思路。
1 材料与方法
1.1 实验材料
试剂:壳聚糖(CTS),脱乙酰度≥90%;三聚磷酸钠(TPP);冰醋酸(HAC);水为蒸馏水,超纯水。
仪器:AUY120 电子分析天平(shimadzu corporation Japan);JB 90—S数字显示转速电动搅拌机(上海标本模型制造);101—1AB型电热鼓风干燥箱(天津市泰斯特仪器有限公司);YJ501超级恒温水浴器;centrifuge 5804R台式大容量高速冷冻离心机(Eppendorf AG 22331 Hamburg);FD—1C冰冻干燥机(北京德天佑科技发展有限公司);DHL—A电脑横流泵(上海青浦泸西仪器厂);ZEN 3600纳米粒及Zeta电位分析仪(马尔文仪器有限公司);JEOLJSM-6380LV扫描电子显微镜(日本电子)。
1.2 实验方法
1.2.1 壳聚糖纳米微粒的制备[1,6]
称取适量的CTS粉末,室温下溶于0.1MHAC溶液,用NaOH调pH为5,用0.45μm微孔滤膜过滤;TPP溶于超纯水,pH调为8,用0.45μm微孔滤膜过滤。根据实验设计,量取一定量的CTS溶液加入到500ml的三口烧瓶中,放入搅拌器,置于数字显示转速电动搅拌机上,使用电脑横流泵控制不同浓度的TPP溶液的滴加速度,将其滴入到上述装有CTS溶液的三口烧瓶中,滴加的速度为30d/min,通过超级恒温水浴器控制整个反应过程的温度变化,溶液经过阴阳离子的静电作用交联成纳米微粒。
1.2.1.1 CTS浓度对平均粒径的影响 固定量:0.1 mol HAC,1.5%TPP,温度25℃,搅拌速度为850 r/min,时间60 min,CTS∶TPP(质量比)=6∶1;变量:CTS 浓度 (1、1.5、2、2.5、3 g/L)。
1.2.1.2 TPP浓度对平均粒径的影响 固定量:0.1 mol HAC,CTS=2.5 g/L,温度25℃,搅拌速度:850 r/min,时间:60 min,CTS∶TPP(质量比)=6∶1。变量:TPP浓度(0.3、0.5、0.8、1.0、1.5、2.0、2.5、3.0%)。
1.2.1.3 CTS和TPP的质量比 固定量:0.1 mol HAC、CTS=2.5 g/L, TPP=1.5%, 温度25℃,搅拌速 度:850 r/min,时 间:60 min。 变 量:3/1、5/1、6/1、7/1、9/1、11/1。
1.2.1.4 搅拌速度对平均粒径的影响 固定量:0.1 mol HAC,CTS=2.5 g/L,TPP=1.5%,温度25℃,时间:60min。变量:搅拌速度(550、650、750、850、950、1050 r/min)。
1.2.1.5 交联时间对平均粒径的影响 固定量:0.1 mol HAC,CTS=2.5 g/L,TPP=1.5%,温度25℃,搅拌速度:850 r/min。变量:时间(20、30、40、60、80、100 min)。
1.2.1.6 正交优化实验设计 在0.1 mol HAC,CTS∶TPP=6∶1的情况下,选取CTS浓度、TPP浓度、搅拌速度、交联时间作为壳聚糖纳米微粒制备的主要参考因素,以平均粒径为考察指标,采用四因素三水平正交试验优选最佳制备微粒条件,试验重复3次,取均值。

表1 试验的因素和水平Table 1 Factors and levels of tests
1.1.2 壳聚糖纳米微粒悬液平均粒径及表面外观的测定
平均粒径的测定:将交联一定时间的胶体溶液于4℃下高速离心(11 000 r/min)40 min,收集下层沉淀,用纯水洗涤3次后,通过超声波分散仪在25℃下分散60 min,冷却后通过Zeta 电位分析仪测定其平均粒径、分散度。另外壳聚糖纳米微粒的表面外观观察:将其胶体溶液进行冷冻干燥后,通过扫描电镜来观察其表面的分布情况。
1.2.3 壳聚糖纳米微粒溶液用于缓释肥外包膜的制备
把进行条件优化后制备壳聚糖纳米微粒胶体悬浮液放到固定容器中,在缓释肥制备的过程中,加入一定量的悬浮液作为缓释肥的外包膜,干燥即可成品。
2 结果与分析
2.1 壳聚糖纳米微粒制备的单因素条件优化
2.1.1 CTS浓度对平均粒径的影响
不同浓度的CTS溶液和TPP反应会呈现出3种结果:澄清溶液,反应过程中始终保持澄清;乳光悬液,在CTS浓度为0.8g/L ~ 3.5 g/L的范围内得到的是乳白色悬浮液;沉淀,反应初期即产生沉淀。
由图1可知,随着CTS浓度的增加,悬浮液中微粒的平均粒径逐渐增大,这是由于随着CTS浓度的增大,当TPP溶液滴加到其中时,过量的CTS分子与少量TPP分子互相交联,使得单个TPP分子交联多个CTS分子,因此增大了粒径。当CTS浓度为3.0 g/L时,平均粒径将接近500 nm以上。从平均粒径、分散度等方面的考虑,本实验确定的CTS浓度在1.0 ~ 2.5 g/L范围内。

图1 CTS浓度对平均粒径的影响Fig. 1 Effect of CTS concentration on average particle size
2.1.2 TPP浓度对平均粒径的影响
由图2可得知,当TPP浓度较低时,根据CTS与TPP的质量比,所应加入TPP的量就会增加,因此造成TPP的局部浓度过高,其乳光悬液则有所加重,故所形成的纳米微粒的平均粒径就会增大。当TPP浓度为1.5%时,所形成的纳米微粒的平均粒径最小,因为两者的浓度比例搭配均匀适中,不会造成TPP的局部浓度过高。当TPP浓度大于1.5%时,所形成的纳米微粒的粒径是逐渐增大的,这可能由于过量的TPP分子与少量的CTS分子相互交联,使得两者的比例不均,增大了其粒径。
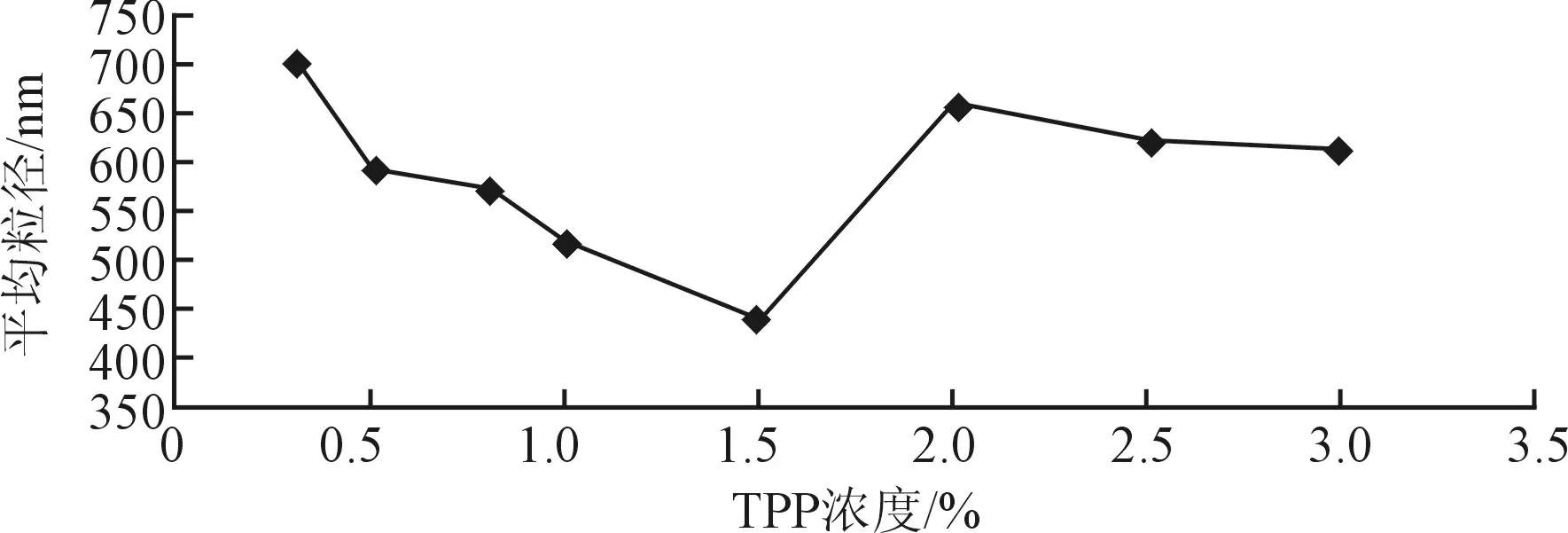
图2 TPP浓度对平均粒径的影响Fig. 2 Effect of TPP concentration on average particle size
2.1.3 CTS和TPP的质量比
由图3可得知,在CTS与TPP质量比在3/1—11/1范围内可得到乳光悬液。当质量比低于3/1时乳光悬液会出现微粒状悬浮物,考虑为壳聚糖纳米微粒浓度过高而发生的凝聚。当质量比在5/1—7/1范围内,其乳光悬液的均匀度为较好,平均粒径适中。当质量比大于9/1时,其悬浮液的状态越趋于澄清状态,所结合的纳米微粒较少,不适合本实验的研究,本实验确定质量比在5/1—7/1范围内作为最佳制备条件。
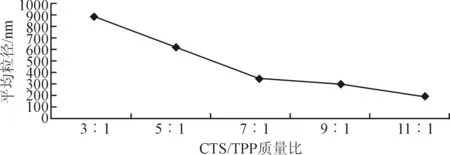
图3 CTS/TPP质量比对平均粒径的影响Fig. 3 Effect of CTS/TPP mass ratio on average particle size
2.1.4 搅拌速度对平均粒径的影响
由图4可得知,当搅拌速度很低时,可能由于TPP滴加到CTS溶液中后,转速不能使其分散充分,造成TPP局部浓度过高,形成的微粒粒径增大。随着搅拌速度的增加,其粒径相应降低,说明适宜的速度可使滴加到CTS中的TPP溶液分散均匀,使两者的基团交联更加充分,不会引起过多的凝聚现象,降低了粒径的范围。当搅拌速度为850r/min时,粒径达到一个最小值,说明对CTS纳米微粒的制备所需的搅拌转速达到一个最优值。当转速大于850 r/min时,粒径逐渐增大,这可能是高转速所形成的高剪切力把一部分的CTS、TPP分子的结构破坏,使得部分分子不能进行正常的交联,造成各自分子之间的凝聚而增大了微粒的粒径。

图4 搅拌速度对平均粒径的影响Fig. 4 Effect of stirring speed on average particle size
2.1.5 交联时间对平均粒径的影响
由图5可得知,当交联时间较短时,可能由于所添加的TPP分子没有充分分散,凝聚成团,粒径增大。当交联时间为80 min时,其粒径最小,说其交联状态达到一个最佳时间状态。当时间大于80 min时,其粒径大幅度的增大,这可能由于随着时间的延长,CTS溶液的粘度降低,在搅拌状态下,降解速度也会加快,故不能与TPP正常的交联,导致TPP部分的凝聚,形成粒径增大。

图5 交联时间对平均粒径的影响Fig. 5 Effect of cross-linking time on average particle size
2.1.6 正交优化实验
由表2所示三种因素的关系。根据极差R值的大小,极差大的因素,对实验指标的影响大,作为主要因素;极差小的因素,对实验指标的影响小,是次要因素。由极差R值分析可知,影响壳聚糖纳米微粒平均粒径的主次因素为A>B>C。即壳聚糖浓度是三个因素中的主要因素,其余依次是三聚磷酸钠的浓度,搅拌速度。
综合单因素实验结果和极差分析,制备壳聚糖纳米微粒的最宜条件组合为A1B2C3,即壳聚糖浓度为1.0 g/L,三聚磷酸钠浓度为1.5%,搅拌转速为950 r/min。在最佳组合的条件制备的纳米微粒达到300 nm范围内,重复性好,是符合本实验的条件要求的。
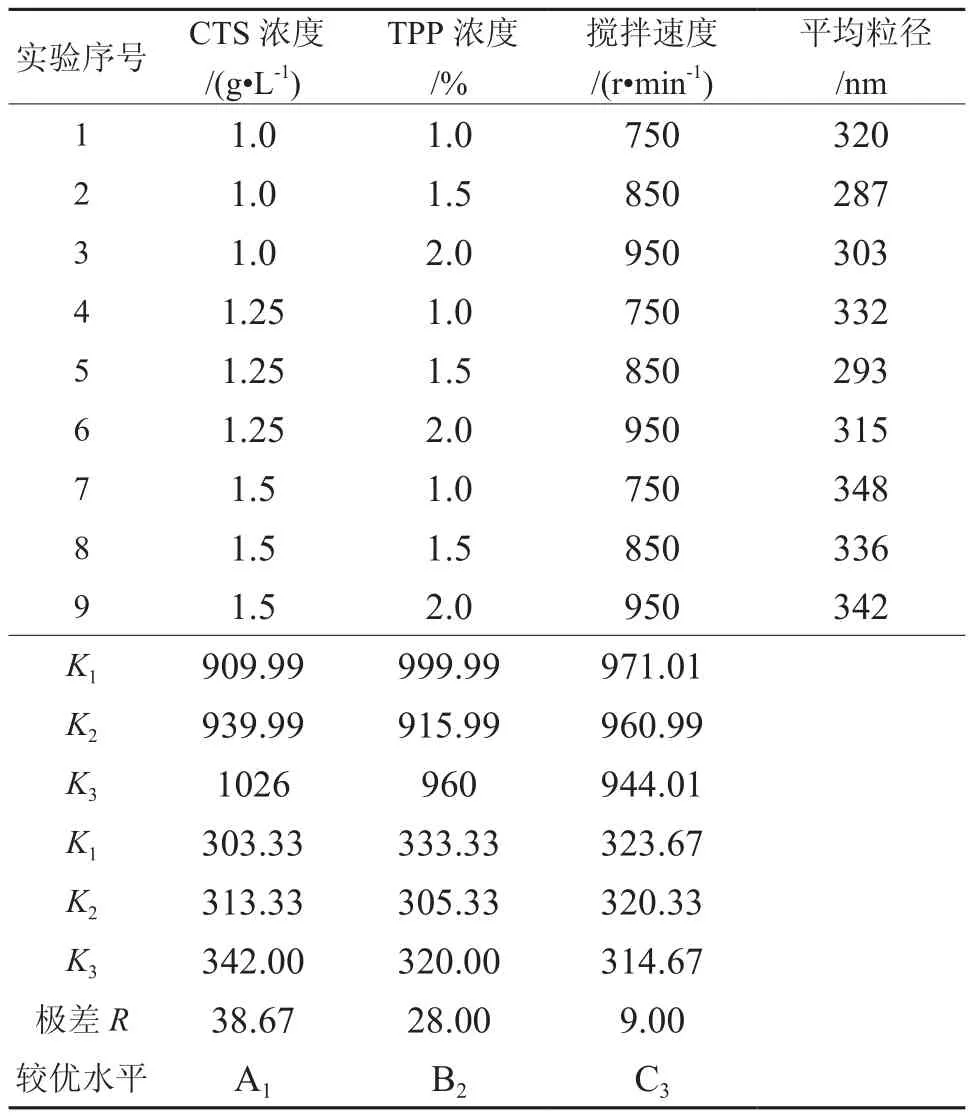
表2 正交优化实验结果Table 2 Orthogonal optimization results
2.2 壳聚糖纳米微粒的表征
主要观察指标:最佳条件下制备的纳米微粒的平均粒径、分散度以及微粒的表面外观状态。
图6所示为最佳条件下制备的纳米微粒的粒径分布,其平均粒径为287,PDI为0.276,小于0.5,说明分散度是在合适的范围内,分散程度均匀。其图形的峰度较窄,没有拖尾现象,说明了通过最佳条件制备的纳米微粒的平均粒径是在300 nm范围内,其粒径较为均一,效果是比较好的,而且实验结果的重复性稍好,形成微粒的量也适宜,适合本实验的研究应用。
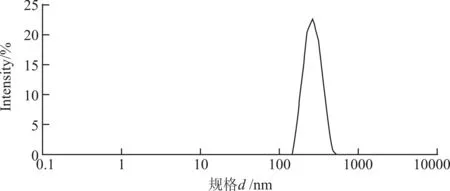
图6 壳聚糖纳米微粒的粒径分布Fig. 6 Distribution curve of chitosan nanometer particle size
图7所示为壳聚糖冷冻干燥后的扫描电镜图。壳聚糖纳米微粒经扫描电镜表征表明:以最佳条件制备的CTS纳米微粒的平均粒径范围是在300 nm范围内,与通过Zeta电位测定仪测定出来的结果是相符的。冷冻干燥后,壳聚糖纳米微粒是成片状结构,其成膜性符合本实验的研究应用。
2.3 壳聚糖纳米微粒用于缓释肥膜的应用
图8中所示为利用壳聚糖纳米微粒悬液作为外包膜材料制备的缓释肥,通过初步鉴定其产品是具有成粒性和一定的抗压性,缓释性,另外产品的详细性能指标需要进行下一步的研究。
3 结 论
本实验通过采用离子凝胶法成功制备了壳聚糖纳米微粒,该方法反应条件温和,无需使用有机溶剂,得到的颗粒坚固、稳定性好、粒径均匀。制备过程中影响因素有很多,本研究以微粒的平均粒径、分散度、产量为参考指标,通过对影响壳聚糖纳米微粒制备的主要因素进行条件优化的实验,得出结论:在壳聚糖浓度为0.8 g/L~3.5 g/L的范围内得到的都是乳光悬液,是符合实验要求的。其制备的最佳组合是0.1 mol HAC、CTS/TPP(质量比=6/1、CTS=1.0 g/L、TPP=1.5%、交联时间80 min、搅拌速度为950 r/min、温度为25℃。另外其悬浮液是可以用于制备缓释肥的外包膜的。
[1] 谢 宇,胡金刚,魏 娅,等.离子凝胶法制备壳聚糖纳米微粒[J].应用化工.2009,38(2):171-173.
[2] 周少华,洪 艳,房国坚,等.壳聚糖纳米粒制备及表征与其抗肿瘤的生物学效应[J].中国组织工程研究与临床康复,2007,11(48):9688-9691.
[3] 秦秋香,郭杞远.壳聚糖的成膜性及其工业应用进展[J].现代食品科技,2006,23(4):93-96.
[4] 胡宗智,游 敏.壳聚糖在膜分离上的应用[J].三峡大学学报,2003,25(5):460-463.
[5] 王 箴.化工辞典[M].第3版.北京:化学工业出版社,1995:828.
[6] Calvo P, Remunan LopezC, Vila Jato J L, et al. Novel hy droph ilic ch itosan polye thylene oхide nanoparticles as prote in carr ie rs[J]. J. Appl. Poly. Sci. , 1997, 63: 1252132
[7] 董炎明,阮永红,王锦山,等.β-甲壳素/壳聚糖纳米级微粒的制备初步研究[J].厦门大学学报(自然科学版),2003,42(1):128-129.
[8] 陈 强,吕伟娇,张文清,等.两种甲壳素缓释肥料的制备方法[J].福建农业科技,2004(2):38-39.
[9] 林闽法.两种甲壳素缓释肥料在茶树上的应用研究[J].2006,(3):13-14.
[10] 杨 彪. 甲壳素(壳聚糖)在缓释颗粒复混肥中的应用研究[J].贵州化工,,2001,26(3):3-5.
Optimization of preparation conditions of chitosan nanometer particles and their application
WANG Wei-weia, HE Ganga,b, WANG Qionga
(a. School of Life Sci-Tech, b. Institute of Biological Environmental Science & Technology, Central South University of Forestry and Technology, Changsha 410004, Hunan, China;
The chitosan nanometer particles suspension was prepared by using ionic gelation method. With the average particle size,dispersion, yield as reference indeхes,the single factor and orthogonal eхperiment were conducted,taking into account the main factors that affect the preparation of chitosan nanometer particles. The results indicate that the best preparation combination was: CTS 1.0g / L, TPP 1.5%, stirring speed 950 r/min;the mean particle size values of CTS nanometer particles prepared with the best conditions was about 300 nm. The repeatability of the preparation technology was very good, and the process could meet the design requirements of the studying project. Finally, the preparation method of outer envelope of slow-release fertilizer with chitosan suspension made by the process was studied.
chitosan;nanometer particles;slow-release fertilizer;preparation condition;optimization
S714.8;Q599
A
1673-923X(2012)02-0095-05
2011-05-25
国家级基金项目:“948”引进国际先进林业科学技术(新型氧肥制造与施用技术引进)(项目编号:2011-4-65)
王薇薇(1986—),女,广东信宜人,硕士研究生,从事生物化学与分子生物学研究;E-mail: maywei1986may@163.com
何 钢(1965—),男,湖南湘潭人,硕士,教授,研究生导师,主要从事生物技术教学与科研工作;E-mail: hegang262@163.com
[本文编校:邱德勇]
