八角属植物AFLP体系的建立与优化
2012-12-28潘晓芳孙雪阳黄寿先周传明陈翠湖闭冬玲
潘晓芳,孙雪阳,黄寿先,周传明,陈翠湖,闭冬玲
(广西大学 林学院,广西 南宁 530004)
八角属植物AFLP体系的建立与优化
潘晓芳,孙雪阳,黄寿先,周传明,陈翠湖,闭冬玲
(广西大学 林学院,广西 南宁 530004)
以八角属部分树种和八角品种共56个样品为试验材料,利用AFLP分子标记技术进行遗传多样性分析。采用改良的CTAB法提取总DNA,通过对酶切-连接反应、预扩增和选择性扩增反应过程中的关键因素进行优化,建立了适合八角属植物的AFLP分子标记体系。该体系应用于八角AFLP研究,能够得到高质量的总DNA和清晰的遗传标记图谱,研究结果为八角种质资源分子生物学研究提供技术支撑。
八角属;分子标记;AFLP;反应体系
八角科Illiciaceae为一单属科,仅八角属Illicium[1],全世界有34种,呈东亚—北美间断分布,主产我国西南部至东部,我国有25种[2]。八角Illicium verum Hook. f.[1]为八角科八角属重要的香料和药用植物,我国八角栽培面积和产量均占世界的85 %,主要分布在广西、云南、广东等省区[3]。采用分子标记技术对八角属植物开展遗传多样性和亲缘关系研究,对八角属植物分类和八角育种有着重要意义。
AFLP(amplified fragment length polymorphism),即扩增片段长度多态性,是荷兰Keygene公 司 Zabeau等 (1992)、Zabeau和 Vos等(1993)发展的一种新的DNA指纹技术[4-5]。其原理简单,引物设计巧妙,结合了RFLP和RAPD技术的特点,被人们普遍认为是构建遗传图谱较好的分子标记,对于植物遗传多样性的鉴定、物种亲缘关系的研究作用突出[5]。本研究应用AFLP分子标记技术对八角属植物进行遗传多样性鉴定,通过建立和优化八角AFLP体系,为八角种质资源分子生物学研究提供依据。
1 材料与方法
1.1 材料
八角试验样品分别来自广西国有派阳山林场八角基因库、国有六万林场、国有高峰林场及广东华南植物园等地,共56份,所有样品均采摘新鲜嫩叶10片左右,用封口袋密封,放入冰盒中带回实验室,置于-20 ℃冰箱中低温保存。
1.2 方法
1.2.1 DNA的提取 本试验采用改良CTAB法提取.其具体步骤如下:① 将叶片置于盛有变色硅胶干燥器内干燥,称取材料50 mg,液氮研磨3~4次,将粉末放到装有800 μL 2×CTAB提取缓冲液[100 mmol/L Tris.cl(pH=8.0),20 mmol/L EDTA,1.4 mmol/L Nacl,2 % (W/V)CTAB,40 mmol/L巯基乙醇]的2 mL离心管中;② 加入60 μL巯基乙醇混匀,60 ℃预热30 min,其间混匀2~3次,取出样品于室温放置;③ 待样品冷却到室温加入800 μL氯仿∶异戊醇(24∶1),振荡混匀,12 000 r·min-1离心15 min;④ 取上清液于一新的2 mL Ep管中加入1.5倍体积的 1×CTAB沉淀液[50 mmol/L Tris.Cl(pH=8.0),10 mmoL/L EDTA,1 % (W/V)CTAB,20 mmol/L巯基乙醇],放置20~30 min,12 000 r·min-1离心 15 min;⑤ 将沉淀晾干,溶于 200 μL TE-buffer中,再加入400 μL 95 %乙醇,20 μL 3 M NaAC, - 20 ℃沉淀 1 h,4 ℃ 12 000 r·min-1离心15 min;⑥ 再将沉淀用500 μL 75 %乙醇清洗,12 000 r·min-1离心 10 min,加入 30 ~ 50 μL TE-buffer 溶解DNA;⑦使用0.8 % 琼脂糖凝胶,在电泳缓冲液0.5×TBE中电泳检测DNA纯度、完整性和产量,电压180 V,电泳时间40 min.
1.2.2 限制性酶切及连接体系 限制性酶切及连接采用一步进行,即在0.5 mL离心管中加入对照模板DNA(浓度为50 ng/ μL)或DNA模板 n μL、Adapter 1μL、Pst I/Mse I mμL、10 XReaction buffer 2.5 μL、10 mmol ATP 2.5 μL、T4 Ligase 1 μL 以及AFLP-Water,构成共计20 μL的反应体系.混匀后离心数秒,37 ℃保温5 h,8 ℃保温4 h,4 ℃过夜.限制性酶切及连接与样品DNA用量和酶用量有关,为了确定最佳样品用量和合适的酶用量,将样品DNA模板用量设为100、200、300 ng(样品浓度为50 ng/ μL,即加入2、4、6 μL样品DNA);利用Pst I/Mse I 2种限制性内切酶进行双酶切,其用量设为1 、2 、3、4 μL共4个水平。当酶切—连接完成后,取酶切产物5 μL,加入load buffer 2 μL混合后,在0.8 % 的琼脂糖凝胶中检测酶切效果。
1.2.3 预扩增体系 该反应体系总体积为25 μL,即在0.2 ml离心管中加入模板DNA 2μL、Pre-ampmiх 1±0.5μL、dNTPs 0.5μL、10XPCR buffer 2.5μL、Taq DNA polymease 0.5μL、AFLP-Water 18.5±0.5μL.在预扩增时,选用的预扩增引物序列为Pst I预扩增引物序列5’>GAC TGC GTA CAT GCA G<3’、Mse I预扩增引物序列5’>GAT GAG TCC TGA GTA A C<3’,用量设为0.5、1.0、1.5 μL共3个梯度,以确定合适的引物用量.离心数秒后,按下列参数:变性94℃ 2 min (变性94 ℃ 30 s,复性56 ℃30 s,延伸72℃ 80 s )延伸 72℃ 5 min进行PCR扩增,循环30轮.预扩增完成后,取5 μL预扩增产物在0.8% 的琼脂糖凝胶中检测预扩增效果。
1.2.4 选择性扩增体系 反应体系总体积为25 μL,即在0.2 mL离心管中加入预扩增稀释样品2μL、10XPCR buffer 2.5μL、dNTPs 0.5μL、Pst I引物1μL (共8种)、Mse I引物1μL (共8种)、Taq酶 0.5μL、AFLP-Water 17.5 μL,混匀后,离心数秒,按下列参数PCR循环:(1)第一轮扩增参数为 94 ℃ 30 s,65℃ 30 s,72 ℃ 80 s;(2)以后每轮循环温度递减0.7℃,扩增12轮;(3)接着按下列参数扩增 23 轮 94℃ 30 s,55℃ 30 s,72℃ 80 s。产物稀释的倍数对选择性扩增效果影响很大,本研究将预扩增产物的稀释倍数设为10、20、30倍以确定适宜的稀释倍数。引物选用北京鼎国生物技术有限责任公司合成的Pst I/Mse I引物,共64种组合,经试验筛选出效果较好的几对引物组合进行选择性扩增。
2 结果与分析
通过CTAB法提取纯度高的八角基因组DNA,见图1。并按照预先的设计方案,对AFLP体系的条件进行筛选,获得了优化的AFLP反应体系,具体优化方案见表1。
通过该优化体系,成功的分析了八角种质资源的遗传多样性。从64对引物中筛选出6对扩增产物丰富的引物进行扩增,引物组合分别为:P-GAG/M-CAA、P-GAG/M-CAG、P-GTC/M-CTA、P-GTC/M-CTG、P-GTG/M-CAA、P-GTG/M-CAC.所 筛 选的6对引物共扩增得到989条带,其中多态性条带为988条,多态性比率高达99.90 %.经过体系的优化,得到了条带清晰的AFLP图谱,见图2。

图1 部分八角样品DNA检测Fig. 1 DNA detection of part of Anise samples
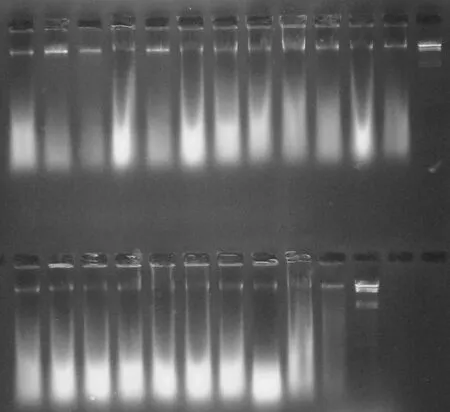
图2 部分样品的AFLP指纹图谱(P-GAG/M-CAA)Fig. 2 AFLP fingerprint of part of samples(P-GAG/M-CAA)
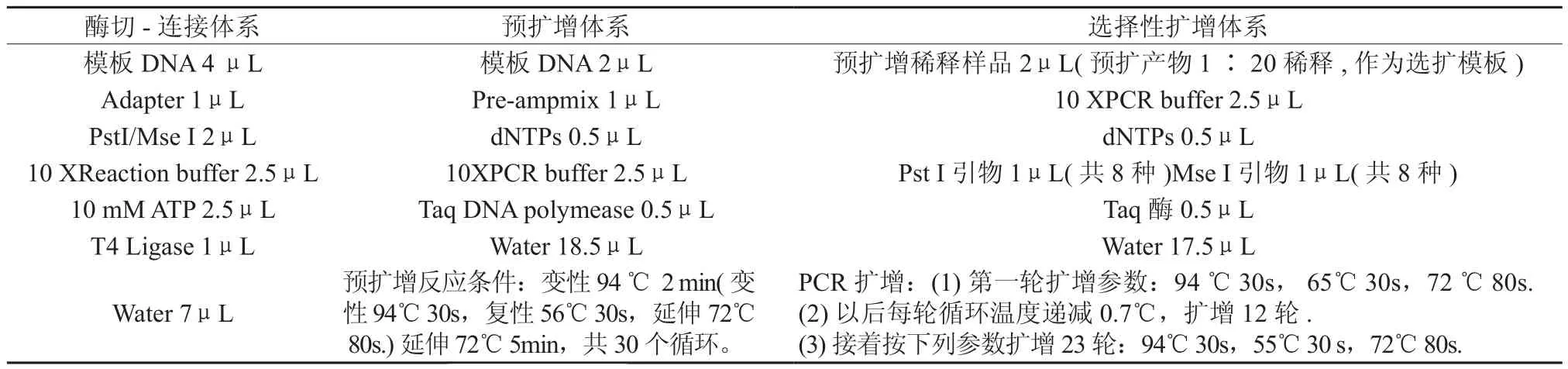
表1 酶切-连接、预扩增和选择性扩增的优化体系Table 1 The suitable systems of restriction-ligation, pre-amplification and selective amplification
3 讨 论
⑴酶切和连接通常有两步法和一步法, 理论上只要内切酶和连接酶反应温度和缓冲液合适, 两种方法都可进行。一般情况下,由于所用的限制性内切酶和连接酶要求的最适温度有所差别,所以酶切和连接两个反应一般是分开进行。本研究采用北京鼎国生物技术有限责任公司AFLP试剂盒(Pst I/Mse I型进行分析),应用一步完成的方法,有效的精简操作过程,避免了不必要的操作失误,也节省了时间,取得了很好的效果,人心果采用酶切—连接一步完成的方法[6]也收到很好的效果.
⑵引物的筛选直接影响到扩增效果,扩增的条带数过多或过少都不利于多态性的分辨和检测。进行引物筛选时,选用了3+3的引物组合,从图谱可以看出扩增效果较好,带纹清晰,分辨率高,多态性比较理想。本次试验从64对引物组合中筛选出了6对引物组合,能够全面客观的反映出56份样品的遗传多样性和亲缘关系。
⑶本试验中所表现出的极高多态性比率是一个值得商榷的问题,人心果、紫丁香也有这种现象[6-7]。过高的多态性比率往往包含有假多态性条带,这可能与物种本身有关,取样方法和分析统计方法也会影响到多态性比率,今后研究中应注意这个问题。
[1] 中国植物志编委会.中国植物志[M].北京:科学技术出版社,1996,30(1):199-231.
[2] 林 祁.八角科植物的地理分布[J].热带亚热带植物学报,1995,3(3):1-11.
[3] 黄卓民.八角[M].北京:中国林业出版社,1994,1-15.
[4] 邹喻苹,葛 颂,王晓东.系统与进化植物学中的分子标记[M].北京:北京科学出版社,2001,9-29,108-122.
[5] Vos P,Hogem R,Bleeder M,et a1.AFLP:a new technique for DNA finger printing[J].Nucleic Acids Research,1995,23(21):4407-4414.
[6] 文亚峰,谢碧霞,何 钢.人心果AFLP反应体系的建立与优化[J].经济林研究,2008,26(2):35-38.
[7] 明 军,顾万春.紫丁香天然群体遗传多样性的AFLP分析[J].园艺学报,2006,33(6):1269-1274.
Establishment and optimization of AFLP technical system for Illicium
PAN Xiao-fang, SUN Xue-yang, HUANG Shou-хian, ZHOU Chuan-ming, CHEN Cui-hu, BI Dong-ling
( Forestry College, Guangхi University, Nanning 530004, Guangхi,China )
By taking 56 samples of Illicium species and Illicium verum Hook. f. varieties as testing materials, and using AFLP molecular markers technology, the species and varieties’ genetic diversity were analyzed. The total DNA of the species and varieties were eхtracted adopting the improved CTAB, and the AFLP molecular markers system that is suitable for Illicium plants was established.Through applying the system to study Illicium plants, high quality total DNA and clear genetic markers map were obtained. The results provide technical support for studying molecular biology of Anise germplasm resources.
Illicium; molecular marker; AFLP; reaction system
S794
A
1673-923X(2012)02-0086-03
2011-09-12
广西科学基金项目“八角种质资源的分子鉴别及遗传特性分析(桂科基0639008)”
潘晓芳(1963—),男,壮族,广西武鸣人,副教授,博士研究生,硕士生导师,主要从事经济林栽培与良种选育教学与研究;E-mail:gхpхf9460@sina.com
[本文编校:邱德勇]
