番茄高效再生体系的建立
2012-12-26刘红霄杨松烨
仇 燕,刘红霄,杨松烨
(河北科技大学生物科学与工程学院,河北石家庄 050018)
番茄高效再生体系的建立
仇 燕,刘红霄,杨松烨
(河北科技大学生物科学与工程学院,河北石家庄 050018)
以砧木1号番茄的子叶和下胚轴为外植体进行离体组织培养,研究了IAA和6-BA及NAA和6-BA不同激素配比对外植体诱导不定芽及生根的影响。结果表明:培养基MS+0.2 mg/L IAA+1.0 mg/L 6-BA为诱导子叶外植体愈伤组织和不定芽的最适培养基,而 MS+0.5 mg/L IAA+1.0 mg/L 6-BA为诱导下胚轴外植体愈伤组织和不定芽的最适培养基;诱导不定芽生根的最佳培养基为 MS+0.1 mg/L IAA。
番茄;子叶;下胚轴;植株再生
番茄作为一种重要的蔬菜作物和模式经济作物已受到众多研究者的关注,番茄转基因的研究是当前植物基因工程研究的热点之一,番茄的广泛栽培和它在遗传理论上的深入研究,为基因工程拓宽资源打下了坚实基础[1]。作为影响基因转化成功与否的关键因素之一,建立高频再生体系的研究一直很受重视[2]。
本试验选用砧木1号番茄种子,比较了不同杀菌剂和杀菌时间对番茄种子萌发的影响,确定了最佳杀菌剂及杀菌时间,并且以番茄无菌苗的下胚轴和子叶作为外植体,通过对不同激素浓度配比进行试验,筛选出能够高效诱导番茄外植体直接分化不定芽和诱导不定芽生根的培养基,建立了一套高效的番茄植株再生体系,以期为进一步的番茄转基因和功能基因组学的研究奠定基础。
1 材料与方法
1.1 试验材料与培养基
砧木1号番茄种子由本实验室保存。培育无菌苗使用含有去离子水的棉花基质;诱导培养基以MS为基本培养基,含有蔗糖质量浓度30 g/L、琼脂质量浓度8 g/L,添加不同种类和浓度的激素,调节p H值至5.8。配制好的培养基于120℃高温灭菌20 min。
1.2 试验方法
1.2.1 种子的处理
选取籽粒饱满的健康种子置于锥形瓶中,无菌水冲洗1次,70%(体积分数,下同)酒精处理20 s后分别用0.05%~0.1%(质量分数)的氧化汞和10%(质量分数)的NaClO消毒,后用无菌水冲洗种子7遍。
1.2.2 无菌苗的培养
灭菌后的种子接种于棉花培养基上,25℃条件下(以下试验都是在该温度条件下进行)黑暗培养,5 d后计算发芽率,然后转至光照周期14 h/d,光照度为2 000 lx的条件下培养,待幼苗子叶完全展开时备用。
1.2.3 外植体的准备
取培养约10 d的无菌苗,将子叶两端及叶边缘切除,中间部分横向切成2段,再在叶块中间划2处伤口;下胚轴剪成8 mm左右的切段。将切好的外植体接种在不同质量浓度的附加IAA(0.1 mg/L,0.2 mg/L,0.5 mg/L)和6-BA(0.5 mg/L,1.0 mg/L,2.0 mg/L)及 NAA(0.1 mg/L,0.2 mg/L,0.5 mg/L)和6-BA(0.5 mg/L,1.0 mg/L,2.0 mg/L)的 MS培养基上,每种培养基接种子叶和下胚轴各10块,每个处理设3个重复。黑暗培养7 d后,转移至14 h/d光照周期条件下培养,28 d后统计外植体的出愈率和不定芽的分化率。外植体的出愈率=(诱导愈伤组织外植体数/接种外植体数)×100%,不定芽的分化率=(分化不定芽的外植体数/接种外植体数)×100%。
1.2.4 生根培养
待不定芽长至2 cm左右时,切除不定芽基部的愈伤组织和培养基,将不定芽转接到含有不同质量浓度的IAA(0.05 mg/L,0.1 mg/L,0.2 mg/L,0.5 mg/L)或 NAA(0.05 mg/L,0.1 mg/L,0.2 mg/L,0.5 mg/L)的生根培养基中,进行生根培养。每种培养基中接种不定芽8块,每个处理设3个重复,10 d后统计不同质量浓度IAA或NAA培养基中不定芽的生根率。生根率=(生根幼芽数/接种幼芽数)×100%,同时观察根的形态。
2 结果与分析
2.1 不同灭菌剂和灭菌时间对番茄种子灭菌及萌发的影响
NaClO处理过的种子表皮褪色变白,由表1可见,不同灭菌时间对种子的萌发影响不大,但是4~6 min处理后有少量霉菌污染;氯化汞处理过的种子较NaClO处理后的种子萌发晚且萌发率低,并且随着氯化汞杀菌浓度的增大,时间的增长,种子的萌发率明显降低,说明氯化汞处理对种子的萌发有一定的抑制作用。试验表明,最佳灭菌条件为70%酒精处理20 s后NaClO处理7 min。
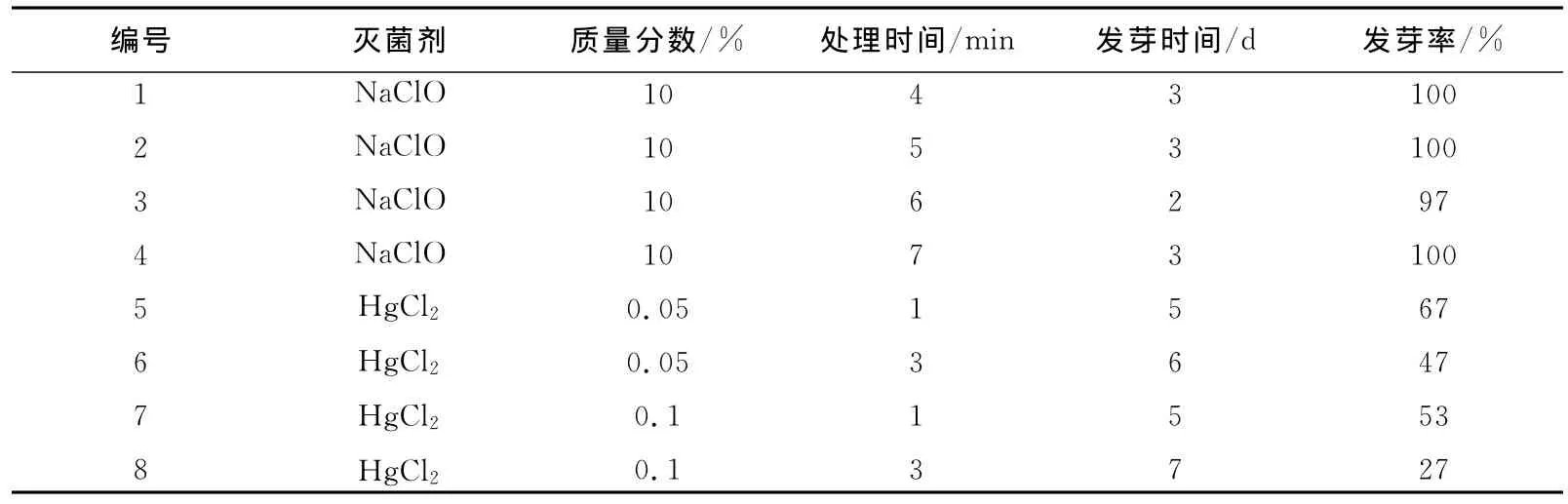
表1 不同灭菌条件对种子萌发的影响Tab.1 Effects for seeds germination with different sterilization condition
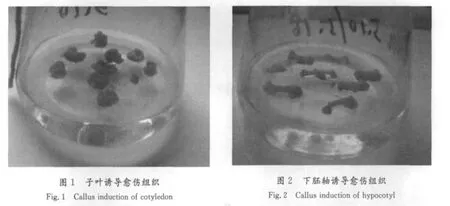
2.2 不同激素配比对番茄愈伤组织和不定芽诱导的影响
外植体接种5 d后,伤口处膨大,开始形成愈伤组织(见图1和图2);13 d后,子叶外植体开始出现芽点并逐渐长成不定芽;18 d后,下胚轴开始出现芽点,不定芽开始生长(见图3)。本试验选用NAA与6-BA的激素组合可以诱导外植体愈伤,但是诱导不定芽分化的效率却极低,只能达到20%左右,且分化形成畸形芽较多,不能生长成完整植株。
由表2可见,在IAA与6-BA激素组合中,子叶与下胚轴出愈率相差不大。在不同激素浓度的培养基中,子叶外植体和下胚轴外植体的出愈率都在90%以上,下胚轴总体出愈率虽略低于子叶,但差异不明显,在6-BA质量浓度为1.0 mg/L时,下胚轴和子叶的出愈率都达到100%,说明该质量浓度的6-BA最有利于愈伤的诱导。不同外植体诱导愈伤和不定芽分化的最佳激素配比并不相同:诱导子叶生芽的最佳激素组合是IAA(0.2 mg/L)+6-BA(1.0 mg/L),出芽率高达97%;诱导下胚轴生芽的最佳激素组合是IAA(0.5 mg/L)+6-BA(1.0 mg/L),出芽率达到77%。相同激素组合中,子叶与下胚轴分化不定芽的能力相差甚远,子叶作为外植体均比下胚轴诱导再生芽的效率高,特别是在本试验的最优条件下(子叶在5号培养基,下胚轴在6号培养基)子叶的出芽率比下胚轴高20%。

表2 不同激素配比对番茄愈伤组织和不定芽诱导的影响Tab.2 Effects of different combination of hormone concentration on tomato callus and buds induction
2.3 不同激素及浓度对番茄外植体生根的影响
待培养的幼芽长到2 cm左右且具有2-3个叶片时,切除不定芽下的愈伤组织,将不定芽转接到不同浓度的IAA或NAA生根培养基中诱导生根(图4)。试验发现,加入IAA的培养基比加入NAA的培养基更有利于番茄不定芽的生根诱导,不仅生根时间短,再生根也比较粗壮。由表3可见,当IAA质量浓度为0.05 mg/L时,诱导的主根较细;质量浓度为0.1 mg/L时,诱导的主根较粗且根系发达、须根多,再生苗也较高;质量浓度为0.2 mg/L时,根系依旧很发达,但再生苗高度比0.1 mg/L时低;质量浓度为0.5 mg/L时,根系较弱,基本无须根,并且生根率明显低于其他浓度。这种变化说明适当提高IAA浓度有利于不定芽的生根,但是超过一定质量浓度后,反而会抑制根的发生。故笔者认为0.1 mg/L为诱导不定芽生根的最佳IAA质量浓度。
待番茄幼苗生长到6~8 cm,根长为5~6 cm时,打开锥形瓶封口膜,在锥形瓶中注入约0.5 cm水后转移到培养箱中进行驯化培养,培养箱温度为白天24℃夜间18℃,光照周期为14 h/d(见图5)。2~3 d后,从锥形瓶中取出小苗洗去根部培养基防止细菌滋生,将再生植株转移到注入1 cm水的锥形瓶中,室温(20~25℃)下生长。4 d后,移栽到营养土中(见图6),移栽成活率达到100%。

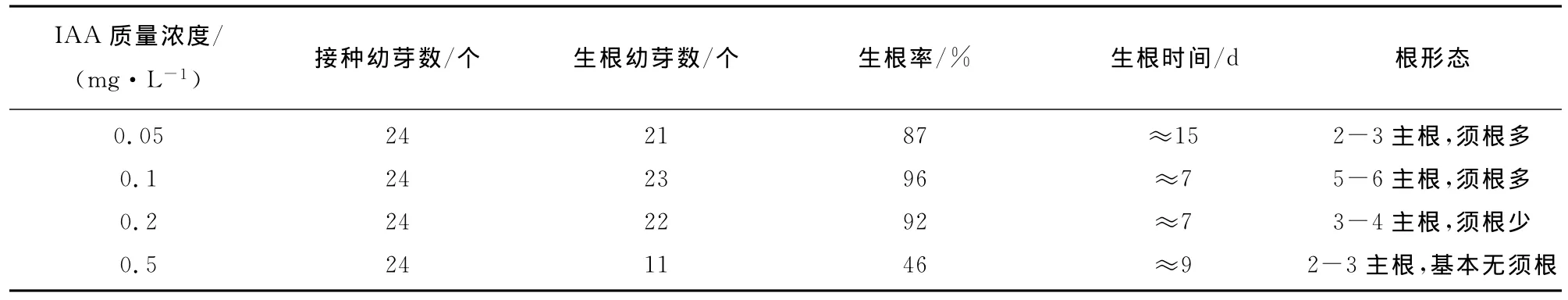
表3 不同浓度IAA对不定芽生根的影响Tab.3 Effect of IAA concentration on adventitious buds generating roots
3 讨 论
3.1 不同灭菌剂对番茄种子发芽的影响
获得无菌苗是植株再生的第1个步骤,以往番茄种子的灭菌主要以氯化汞灭菌法为主,但也有报道指出氯化汞对种子的萌发可能有一定的抑制作用。本试验结果表明,NaCl O处理的种子比氯化汞处理的种子发芽时间更短,发芽率更高。氯化汞抑制种子萌发的原因可能在于氯化汞在种子表面的残留不易去除,从而导致种子不能萌发,而次氯酸钠最后分解成氯和氧气排入大气中,灭菌后易于去除[3],不会再损伤种子。
3.2 不同外植体再生能力的比较
番茄的不同部位外植体再生能力不尽相同,梁美霞发现番茄下胚轴的愈伤组织诱导和不定芽诱导均低于子叶诱导,这与本试验得出的结论是一致的[4]。而子叶作为外植体比下胚轴更容易形成不定芽的原因可能在于子叶是营养储存器官,可以为芽的生长提供更为充足的营养[5]。欧阳波等的研究则相反[6],这可能与不同番茄品种的内源激素的含量和种类有关。陈火英等的实验证明离体培养诱导发生过程中,物理创伤作用对启动愈伤组织有明显的作用[7],故在制备外植体时应尽量多的制造外植体伤口,本试验不仅切除了子叶的边缘同时在子叶切块的中部也划出伤口,以利于外植体的再生培养。
3.3 不同激素配比对外植体生芽及生根的影响
不同激素配比是影响番茄外植体再生的重要因素之一,有关番茄离体培养激素调控方面的研究一直在进行。王月等以番茄子叶和下胚轴为外植体进行离体培养,筛选出ZR与IAA的组合最有利于愈伤组织和不定芽的形成,添加IBA的培养基利于诱导不定芽生根[8];而乔永旭则认为,IAA与6-BA的组合有利于番茄外植体不定芽的生长,而生根培养基中添加的则是IAA[9],毕建水等的实验得到相同的结论[10]。本试验的研究中也发现IAA与6-BA的组合比NAA与6-BA的组合更有利于番茄外植体再生芽的诱导,同时,IAA诱导不定芽生根的作用也比NAA更显著。这一现象表明,番茄外植体诱芽的最佳激素组合有基因型依赖性,不同的品种其再生的条件不同。要建立适合当地气候的番茄品种的再生体系,必须对其再生体系进行进一步的探索。
3.4 再生植株的驯化和移栽
如2.3部分中再生植株移栽过程,可有利于保持再生植株的湿度,相对于直接移栽到营养土中的植株更易成活,4 d后,再生植株移栽到营养土中。移栽时试管苗的高度一般在6~10 cm,过高过低都不适合移栽,根系的发育程度是移栽成功与否的决定因素,移栽时应尽量选择根系较发达的再生植株。
3.5 形成再生植株的周期及效率
本试验诱导愈伤组织和芽分化都在同一培养基中进行,建立了高效的番茄再生体系,子叶在最佳培养基中诱导不定芽和根的效率分别达到了97%和96%。有些报道也可以得到高达95%以上的再生率,但是,这些报道有的是经过愈伤组织诱导不定芽[9-11],有的统计分化不定芽率时间较长[8,12],这样从接种外植体到植株移栽大概需要70~85 d的时间。本研究中,子叶外植体在最适宜的6-BA和IAA组合上从接种外植体到转移至生根培养基约需35 d,芽诱导生根约需15 d,再生苗锻炼5~7 d后移栽,诱导产生再生植株的整个过程约需55 d,加快了再生植株的形成过程缩短了周期,同时提高了再生效率,为番茄快速繁殖和转基因研究奠定了基础。
[1]何秀霞,陆一鸣,白杰英,等.番茄组织培养体系的建立及其影响因素的研究[J].内蒙古民族大学学报(Journal of Inner Mongolia University for Nationalities),2003,18(1):30-33.
[2]李铁松,王关林.番茄外植体诱导直接分化不定芽建立高频再生系统[J].辽宁师范大学学报(Journal of Liaoning Normal University),2003,26(2):178-182.
[3]朱广廉.植物组织培养中的外植体灭菌[J].植物生理学通讯(Plant Physiology Communications),1996,32(6):444-449.
[4]梁美霞.番茄子叶和下胚轴离体再生体系建立[J].中国农学通报(Chinese Agricultural Science Bulletin),2010,26(6):47-50.
[5]尹明安,郭 立,刘华伟,等.番茄ZF遗传转化再生体系的研究[J].西北农林科技大学学报(Journal of Northwest A&F University),2002,30(5):27-30.
[6]欧阳波,李汉霞.番茄下胚轴转化获得转基因植株[J].华中农业大学学报(Journal of Huazhong Agricultural University),2002,21(3):206-209.
[7]陈火英,张建华,钟建江,等.番茄下胚轴离体培养植株再生及其组织学观察[J].西北植物学报(Acta Botanica Boreali-Occidentalia Sinica),2000,20(5):759-765.
[8]王 月,郭 凤,林 英.Micro-Tom番茄离体再生条件的选择[J].北方园艺(Northern Horticulture),2010(18):139-141.
[9]乔永旭.番茄再生体系的建立[J].北方园艺(Northern Horticulture),2010(17):174-176.
[10]毕建水,李翠翠,徐丽丽.培养基和继代时间对番茄叶片愈伤组织诱导和芽分化的影响[J].安徽农学通报(Anhui Agricultural Science Bulletin),2008,14(13):41-42.
[11]蒋素华,顾东亚,崔 波,等.番茄真叶愈伤组织诱导及植株再生研究[J].北方园艺(Northern Horticulture),2009(10):113-114.
[12]张艳芳,霍秀文,苏彩霞,等.番茄遗传转化体系的建立[J].农业生物技术学报(Journal of Agricultural Biotechnology),2008,24(3):58-61.
Establishment of highly efficient regeneration system of tomato
QIU Yan,LIU Hong-xiao,YANG Song-ye
(College of Bioscience and Engineering,Hebei University of Science and Technology,Shijiazhuang Hebei 050018,China)
The effects of medias containing different concentration of IAA and 6-BA or NAA and 6-BA on tomato callus induction,bud differentiation and rooting were detected in hypocotyl and cotyledon of Zhenmu No.1.The results show that MS+0.2 mg/L IAA+1.0 mg/L 6-BA is the best medium for callus induction and bud differentiation of cotyledon;MS+0.5 mg/L IAA+1.0 mg/L 6-BA is the optimum medium for callus induction and bud differentiation of hypocotyl;the optimum root induction medium is MS+0.1 mg/L IAA.
tomato;cotyledon;hypocotyl;plant regeneration
S641.2
A
1008-1542(2012)01-0083-06
2011-05-27;
2011-11-09;责任编辑:王海云
河北省自然科学基金资助项目(C2010000860)
仇 燕(1977-),女,河北井径人,副教授,博士,主要从事植物种质创新方面的研究。
