尖萼耧斗菜的传粉机制与遗传结构
2012-12-26史凤雪李志瑞孙明洲李霖锋肖洪兴
庞 迪,史凤雪,李志瑞,崔 娜,孙明洲,李霖锋,肖洪兴
(1.东北师范大学分子表观遗传学教育部重点实验室,吉林 长春 130024;
2.东北师范大学生命科学学院,吉林 长春 130024)
尖萼耧斗菜的传粉机制与遗传结构
庞 迪1,2,史凤雪1,2,李志瑞1,2,崔 娜2,孙明洲2,李霖锋1,2,肖洪兴1,2
(1.东北师范大学分子表观遗传学教育部重点实验室,吉林 长春 130024;
2.东北师范大学生命科学学院,吉林 长春 130024)
对尖萼耧斗菜(AquilegiaoxysepalaTrautv.et C.A.Mey.)及其变型黄花尖萼耧斗菜(A.oxysepalaf.pallidiflora(Nakai)Kitag)进行了传粉生物学与遗传结构研究.结果表明,虽然尖萼耧斗菜及其变型黄花尖萼耧斗菜的繁殖系统没有差异,但其传粉高峰期已经产生分化.其次,SSR数据显示这二者的遗传结构也产生了分化,为将来进一步研究其种内的微分化奠定了基础.
毛茛科;尖萼耧斗菜;繁殖系统;传粉;遗传结构
尖萼耧斗菜(AquilegiaoxysepalaTrautv.et C.A.Mey.)隶属于毛茛科(Ranunculaceae)耧斗菜属(Aquilegia),多年生草本;该属共有约70个物种,广泛分布于欧洲、北美与亚洲等地区[1-3].已有的研究显示,耧斗菜属大约于600万年前起源于亚洲北部,然后于300万年前分别扩散至北美与欧洲等地区,并随后产生了适应性辐射.其中导致欧洲耧斗菜属物种辐射成种的主要原因是生态位(niche)的变迁,而导致北美地区耧斗菜属物种辐射成种的主要原因是传粉者(pollinator)的改变[4].由此可知耧斗菜属是研究物种形成与适应性进化的优良材料.
根据《中国植物志》,我国东北地区约有7个耧斗菜属物种,其中尖萼耧斗菜为该属在东北地区最为常见的物种之一,其种内包括尖萼耧斗菜(A.oxysepala)及其变型黄花尖萼耧斗菜(A.oxysepalaf.pallidiflora(Nakai)Kitag).二者在形态学上的主要区别为尖萼耧斗菜花瓣尖端为黄色,距和萼片为紫色;而黄花尖萼耧斗菜的距和萼片均为黄色[5].Bradshaw和Schemske等(2003)曾对Mimulus cardinalis和M.lewisii进行了研究,发现花颜色的改变对传粉者种类的变化起着较大的作用[6].随后,Hodges和Nathan等(2009)通过对北美地区的耧斗菜属物种进行的相关研究也发现了耧斗菜属各物种花颜色的改变对其传粉系统以及物种分化起着关键的作用[7].
鉴于花色的改变在物种进化过程中所扮演的重要作用,本文分别对尖萼耧斗菜及其变型黄花尖萼耧斗菜的传粉机制进行了研究.此外,运用简单重复序列(simple sequence repeat,SSR)技术对尖萼耧斗菜及其变型黄花尖萼耧斗菜进行了遗传结构分析,以期揭示花颜色的改变对二者传粉系统与遗传结构的影响.
1 材料与方法
1.1 传粉生物学研究
1.1.1 样地的选择与套袋实验 选取抚松县露水河镇的永清林场与21林班为研究地点,分别对尖萼耧斗菜及其变型黄花尖萼耧斗菜的花进行套袋处理,具体操作如下:在同一植株中选择部分花粉尚未成熟的花进行套袋,其余部分的花则让其自然生长,检测它们的繁殖系统(mating system).
1.1.2 传粉过程观察 自8:00~17:00分别对尖萼耧斗菜及其变型黄花尖萼耧斗菜进行传粉生物学观察,并以30min为单位对传粉者的种类、传粉的次数以及方式进行统计.同时,捕获部分传粉者作为实验的凭证.
1.2 分子生物学实验
1.2.1 样品的收集与DNA的提取 广泛收集分布于长白山地区的尖萼耧斗菜及其变型黄花尖萼耧斗菜,并运用基因组DNA提取试剂盒(康为世纪出品)对所收集的样品进行DNA提取,具体信息见表1.

居群编号 花色 个体数 采集地点 采集人BYG 黄色 5辽宁省冰峪沟 肖洪兴紫色 5 DH 紫色 5 吉林省敦化市 肖洪兴黄色 3 WCH 黄色 4 黑龙江省五常市 肖洪兴LBSH 黄色 3 吉林省老白山 肖洪兴LKZ 紫色 5黑龙江省林口县 肖洪兴
1.2.2 PCR检测与毛细管荧光电泳 实验所用的SSR引物参见文献[8],具体名称分别是A6,A7,AA12,AA4,EST7.PCR反应体系为:ddH2O 14.4μL,10×buffer(含 Mg2+)2μL,正引物与反引物各0.6μL,Taq酶(5U)0.2μL,DNA 50ng.反应程序为:95℃,5min;94℃,30s;退火温度,30s;72℃,30s;35个循环;72℃,8min.实验所用PCR检测仪和毛细管荧光电泳仪型号分别为ABI2720(ABI,USA)和 ABI3730(ABI,USA).
2 结果与分析
2.1 传粉实验结果
2.1.1 套袋实验结果 对套袋处理的尖萼耧斗菜及其变型进行后统计发现,相对于同株未套袋的对照而言,尖萼耧斗菜的自交不育率高达80.3%,而且自交可育的果实中种子的数量为非套袋果实的85.0%,说明尖萼耧斗菜的繁殖系统为自交亲和型(self-compatible).与此类似,黄花尖萼耧斗菜的植株经套袋处理后,自交不育率为50%,但种子数量与对照组没有明显区别,因此,其繁殖系统也为自交亲和型.由此可见,花色的改变对尖萼耧斗菜及其变型黄花尖萼耧斗菜的繁殖系统没有明显的影响.2.1.2 传粉生物学实验结果 通过对尖萼耧斗菜及其变型的传粉生物学实验发现,虽然它们的传粉者种类并没有明显的区别,但各种传粉者的传粉频率有明显差异,如二者的蜜蜂和黑胡蜂的传粉比例存在差异(见图1).此外,对各个时间段传粉频率的研究发现,尖萼耧斗菜及其变型黄花尖萼耧斗菜的传粉高峰期已经产生分化,尖萼耧斗菜的传粉高峰期分别为上午8:30—9:00和10:00—10:30,而黄花尖萼耧斗菜的传粉高峰期分别8:00—8:30和9:00—9:30(见图2).
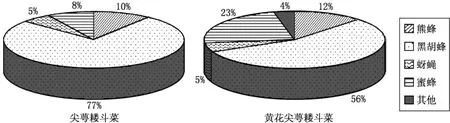
图1 尖萼耧斗菜及其变型黄花尖萼耧斗菜的传粉者种类及其比例

图2 尖萼耧斗菜及其变型黄花尖萼耧斗菜的传粉者访问频率
2.2 PCR检测与毛细管荧光电泳实验结果
根据本实验所获得的5个SSR位点数据,分别对各个位点的等位基因数进行了统计(见表2).根据该结果,在A6和EST7两个位点上,黄花尖萼耧斗菜分别拥有独特的等位基因,这说明其与尖萼耧斗菜的遗传结构已出现遗传分化的趋势.此外,运用生物软件POPULATION对尖萼耧斗菜及其变型黄花尖萼耧斗菜进行了系统树的构建(见图3),结果显示,尖萼耧斗菜及其变型黄花尖萼耧斗菜的聚类关系已产生分化.例如,除DH1外,其余的尖萼耧斗菜个体都集中分布于A分支与B1分支中;而对于黄花尖萼耧斗菜而言,其个体并没有依据采集地点发生聚类,这与表2的结果基本一致.由此可知,尖萼耧斗菜及其变型黄花尖萼耧斗菜的遗传结构已经有分化的趋势.

表2 尖萼耧斗菜与黄花尖萼耧斗菜各SSR位点的等位基因数 个
3 讨论
3.1 尖萼耧斗菜及其变型黄花尖萼耧斗菜的传粉生物学研究
本实验的套袋结果显示,花色的变化并没有直接导致尖萼耧斗菜及其变型繁殖系统的改变,但套袋组的结实率低于对照组.在对花的结构进行解剖时也发现,最内层的雄蕊出现了功能退化的现象.根据此实验结果,初步推断尖萼耧斗菜及其变型黄花尖萼耧斗菜繁殖系统的结构特征是适应昆虫传粉的结果.
在对尖萼耧斗菜及其变型的传粉者进行观察时发现,二者的传粉者种类并没有明显的差异,但是每种传粉者的访花频率存在差异,这与以往的研究结果类似[9].此外,对尖萼耧斗菜及其变型传粉高峰期的分析发现,二者的高峰期已经错开.有研究显示,传粉者访问高峰往往与植物体产生花粉与花蜜的高峰期是协同的[10].基于此,我们推测尖萼耧斗菜及其变型产生花粉和花蜜的时间已经分化,而导致该现象的原因可能是控制花粉和花蜜产生的相关基因已经开始分化.传粉高峰期的分化会直接或者间接地导致尖萼耧斗菜及其变型之间基因流的减少,将增加二者之间的遗传分化.
3.2 尖萼耧斗菜及其变型黄花尖萼耧斗菜的遗传结构分析
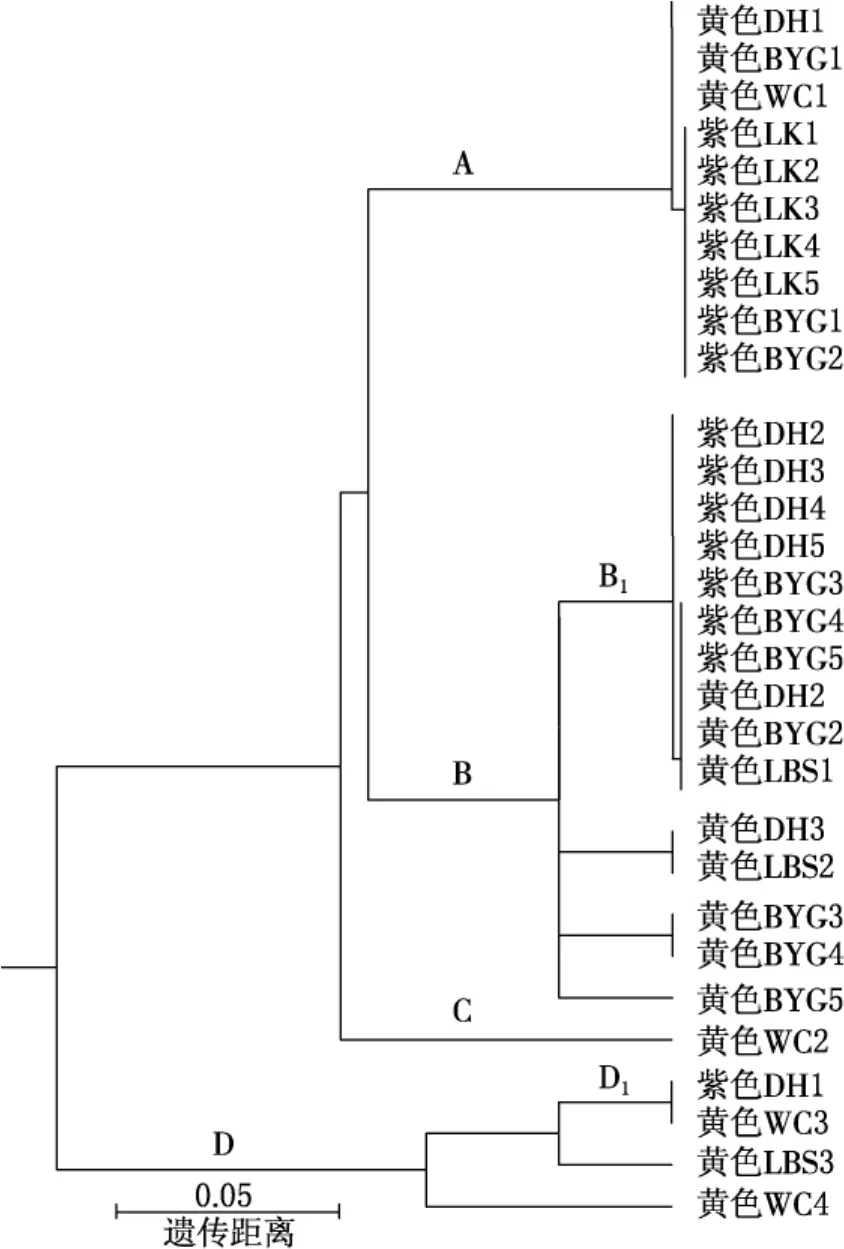
图3 尖萼耧斗菜及其变型黄花尖萼耧斗菜的UPGMA树
以往的研究显示,传粉系统的改变往往会导致遗传结构的变化[11-13],因此,采用SSR标记技术分别对分布于长白山地区的尖萼耧斗菜及其变型进行了遗传结构的研究.结果显示,尖萼耧斗菜及其变型的等位基因已初步产生分化.例如,在A6和EST7位点中黄花尖萼耧斗菜除了有与尖萼耧斗菜共同的等位基因外,还出现了一些特有的等位基因.产生这种现象的原因可能是由于这二者的传粉系统产生了差异导致基因流的减少,并最终导致黄花尖萼耧斗菜拥有独特的等位基因.此外,基于SSR数据构建的分子系统树可知,虽然尖萼耧斗菜及其变型黄花尖萼耧斗菜并没有完全分成两个分支,但是这二者间也产生了初步的分化.综上所述,尖萼耧斗菜及其变型黄花尖萼耧斗菜的遗传结构已开始分化.
[1] MUNZ P A.Aquilegia:the cultivated and wild columbines[J].Gentes Herbarium,1946,7:1-50.
[2] WHITTEMORE A T.Aquilegia[G]//MORIN N R.Flora of North America.New York:Oxford University Press,1997:1-100.
[3] NOLD R COLUMBINES.Aquilegia,ParaquilegiaandSemiaquilegia.[M].Cambridge:Timber Press,2003.
[4] BASTIDA J M,ALCANTARA J M,RRY P J,et al.Extended phylogeny ofAquilegia:the biogeographical and ecological patterns of two simultaneous but contrasting radiations[J].Plant Syst Evol,2010,284:171-185.[5] 傅沛云.东北植物检索表(第二版)[M].北京:科学出版社,1995:189-191.
[6] BRADSHWA H D,SCHEMSKE D W.Allele substitution at a flower color locus produces a pollinator shift in monkeyflowers[J].Nature,2003,426:176-178.
[7] HODGES S A,DERIEG N J.Adaptive radiations:from field to genomic studies[J].PNAS,2009,106:9947-9954.
[8] LI L F,PANG D,LIAO Q L,et al.Genomic and EST microsatellite markers forAquilegiaflabellateand cross-amplification inA.oxysepala[J].Am J Bot,2011,98(8):213-215.
[9] GEGEAR R J,LAVERTY T M.The effect of variation among floral traits on pollinator flower constancy and preference[G]//CHITTKA L,THOMSON J D.Cognitive ecology of pollination:animal behavior and floral evolution.Cambridge:Cambridge University Press,2001:1-20.
[10] GOTISBERGER G,SCHRAUWEN J,LINSKENS H F.Amino acids and sugars in nectar,and their putative evolutionary significance[J].Plant Syst Evol,1984,145:55-77.
[11] WILLIAMS C F,RUVINSKY J,SCOTT P E,et al.Pollination,breeding system and genetic structure in two sympatricDelphinium(Ranunculaceae)species[J].Am J Bot,2001,88:1623-1633.
[12] GUAN B C,FU C X,QIU Y X,et al.Genetic structure and breeding system of a rare understory herb,Dysosmaversipellis(Berberidaceae)form temperate deciduous forest in China[J].Am J Bot,2010,97(1):111-122.
[13] KRAMER A T,FANT J B,ASHLEY M V.Influences of landscape and pollinators on population genetic structure:examples from threePenstemon(Plantaginaceae)species in the Great Basin[J].Am J Bot,2011,98(1):109-121.
The pollination system and genetic structure ofAquilegiaoxysepalaTrautv.et C.A.Mey.
PANG Di1,2,SHI Feng-xue1,2,LI Zhi-rui1,2,CUI Na2,SUN Ming-zhou2,LI Lin-feng1,2,XIAO Hong-xing1,2
(1.Key Laboratory of Molecular Epigenetics of MOE,Northeast Normal University,Changchun 130024,China;
2.School of Life Sciences,Northeast Normal University,Changchun 130024,China)
The speciesAquilegiaoxysepalaTrautv.et.C.A.Mey,which belongs to the genusAquilegiaof family Ranunculaceae,is a perennial herb and widely distributes in northeast of China.This paper analyses the pollination system and genetic structure of the speciesAquilegiaoxysepalaand its formaA.oxysepalaf.pallidiflora(Nakai)Kitag.According to the results,despite there are no obvious differences in the mating system,they exhibit differentiation in pollination peak and genetic structure.These findings provide us fundamental information for future studies of microevolution.
Ranunculaceae;Aquilegiaoxysepala;mating system;pollination;genetic structure
Q 941+.3
180·5155
A
1000-1832(2012)01-0132-04
2010-08-22
中央高校基本科研业务费专项资金资助项目(10QNJJ011).
庞迪 (1987—),女,硕士研究生;通讯作者:肖洪兴(1963—),男,博士,教授,主要从事植物系统与进化研究.
方 林)
