燃煤细颗粒物对血管内皮细胞EA.hy926的细胞毒性
2012-12-26刘芳盈王菲菲丁明玉淄博市疾病预防控制中心环境卫生监测所山东淄博5506中国环境科学研究院环境基准与风险评估国家重点实验室北京000山东大学公共卫生学院山东济南500
刘芳盈,王菲菲 ,丁明玉,李 杰 (.淄博市疾病预防控制中心环境卫生监测所,山东 淄博 5506;.中国环境科学研究院环境基准与风险评估国家重点实验室,北京 000;.山东大学公共卫生学院,山东 济南 500)
燃煤细颗粒物对血管内皮细胞EA.hy926的细胞毒性
刘芳盈1,王菲菲2*,丁明玉2,李 杰3(1.淄博市疾病预防控制中心环境卫生监测所,山东 淄博 255026;2.中国环境科学研究院环境基准与风险评估国家重点实验室,北京 100012;3.山东大学公共卫生学院,山东 济南 250012)
以银川散煤为样品煤,在实验室采用固定源稀释通道采集燃煤 PM2.5,超声波水浴提取燃煤 PM2.5全颗粒悬液,对人脐静脉内皮细胞EA.hy926进行染毒,并采用MTS法检测燃煤PM2.5在不同染毒时间对EA.hy926细胞增殖的影响.结果表明,燃煤PM2.5悬液对EA.hy926细胞分别染毒6,12,24h均可抑制细胞增殖,且12,24h各剂量组和溶剂对照相比具有统计学意义;在相同染毒剂量组内,和6,12h相比,染毒24h对细胞存活率抑制更加明显,其差异具有统计学意义.可见,燃煤 PM2.5可以抑制血管内皮细胞增殖且具有时间和剂量依赖性,血管内皮损伤是PM2.5致心血管毒性的可能机制之一.
燃煤细颗粒物;PM2.5;血管内皮细胞;EA.hy926;细胞毒性;MTS法
目前,中国许多大中城市,PM2.5污染十分严重.据报道,2005年中国的总悬浮颗粒物(TSP)、可吸入颗粒物(PM10)和细颗粒物(PM2.5)的排放量分别是 29.98,15.30,9.79Mt,2000~2005年间的排放增长率分别是3.4%、4.7%和5.4%[1]. PM2.5主要来源于燃煤排放和汽车尾气,目前我国的大气污染虽然已从煤烟型大气污染特征转向煤烟和汽车尾气复合型大气污染特征,但仍以煤烟型污染为主[2-3].国家统计局发布的 2009年统计公报显示,中国煤炭消费量为3.02Gt,远远高于欧盟和世界平均水平[4].直到2050年,煤炭占我国占一次能源消费比重仍会在 50%左右,主要利用方式为燃烧[5].燃煤排放的污染物以颗粒物为主,其中细颗粒物(PM2.5)贡献较大.Dockery等[6]的研究结果显示,空气污染和心血管疾病死亡相关,并且细颗粒物空气污染与心肺疾病的死亡增加显著相关.Pope等[7]的研究结果表明,在控制各项混杂因素后,PM2.5年均浓度每增加10μg/m3,心血管疾病死亡率增加 8%,且死亡率与空气动力学粒径>2.5μm的颗粒物相关关系不明显.可见, PM2.5可能是与心血管疾病相关的主要环境污染物之一.
研究显示,PM2.5可到达细支气管及肺泡,通过肺部氧化应激炎症反应释放炎症因子和细胞因子介导心血管事件,部分组分(如水溶性过渡金属等)甚至可以穿过肺泡间质进入循环产生直接影响心血管系统[8-10].血管内皮细胞(VEC) 具有多种生理功能,血管内皮损伤是许多心血管疾病的病理基础.人脐静脉内皮细胞被广泛用于内皮功能的研究中,但 HUVEC原代培养较为耗时,且易出现杂细胞的污染,传2~3代后细胞就开始衰退,难以长期维持,对于多种来源颗粒物血管内皮细胞毒性比较研究中存在细胞数量和杂细胞干扰的限制. 因此,一般采用细胞株研究内皮功能.国内相关研究中有采用ECV304细胞进行颗粒物心血管毒性研究[11-13],但该株细胞已被证实为膀胱癌细胞派生来的上皮样细胞而非血管内皮细胞[14-16].实验选择人脐静脉内皮细胞株EA.hy926作为研究细胞,EA.hy926是人脐静脉内皮细胞和A549融合的细胞株,是目前内皮功能体外研究中最为认可的细胞株[17].
细胞增殖毒性实验常规选择MTT法.MTT是一种四唑类化合物,自20世纪80年代出现并得到了广泛应用.此法的主要原理是活细胞线粒体中的琥珀酸脱氢酶能使外源性的MTT还原为难溶性的蓝紫结晶物formazan,并沉积在细胞中,而死细胞则无此功能[18].MTS是一种新合成的四唑类化合物,与MTT的应用原理相同. MTS被还原后生成的甲瓒产物颜色较深,还原产物稳定,且为水溶性物质,可直接测定,无需有机溶剂溶解[19].可见,在对多种样品细胞毒性比较中,MTS试剂盒相比传统MTT法具有方法简便及检测状态稳定的特点,细胞毒性比较结果更为准确.实验选择银川散煤为样煤采集细颗粒物,以人脐静脉内皮细胞EA.hy926为研究对象,采用MTS法检测不同浓度燃煤PM2.5分别在染毒6,12,24h后对血管内皮细胞的毒性作用,为进一步探讨燃煤PM2.5对心血管毒性机制奠定基础.
1 材料与方法
1.1 材料
1.1.1 实验细胞 人脐静脉血管内皮细胞株EA.hy926购自美国ATCC细胞库,增殖周期约为31h.
1.1.2 仪器 PM2.5撞击式中流量颗粒物采样器(78L/min),METTLER TOLEDO 分析天平(梅特勒-托利多仪器公司,AL104-IC),超声震荡仪(江苏昆山市超声仪器公司,舒美 KQ500DB),真空冷冻干燥机(北京亚泰科隆公司,LGJ-18),生物安全柜(美国 Thermo Forma公司),CO2恒温培养箱(美国Thermo Forma公司),倒置显微镜(日本OLYMPUS公司,TH4-200),D-1型自动蒸汽灭菌锅(北京发恩科贸有限公司),Model 680型酶标仪(美国 Bio-Rad 公司).
1.1.3 试剂 DMEM培养液(美国 HyClone公司),胎牛血清(美国 HyClone公司),磷酸盐缓冲液 PBS(美国 HyClone 公司),双抗青霉素-链霉素(华北制药公司),胰蛋白酶(美国 Sigma公司),MTS试剂盒(美国Promega公司),石英纤维采样滤膜(美国PALL公司).
1.2 方法
1.2.1 燃煤PM2.5的采样 采样时间为2009年11月,采样地点在中国环境科学研究院气溶胶实验室,以银川散煤为样煤,采用 PM2.5撞击式中流量颗粒物采样器(78L/min)和直径90mm的石英纤维滤膜,利用固定源稀释通道对燃煤排放细颗粒物进行直接采集.采样时,将银川散煤块加工到3~5cm,用焦炭引火,待火焰稳定后将采样通道和燃煤炉连接.然后将已称量好的煤块均匀的放于炉内,同时开泵开始采样,直到燃尽,记录开始5min时采样流量和结束前5min时采样流量.石英纤维滤膜采样前要在马弗炉中 600℃灼烧 2h,恒温干燥24h后称重并用灼烧后的铝箔包装,采样后用铝箔纸包装好并在同样条件下平衡24h,-20℃避光保存.
1.2.2 燃煤 PM2.5的提取和染毒液配制 将载有燃煤 PM2.5的石英纤维滤膜,采样面朝下置于50mL去离子水中,超声震荡 30min×2次(功率500W)以洗脱颗粒物.提取液8层纱布过滤,除去石英纤维滤膜碎片.将滤液分装到已消毒小瓶中,5mL/瓶,真空冷冻干燥成干粉,称重后用灭菌PBS配制成100,250,500,1000,2000μg/mL的颗粒物悬液作为染毒母液,于-20℃避光保存备用.
1.2.3 血管内皮细胞EAhy926的培养 将冻存的EA.hy926细胞移入于含20%胎牛血清、1%双抗的DMEM培养液中,在37℃、5%CO2条件下培养复苏.待细胞达到80%融合时,以0.25%胰酶消化,1:3传代,用含 10%胎牛血清、1%双抗的DMEM培养液,在37℃、5%CO2条件下传代培养至对数生长期.
1.2.4 细胞染毒和实验分组 取处于对数生长期的生长良好的细胞,用含 10% 胎牛血清、1%双抗的 DMEM 培养液将细胞浓度调整成3×105/mL细胞悬液,以每孔100µL接种于96孔板,在37℃、5%CO2条件下培养24h.将染毒母液超声震荡 15min,加入含 0.5% 胎牛血清的DMEM 培养液十倍稀释[20],终浓度为 10,25,50, 100,200μg/mL,以 PBS为阴性对照.临用前超生15min,弃去培养板中原培养液,加入已配制好的染毒液,每个剂量设置6个平行样.
1.2.5 MTS毒性实验[20]采用MTS法检测细胞增殖毒性.细胞染毒结束前1h分别加入20μL/孔的MTS,将96孔板用铝箔纸包好后置于37℃孵箱内继续培养 1h,终止培养.用酶联免疫检测仪490 nm测吸光度OD(参考波长630 nm,检测波长490nm).实验重复2次后整理分析数据.按下列公式计算细胞存活率:细胞存活率(%)=OD实验组/OD对照组×100%.
1.3 统计学分析
用SPSS 17.0软件进行统计处理,实验结果以均数±标准差表示.多个样本均数的比较采用单因素方差分析,根据方差齐性检验结果,方差齐性时选择LSD法,方差不齐时选择Tamhane’s T2法.
2 结果
2.1 燃煤PM2.5对血管内皮细胞毒性的剂量-反应关系
由表1及图1可见,燃煤PM2.5作用于EA. hy926细胞6h,在0~25μg/mL剂量范围内可能存在低剂量兴奋效应,轻微促进了细胞增殖(100%~103.71%),在 50~200μg/mL剂量范围内出现了小幅度的抑制增值(99.92%~96.94%).但各剂量组与阴性对照组相比,差异均没有统计学意义.
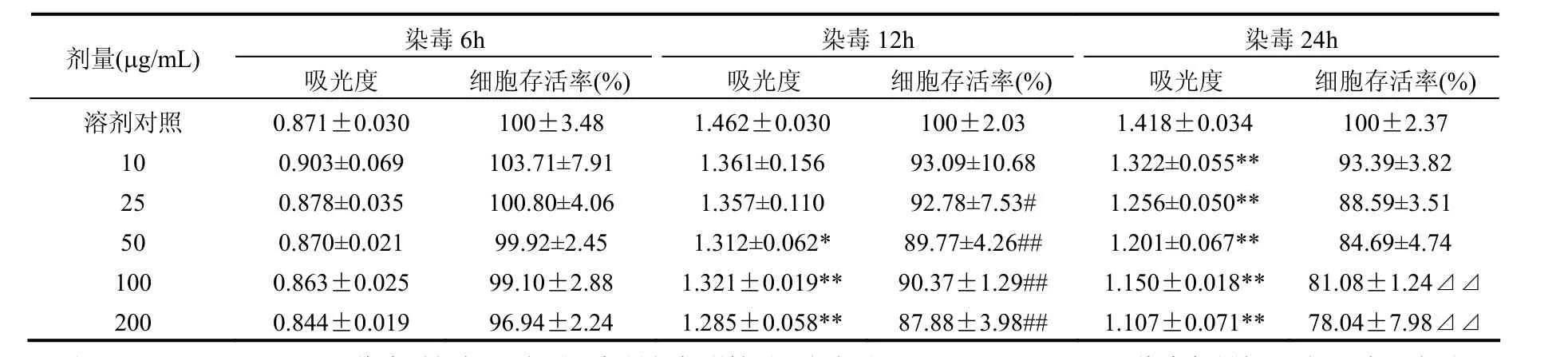
表1 不同染毒时间燃煤PM2.5对血管内皮细胞毒性的比较(n=6)Table 1 Compared cytotoxicity of coal-fired PM2.5 on EA.hy926 cells exposed for different times(n=6)
燃煤PM2.5作用于EA.hy926细胞12h,明显抑制了细胞活性,且随着染毒剂量的增加,细胞存活率下降越明显(93.09%~87.88%),呈剂量-反应关系.与阴性对照组相比,50μg/mL(P<0.05)、100μg/mL(P<0.01)和 200μg/mL(P<0.01)剂量组的差异均具有统计学意义.
燃煤PM2.5作用于EA.hy926细胞24h,细胞活性抑制程度明显,且随着染毒剂量的增加,细胞存活率下降更加明显(93.39%~78.04%),呈剂量-反应关系.各剂量组与阴性对照组相比,差异均具有统计学意义(P<0.01).

图1 燃煤PM2.5对EA.hy926细胞毒性的剂量-反应曲线Fig.1 Dose-effect curve of cytotoxicity of coal-fired PM2.5 on EA.hy926 cells
2.2 燃煤 PM2.5对血管内皮细胞毒性的时间依赖性关系
如表 1所示,在同一染毒剂量组内,10μg/mL剂量组在6,12,24h对EA.hy926细胞活性的差别无统计学意义;25,50μg/mL剂量组和染毒12h相比,染毒6h对EA.hy926细胞活性的差别有统计学意义(P<0.01或 P<0.05),而染毒 24h对 EA. hy926细胞活性的差别无统计学意义;100, 200μg/mL剂量组在不同染毒时间组细胞存活率结果的差异均有显著意义(P<0.01或P<0.05).
可见,燃煤PM2.5作用于EA.hy926细胞,相同染毒时间时,随着染毒剂量的增加,细胞活性抑制程度越高,具有剂量-反应关系;相同染毒剂量时,随着染毒时间的增加,细胞活性抑制程度越高,具有时间依赖性关系关系.综上所述,染毒剂量越大,染毒时间越长,燃煤PM2.5对EA.hy926细胞活性抑制越明显,存在时间依赖和剂量依赖关系.
3 讨论
近年来的一些研究发现,PM2.5对心血管系统的毒作用可能是其人群健康危害的主要原因,颗粒物引起的心脏病死亡远高于呼吸系统的死亡[8,21-23].美国ANA于2011年综述100多项研究结果显示PM2.5急性或慢性暴露每增加10µg/m3,心血管疾病死亡危险会显著增加(慢性相对危险度:1.06~1.76).其中,缺血性心脏病、心率失常、心力衰竭和心脏骤停占主要部分;健康效应机制主要包括肺部炎性反应、动脉粥样硬化加速及自主神经功能紊乱[24].而动脉粥样硬化(AS)是心血管系统疾病中最常见的疾病,也是众多心脑血管疾病共同的病理基础.现在血管内皮的损伤几乎被公认为是 AS发生的始动环节,血管内皮损伤引发血栓形成是许多心血管病的病理基础.PM诱导的炎症可以作用于血管内皮细胞, 导致内皮功能障碍,从而加速AS进展,可能是颗粒物污染和心血管死亡之间关系的基础[25].
目前PM2.5对血管内皮细胞毒理学研究尚不多,对血管内皮细胞时间依赖性的研究更为少见.但已有结果均表现出PM2.5对血管内皮细胞毒性存在剂量和时间依赖性.Zhao等[26]将大气 PM2.5水溶及有机组分暴露于 HUVECs 24h,结果显示水溶及有机组分均抑制了细胞生长且水溶组分抑制作用更强,并具有剂量反应关系.Han等[27]研究发现,大气PM2.5悬浮液、水溶组分和水不溶组分暴露于EA.hy926细胞24h后,分别抑制了细胞增殖且存在剂量-反应关系.Mo等[28]研究显示,大鼠肺动脉微血管内皮细胞(MPMVEC)暴露于UFP 12,24,36,48,72h后,12h没有明显的毒性,但从 24h开始均显示了明显的细胞毒性且存在时间反应关系.本研究结果显示染毒 6h对 EA. hy926细胞无明显毒性,但在12h、24h均显示出明显的细胞毒性,并具有时间依赖性.两项研究中出现明显细胞毒性的时间略有差异的原因可能是因为燃煤PM2.5富集了更多的过渡金属和有机成分,更易诱导过氧化损伤[29],介导血管内皮损伤.郑灿军等[30]采用原代培养的大鼠心肌细胞,以细胞存活率为指标,观察到PM 及其组分对心肌细胞的hormesis效应,即低剂量刺激(低浓度时细胞活力随剂量的增加而上升),而高剂量时抑制心肌细胞的活力(高浓度时,细胞活力随剂量增加而降低).本研究中银川燃煤 PM2.5作用于EA.hy926细胞6h后,在10和25μg/mL 2个剂量组观察到轻微促进增殖作用,但均无统计学差异;且染毒 12,24h,燃煤 PM2.5的作用均表现为抑制增殖.燃煤 PM2.5对血管内皮细胞是否存在hormesis效应,仍需进一步探索研究.
颗粒物是一种复杂混合物体,不同来源的颗粒物由于形成条件和化学组分不同,其对健康的影响性质和程度也不相同.银川市采暖期 PM2.5中各种无机离子和重金属元素(Fe、Zn、Cd、Pb等)高度富集,显著高于非采暖期,说明冬季燃煤对重金属元素贡献明显[31].Ni、Zn、Pb、Co、Fe、As、Cd、Cr等严重危害人体健康的有害重金属元素高度富集在 PM2.5上[31].研究表明,燃煤颗粒物中富含Fe等金属元素,可诱导豚鼠肺泡巨噬细胞产生活性氧自由基,引起脂质过氧化损伤[29,32].目前大气颗粒物对心血管健康效应的研究刚刚开展,燃煤源颗粒物成分更为复杂,有害元素及成分高度富集,但燃煤源颗粒物心血管健康效应研究尚处起步,其健康效应毒性机制尚待探讨.本研究在体外培养血管内皮细胞的基础上,观察了不同染毒剂量和时间燃煤 PM2.5对血管内皮细胞EA.hy926的毒性作用,结果显示随着染毒剂量增大,燃煤PM2.5可抑制EA.hy926细胞增殖,具有剂量-反应关系;且染毒时间越长,细胞存活率显著降低.这初步显示燃煤 PM2.5可引起血管内皮损伤,其损伤机制仍需进一步探索.
4 结论
4.1 燃煤PM2.5染毒EA.hy926不同时间后均对EA.hy926细胞活性产生抑制且存在剂量-反应关系.
4.2 相同剂量组比较, 燃煤 PM2.5对 EA.hy926细胞活性存在时间依赖关系,即染毒时间越长,细胞活性抑制越明显.
4.3 血管内皮损伤可能是燃煤 PM2.5致心血管毒性机制之一,但仍需深入探讨.
[1] 张楚莹,王书肖,赵 瑜,等.中国人为源颗粒物排放现状与趋势分析 [J]. 中国环境科学, 2009,30(7):1881-1887.
[2] 郝吉明,段 雷,易红宏,等.燃烧源可吸入颗粒物的物理化学特征 [M]. 北京:科学出版社, 2008:4-5.
[3] 金银龙,赵宝新.中国煤烟型大气污染对人群健康危害的定量研究 [J]. 卫生研究, 2002,31(5):342-348.
[4] 中华人民共和国国家统计局.中华人民共和国2009年国民经济社会发展统计公报 [R]. 2010.
[5] 吕建燚,李定凯,吕子安.燃烧过程颗粒物的形成及我国燃烧源分析 [J]. 环境污染治理技术与设备, 2006,7(5):43-47.
[6] Dockery D W, Pope C A, Xu X, et al. An association between air pollution and mortality in six US cities [J]. New England Journal of Medicine, 1993,329(24):1753-1759.
[7] Pope C A, Burnett R T, Thun M J, et al. Lung cancer, cardiopulmonary mortality, and long-term exposure to fine particulate air pollution [J]. JAMA: the journal of the American Medical Association, 2002,287(9):1132-1141.
[8] Brook R D, Franklin B, Cascio W, et al. Air pollution and cardiovascular disease: a statement for healthcare professionals from the Expert Panel on Population and Prevention Science of the American Heart Association [J]. Circulation, 2004,109(21): 2655-2671.
[9] Nogueira J. Air pollution and cardiovascular disease [J]. Rev. Port. Cardiol., 2009,28(6):715-733.
[10] Nemmar A, Hoet P H M, Vanquickenborne B, et al. Passage of inhaled particles into the blood circulation in humans [J]. Circulation, 2002,105(4):411-414.
[11] 解玉泉,陈大年,王邦宁.大气细颗粒物对血管内皮功能的影响及阿托伐他汀的干预研究 [J]. 临床心血管病杂志, 2010,(1): 57-61.
[12] 赵金镯,高知义,宋伟民.上海市区大气细颗粒物不同成分对血管内皮细胞的氧化损伤 [J]. 环境与职业医学, 2009,353-357.
[13] 董 晨,宋伟民,施烨闻.PM2.5颗粒物引起血管内皮细胞氧化损伤的研究 [J]. 卫生研究, 2005,34(2):169-171.
[14] Dirks W G, Macleod R a F, Drexler H G. ECV304 (endothelial) is really T24 (bladder carcinoma): cell line cross-contamination at source [J]. In Vitro Cellular and Developmental Biology-Animal, 1999,35(10):558-559.
[15] Drexler H G, Quentmeier H, Dirks W G, et al. Bladder carcinoma cell line ECV304 is not a model system for endothelial cells [J]. In Vitro Cellular and Developmental Biology-Animal, 2002,38(4): 185-186.
[16] Brown J, Reading S J, Jones S, et al. Critical evaluation of ECV304 as a human endothelial cell model defined by genetic analysis and functional responses: a comparison with the human bladder cancer derived epithelial cell line T24/83 [J]. Laboratory Investigation, 2000,80(1):37-45.
[17] Cenni E, Perut F, Baldini N. In vitro models for the evaluation of angiogenic potential in bone engineering [J]. Acta Pharmacologica Sinica, 2010,32(1):21-30.
[18] Mosmann T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays [J]. Journal of Immunological Methods, 1983,65(1/2):55-63.
[19] 叶 萍,李 燕,谷淑燕.MTS和MTT法检测小鼠NK及特异性细胞毒性T细胞活性的比较 [J]. 中华实验和临床病毒学杂志, 1998,12(1):85-86.
[20] Ramachandran V, Arumugam T, Wang H, et al. Anterior gradient 2 is expressed and secreted during the development of pancreatic cancer and promotes cancer cell survival [J]. Cancer Research, 2008,68(19):7811-7818.
[21] Pope III C A. Epidemiology of fine particulate air pollution and human health: Biologic mechanisms and who′s at risk [J]. Environ. Health Perspect, 2000,108(Suppl 4):713-723.
[22] Pope III C A, Muhlestein J B, May H T, et al. Ischemic heart disease events triggered by short-term exposure to fine particulate air pollution [J]. Circulation, 2006,114(23):2443-2448.
[23] Pope III C A, Ezzati M, Dockery D W. Fine-particulate air pollution and life expectancy in the United States [J]. New England Journal of Medicine, 2009,360(4):376-386.
[24] Pope III C A, Burnett R T, Thurston G D, et al. Cardiovascular mortality and long-term exposure to particulate air pollution: epidemiological evidence of general pathophysiological pathways of disease [J]. Circulation, 2004,109(1):71-77.
[25] Yatera K, Hsieh J, Hogg J C, et al. Particulate matter air pollution exposure promotes recruitment of monocytes into atherosclerotic plaques [J]. American Journal of Physiology-Heart and Circulatory Physiology, 2008,294(2):944-953.
[26] Zhao J, Xie Y, Jiang R, et al. Effects of atorvastatin on fine particle-induced inflammatory response, oxidative stress and endothelial function in human umbilical vein endothelial cells [J]. Human and Experimental Toxicology, 2011, 30(11):1828-1839.
[27] Wei H, Wei D, Yi S, et al. Oxidative stress induced by urban fine particles in cultured EA. hy926 cells [J]. Human and Experimental Toxicology, 2011,30(7):579-590.
[28] Mo Y, Wan R, Chien S, et al. Activation of endothelial cells after exposure to ambient ultrafine particles: The role of NADPH oxidase [J]. Toxicology and Applied Pharmacology, 2009,236(2): 183-193.
[29] Ball B R, Smith K R, Veranth J M, et al. Bioavailability of iron from coal fly ash: mechanisms of mobilization and of biological effects [J]. Inhalation Toxicology, 2000,12:209-225.
[30] 郑灿军,王菲菲,郭新彪.大气PM对原代培养大鼠心肌细胞的毒性 [J]. 环境与健康杂志, 2006,23(1):17-20.
[31] 樊曙先,樊 韬,严培君,等.银川市 PM2.5重金属元素的环境污染特征分析 [J]. 中国沙漠, 2006,26(2):291-294.
[32] 闫洪涛,刘君卓,孔祥环,等.烹调油烟提取物和燃煤颗粒物对豚鼠肺泡巨噬细胞自由基的体外诱导作用 [J]. 环境健康杂志, 2007,24(2):73-75.
Cytotoxicity assessment of fine particles from coal combustion on EA. hy926 vascular endothelial cells.
LIU Fang-ying1, WANG Fei-fei2*, DING Ming-yu2, LI Jie3(1.Zibo Municipal Center For Disease Control and Prevention, Zibo 255026, China;2.State Key Laboratory of Environmental Criteria and Risk Assessment, Chinese Research Academy of Environmental Sciences, Beijing 100012, China;3.School of Public Health, Shandong University, Jinan 250012, China). China Environmental Science, 2012,32(1):156~161
The coal sample taken from Yinchuan, coal-fired PM2.5was sampled by fixed source dilution channel and PM2.5suspension was extracted by ultrasonic water-bath method. Human umbilical vein endothelial cells were treated with PM2.5suspension at various concentrations and exposed for different times (6h, 12h, and 24h). The MTS assay was used to measure the effect of PM2.5on cell proliferation of EA. hy926. Coal-fired PM2.5suspension decreased the viability of vascular endothelial cells at different times and exposure time groups of 12h and 24h showed significance statistically in comparison to the solvent control. Compared with the same concentration group of 12h and 6h, exposure time groups of 24h had statistically significant differences. Coal-fired PM2.5could significantly decrease the viability of hman umbilical vein endothelial cells in dose-dependent and time-dependent manner. Vascular endothelial injury might be one of the possible mechanisms of cardiovascular toxicity caused by coal-fired PM2.5.
coal fine particles;PM2.5;vascular endothelial cell;EA.hy926;cytotoxicity;MTS assay
2011-03-21
中国环境科学研究院中央级公益性科研院所基本科研业务专项(2009KYYW05)
* 责任作者, 助理研究员, wangff@craes.org.cn
X111.5
A
1000-6923(2012)01-0156-06
刘芳盈(1984-),男,山东东营人,硕士,研究方向为环境毒理学.发表论文2篇.
