一株耐酸产氢突变株Pantoea agglomerans的筛选与产氢特性
2012-12-26刘洪艳朱大玲王文磊天津科技大学海洋科学与工程学院天津市海洋资源与化学重点实验室天津300457
刘洪艳,朱大玲,王文磊 (天津科技大学海洋科学与工程学院,天津市海洋资源与化学重点实验室,天津 300457)
一株耐酸产氢突变株Pantoea agglomerans的筛选与产氢特性
刘洪艳*,朱大玲,王文磊 (天津科技大学海洋科学与工程学院,天津市海洋资源与化学重点实验室,天津 300457)
以红树林污泥中分离的厌氧发酵产氢细菌Pantoea agglomerans BH18为出发菌株,利用转座子Tn7随机插入菌株基因组DNA,通过卡那霉素筛选与 PCR扩增验证,获得一批转座子插入突变菌株.起始 pH4.0培养条件下,以产氢量为指标分离获得一株耐酸产氢突变菌株TB220.多次传代结果表明,突变菌株TB220具有稳定的产氢遗传特性.起始pH3.5~7.0范围内,突变菌株TB220最适产氢pH值为6.0,产氢量为(2.39±0.08)mol H2/mol葡萄糖.起始pH4.0和葡萄糖浓度10g/L的海水培养条件下,突变菌株TB220产氢量为(0.47 ± 0.02)mol H2/mol葡萄糖,比野生菌株高70%,表现出较强耐酸性.
成团泛菌;产氢量;转座子耐酸
生物制氢是目前化石能源燃料的替代途径之一,主要包括藻类、光合细菌和厌氧发酵细菌制氢3种方式,其中厌氧发酵细菌产氢效率要高于藻类和光合细菌[1-2].近年来,研究人员将有机废水或废渣等处理与厌氧发酵细菌制氢技术结合起来,使得厌氧发酵细菌制氢技术具有更广阔的应用前景[3].目前,已报道高效厌氧发酵产氢细菌,例如: Enterobacter cloacae IIT-BT 08、Enterobacter aerogenes 、 Clostridium acetobutylicum ATCC 824、 Ethanoligenens harbinense YUAN-3、Pantoea agglomerans等[4-8].这些菌株产氢量一般在 2mol H2/mol 葡萄糖左右,而厌氧发酵细菌产氢量理论值为 4mol H2/mol葡萄糖.厌氧发酵细菌在产氢过程中会同时产生有机酸,有机酸的累积将导致发酵液 pH值降低,发酵细菌的生理代谢活动逐渐受到抑制,甚至停止,即产生有机酸反馈抑制[9-10],因而造成菌株实际产氢量与理论产氢量相差比较大,酸累积也成为了细菌发酵制氢工业化生产的制约因素.从目前研究来看,解决发酵细菌的有机酸反馈抑制主要有2种途径:一是采用厌氧发酵细菌与光合细菌(或酵母菌)耦联发酵产氢,通过后者对小分子有机酸的利用与消除,重新提高发酵液pH 值[9-14].然而,无论是光合细菌还是酵母菌,其自身产氢速率很低,耦联发酵产氢的整个过程在经济可行性上仍是个问题[15].二是在实际生产中采用化学中和法维持产氢体系中的 pH值,但该法既不经济,又容易导致反应器生态系统受到破坏[16].因此,引入高酸条件下仍具有较强代谢活力的耐酸型产氢细菌,将有利于提高产氢效率.
在野生型菌株基础上,通过诱变手段获得产氢突变菌株的相关研究已经开展[16-21].这些诱变手段主要集中于物理或化学手段,然而关于分子生物学手段诱变,比如转座子插入突变技术,应用于厌氧发酵细菌的报道还比较少.本研究利用分离自海洋环境的产氢细菌 Pantoea agglomerans为出发菌株,采用Tn7转座子构建菌株的转座子突变文库,在此基础上筛选产氢突变菌株并进行耐酸性能研究,为进一步构建耐酸性产氢工程菌株奠定基础.
1 材料与方法
1.1 菌种
厌氧发酵产氢细菌Pantoea agglomerans野生菌株分离自红树林污泥,由本实验室保存.
1.2 培养基
野生菌株培养采用LM培养基(g/L):葡萄糖20、胰蛋白胨 4,牛肉膏 2,酵母粉 1,NaCl 30, K2HPO41,MgCl20.1,FeSO4·7H2O 0.1,L-半胱氨酸 0.5.微量元素液(g/L,MnSO4·7H2O 0.01, ZnSO4·7H2O 0.05,H3BO30.01,CaCl2·2H2O 0.01, Na2MoO40.01,CoCl2·6H2O 0.2) 10mL,维生素溶液(g/L,L-抗坏血酸VC0.025,柠檬酸0.02,吡哆醛0.05,对氨基苯甲酸 0.01,生物素 0.01,维生素 B10.02,核黄素0.0250) 10mL.菌株活化采用LB培养基(g/L):胰蛋白胨 10,酵母提取物 5,NaCl 10.菌株感受态细胞制备采用2×YT培养基(g/L):胰蛋白胨 16,酵母提取物10,NaCl 4.复苏电转化产物采用SOC培养基(g/L):胰蛋白胨 2 0,酵母提取物5.0,NaCl 0.5,KCl 1.86,MgCl22.03,葡萄糖3.6.
1.3 转座子突变菌株Pantoea agglomerans
1.3.1 感受态细胞的制备 (1)活化 Pantoea agglomerans菌株接种于 50mL 2×YT培养基中,18℃ 120r/min培养使细菌分光光度值达到0.4~0.6. (2) 4℃,2500g离心15min,弃上清收集菌体,用预冷的 50mL双蒸水轻轻悬浮菌体.(3) 重复步骤(2)3次,预冷双蒸水的体积分别为 25,10, 5mL,最后于4℃,2500g离心15min收集菌体. (4)向沉淀中加140μL预冷双蒸水和DMSO 2μL,悬浮的感受态细胞等量分装(40μL)于无菌离心管中,立刻或-80℃保存用于电转化.
1.3.2 转座过程 首先,反应体系中加入1μL转座子质粒 pGPS3、1μL DNA和 1μL转座酶TnsABC,加水至总体积20μL,37 ℃温育1h.然后,利用DNA聚合酶Ⅰ填补转座插入反应产生的缺口,利用酚/氯仿抽提后,加 1μL DNA聚合酶Ⅰ, 3μL 10×Buffer, 9μL dNTP,室温放置 15min,加1μLT4连接酶(400U,ATP终浓度为 1mmol/L), 16℃温育 4h.最后,利用稀有反应酶 PISceⅠ ( VDE)酶切转座产物,使转座子重组 DNA能够有效转化到大肠杆菌细胞中.酚/氯仿抽提后,加入6μL PI-SceⅠ (6U),5μL 10×PI- SceⅠ缓冲液, 0.5μL牛血清蛋白,18.5μL水,37℃温育1~2h后, -20℃中保存留用.
1.3.3 电转化步骤 把0.2~0.5μg转座产物加入到 40μL感受态细胞中,混合后于冰上放置.设置电转化仪(BIO-RAD)参数为电压 1.8kV.将冰上放置的混合物加入到 0.2cm预冷电转杯中开始电击.电击产物快速从电转化杯中转移到装有1mL SOC培养基的离心管内,37℃, 150r/min复苏1h.复苏产物于2000g离心1min,弃上清,剩余100μL用于悬浮细胞,涂布于含浓度卡那霉素的LB培养基中,37℃过夜培养.
1.4 耐酸产氢突变菌株的筛选
1.4.1 转座子突变菌株的鉴定 在 LB培养平板(卡那霉素浓度 40μg/mL)上生长的菌落,即表示可能发生了转座.随机挑取单菌落340个, 37℃过夜培养, 2500g离心后,提取细菌基因组DNA,作为PCR反应的模板.引物序列按转座子突变试剂盒提供,引物P1: 5'-TTAAGGATTATTTAGG-GAAG-3';P2: 5'-ACAATAAAGTCTTAAACTAG-3'.PCR反应体系(50μL):buffer 5 μL(10×),引物P1和P2各1μL(10μmol/L),dNTP 1μL(10 mmol/ L),Taq DNA聚合酶1 μL(5U/L),模板lμL,超纯水40μL.反应程序为 94℃ 4min;94℃ 30s,49℃30s;72℃ 1min,30个循环;72℃, 10min.
1.4.2 突变菌株耐酸性能测定 突变菌株接种于不同pH值(3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0)的发酵培养基,测定各突变菌株生长及产氢指标(细菌生物量、发酵液的pH值、氧化还原电位ORP、葡萄糖利用率和产氢量等,筛选耐酸产氢突变菌株.
1.5 分析方法
pH值和氧化还原电位测定采用 DLELTA–320型酸度计量.A600采用岛津分光光度计.气体收集采用排水法.利用气相色谱仪(型号 6820, Agilent)测定发酵气体中氢气的含量.氮气做载气,流量为 30mL/min,色谱柱填料为 5A分子筛(60/80目),柱长 2m,检测器为热导检测器(TCD),柱温、进样器和检测器分别为40,200,200℃.
2 结果与讨论
2.1 转座子插入突变菌株的鉴定
野生菌株Pantoea agglomerans接种于不同起始pH值的培养液中,结果表明,菌株能够在起始pH5.0的条件下产氢,产氢量为(0.6 ± 0.02) mol H2/mol葡萄糖.Chen等[22]报道 Clostridium butyricum CGS5在起始pH值为5.0时,不能产氢.支晓鹏等[23]研究发现 Enterobacter sp.C32在起始 pH值 5.0的产氢微弱,只有 3.3mL/L.菌株Pantoea agglomerans能够在起始5.0的条件下进行产氢,表明该菌株具有一定的耐酸性,作为本实验转座子Tn7插入突变的出发菌株.
利用转座子对成团泛菌进行随机突变,构建转座突变体文库,用以筛选耐酸型产氢突变株.在含卡那霉素浓度40μg/mL分离琼脂平板上长出的单菌落即为插入转座子的突变体,阴性对照无菌落生长.提取突变菌株基因组DNA,经PCR扩增验证,突变菌株的PCR扩增产物在1699bp处具有特异性片段(图1),该片段大小与转座质粒阳性对照的扩增片段大小一致,证实突变菌株含有Tn7转座子插入片段.以野生菌株 DNA为模板,PCR产物无扩增片段.在随机挑选340个菌落中,通过 PCR检测发现有 331个突变菌株含有Tn7转座子插入片段.
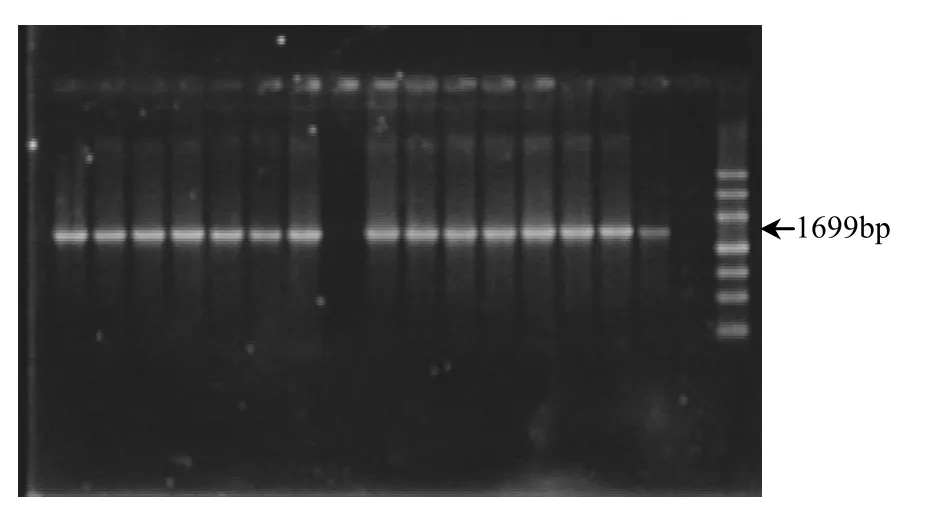
图1 Tn7的PCR检测Fig.1 PCR amplification of Tn7 from the genome of mutants
2.2 耐酸产氢突变菌株的筛选
转座子插入突变菌株接种于 LM液体培养基中,在起始 pH4.0条件下进行厌氧发酵产氢和耐酸驯化筛选.以Pantoea agglomerans野生菌株产氢量为对照,随机挑取的331株突变株中,筛选出9个突变株的产氢量有明显提高,其他突变菌株的产氢量与野生菌株相当或降低.在起始pH4.0培养条件下,以单位葡萄糖产氢气的摩尔数为标准进行比较,突变菌株TB220的产氢量最高,为(0.47 ± 0.02 )mol H2/mol 葡萄糖,比野生菌株提高70%.
2.3 突变菌株TB220产氢特性
2.3.1 稳定性 突变菌株TB220接种到厌氧平板培养基上作为第1代,以后每隔36h传代1次,分别于血清瓶中厌氧培养,测定其产气量和氢气含量,如此连续传代,共传代5次.取子代菌株提取DNA,进行PCR检测,在5代菌株中都能扩增出转座子特异性序列(1699bp).以上结果表明,转座子Tn7的插入具有稳定遗传性,这与Paul等[24]验证Tn5转座子在Burkeholderia glumae中稳定性的实验结果相一致.突变菌株TB220的产氢稳定性是通过5代菌株之间产氢量的差异来确定.由图2可以看出,突变菌株TB220连续传代5次,产氢量和氢气含量分别维持在(0.46±0.02)mol H2/mol葡萄糖和(25.93±2.39)%.
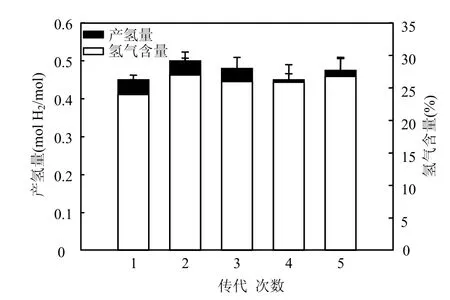
图2 突变菌株TB220的产氢稳定性Fig.2 Hydrogen production stability of mutantTB220
2.3.2 产氢过程 图3可以看出,起始pH4.0时,突变菌株TB220在发酵12h进人对数生长期,生物量最大值为 1.284,较原始菌株明显提高(原始菌株为0.646).突变菌株TB220发酵液pH值在发酵12h后开始明显下降,在发酵时间24h时发酵液 pH值基本不再变化,表明产氢主要发生在发酵时间 12~24h,产氢过程中发酵液 pH值在3.79~3.44之间.氧化还原电位(ORP)能够作为产氢过程的一个实时监测指标,高产氢率对应于发酵液的低ORP值[8].在产氢过程中发酵液ORP始终处于一个比较低的值(-33mV左右).
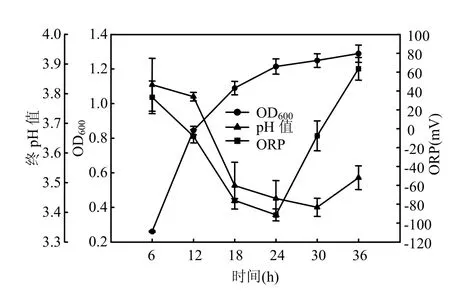
图3 起始pH 4.0培养条件下突变菌株TB220pH值, ORP和OD600变化Fig.3 Variation of pH,ORP and OD600 of mutantTB220 at the initial pH value of 4.0
2.3.3 耐酸性 由图4可见,在起始pH3.5~10.0的范围内突变菌株都能生长,最适生长 pH7.0.突变菌株TB220在pH3.5时不能产氢,在pH4.0~7.0测定其产氢特性.由图 4可以看出,突变菌株TB220在起始 pH4.0~7.0的范围内都能够产氢,最适产氢pH6.0,产氢量为(2.39±0.08)mol H2/mol葡萄糖.Yokoi等[16]分离到的耐酸产气肠杆菌HO-39最适发酵产氢pH值为6~7,在pH4.0下也能够生长与产氢,这与突变菌株TB220相当.
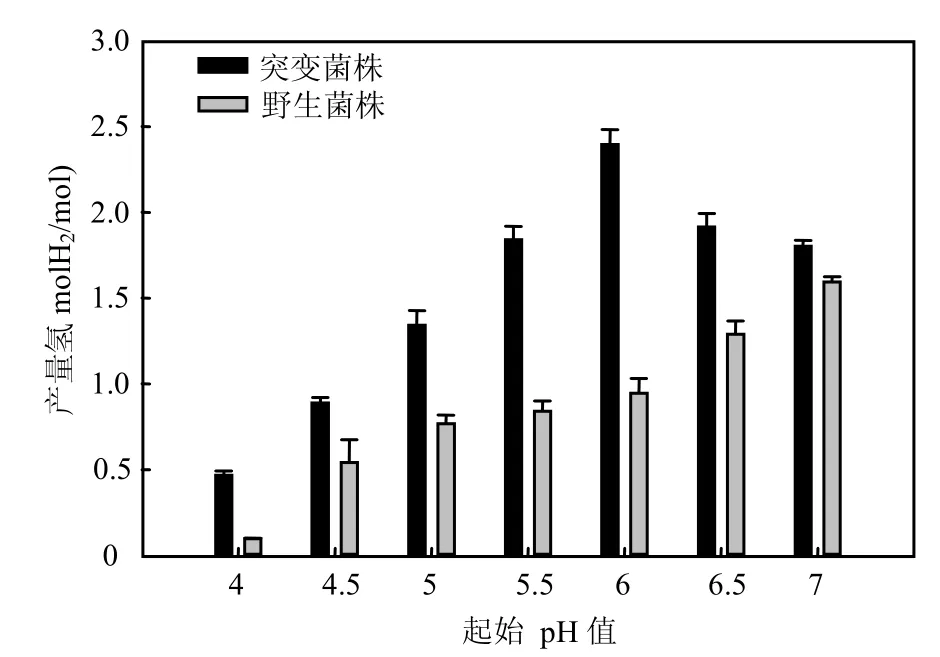
图4 起始pH值对突变菌株TB220产氢量的影响Fig.4 Effect of initial pH on hydrogen production of mutantTB220
起始pH4.0的培养条件下,成团泛菌野生菌株产氢能力明显下降,产氢量仅为(0.21±0.04) mol H2/mol葡萄糖,而突变菌株产氢量比野生菌株提高70%,显示出较明显耐酸产氢特性.与物理或化学诱变相比,转座子插入突变可以利用转座子的已知序列作为标签,在获得耐酸产氢突变菌株TB220的基础上,通过测定突变基因序列研究突变相关基因,为在分子水平上解释相关耐酸机理提供前提.
3 结论
3.1 利用Tn7转座子随机插入成团泛菌基因组DNA,获得一批产氢突变菌株,其中突变菌株TB220在起始pH4.0条件下具有较高产氢能力.
3.2 突变菌株TB220连续传代5次,通过卡那霉素选择性筛选和PCR验证,表明该突变菌株具有稳定的产氢遗传特性.
3.3 与野生菌株相比,突变菌株 TB220的耐酸性和产氢能力明显提高.在起始pH值4.0的海水培养条件下,突变菌株 TB220产氢量为(0.47 ± 0.02)mol H2/mol 葡萄糖,比野生菌株提高 70%,表现出较强耐酸性.
[1] Chin H L, Chen Z S, Chou C P. Fedbatch operation using Clostridium acetobutylicum suspension culture as biocatalyst for enhancing hydrogen production [J]. Bioechnology Progress, 2003, 19:383-388.
[2] Zhang H, Bruns M A, Logan B E. Biological hydrogen production by Clostridium acetobutylicum in an unsaturated fow reactor [J]. Water Resesrch, 2006,40:728-734.
[3] Levin D B, Pitt L, Love M. Biohydrogen production: prospects and limitations to practical application [J]. International Journal of Hydrogen Energy, 2004,29:173-185.
[4] Kumar N, Ghosh A, Das D. Redirection of biochemical pathways for the enhancement of H2production by Enterobacter cloacae [J]. Biotechnology Letters, 2001,23:537-541.
[5] Nakashimada Y, Rachman M A, Kakizono T, et al. Hydrogen production of Enterobacter aerogenes altered by extracellular and intracellular redox states [J]. International Journal of Hydrogen Energy, 2002,27:1399-1405.
[6] Fabiano B, Perego P. Thermodynamic study and optimization of hydrogen production by Enterobacter aerogenes [J]. International Journal of Hydrogen Energy, 2002,27:149-156.
[7] Xing D F, Ren N Q, Wang A J, et al. Continuous hydrogen production of auto-aggregative Ethanoligenens harbinense YUAN-3 under non-sterile condition [J]. International Journal of Hydrogen Energy, 2008,33:1489-1495.
[8] Zhu D L, Wang G C, Qiao H J, et al. Fermentative hydrogen production by the new marine Pantoea agglomerans isolated from the mangrove sludge [J]. International Journal of Hydrogen Energy, 2008,33:6116-6123.
[9] Valdez-Vazquez I, Ríos-Leal E, Muñoz-Páez K M. Effect of inhibition treatment, type of inocula and incubation temperature on batch H2production from organic solid waste [J]. Biotechnology and Bioengineering, 2006,95:342-349.
[10] Liu H Y, Wang G C, Zhu D L, et al. Enrichment of the hydrogen-producing microbial community from marine intertidal sludge by different pretreatment methods [J]. International Journal of Hydrogen Energy, 2009,34:9696-9701.
[11] Kawaguchi H, Hashimoto K, Hirata K, et al. H2production from algal biomass by a mixed culture of Rhodobium marinum A-501 and Lactobacillus amylovorus [J]. Journal of Bioscience and Bioengineering, 2001,91:277-282.
[12] Fang H H P, Zhu H G, Zhang T. Phototrophic hydrogen production from glucose by pure and co-cultures of Clostridium butyricum and Rhodobacter sphaeroides [J]. International Journal of Hydrogen Energy, 2006,31:2223-2230.
[13] Ding J, Liu B F, Ren N Q, et al .Hydrogen production from glucose by co-culture of Clostridium Butyricum and immobilized Rhodopseudomonas faecalis RLD-53 [J]. International Journal of Hydrogen Energy, 2009,34:3647-3652.
[14] Sun Q, Xiao W, Xi D, et al. Statistical optimization of biohydrogen production from sucrose by a co-culture of Clostridium acidisoli and Rhodobacter sphaeroides [J]. International Journal of Hydrogen Energy, 2010,35:4076-4084.
[15] Oh Y K, Seol E H, Kim M S, et al. Photoproduction of hydrogen from acetate by a chemoheterotrophic bacterium Rhodopseudomonas palustris P4 [J]. International Journal of Hydrogen Energy, 2004,29:1115-1121.
[16] Yokoi H, Ohkawara T, Hirose J. Characteristics of hydrogen production by aciduric Enterobacter aerogenes strain HO-39 [J]. Journal of Fermentation and Bioengineering, 1995,80:571-574.
[17] 任南琪,林 明,马汐平,等.厌氧高效产氢细菌的筛选及其耐酸性研究 [J]. 太阳能学报, 2003,24(1):80-84.
[18] Kondo T, Arakawa M, Hiral T, et al. Enhancement of hydrogen production by a photosynthetic bacterium mutant with reduced pigment [J]. Journal of Bioscience and Bioengineering, 2002, 93(2):145-150.
[19] 卢文玉,闻建平,陈 宇,等.激光诱变选育耐酸产氢菌产气肠杆菌 [J]. 化工进展, 2006,25(7):799-802.
[20] 宋 丽,刘晓风,刘培旺,等.微波诱变选育耐酸高效厌氧产氢菌[J]. 应用与环境生物学报, 2008,14(3):427-431.
[21] 郑国香,任南琪,李永峰,等.一株高效产氢突变体RF-9的筛选与产氢特性 [J]. 中国环境科学, 2007,27(2):184-188.
[22] Chen W M, Tseng Z J, Lee K S, et al. Fermentative hydrogen production with Clostridium butyricum CGS5 isolated from anaerobic sewage sludge [J]. International Journal of Hydrogen Energy, 2005,30:1063-1070.
[23] 支晓鹏,刘清锋,邬小兵.产氢菌Enterbacter sp.和Clostridium sp.的分离鉴定及产氢特性 [J]. 生物工程学报, 2007,23(1):152-156.
[24] Paul A Nakata. The generation of a transposon-mutagenized Burkeholderia glumae library to isolate novel mutants [J]. Plant Science, 2002,162:267-271.
Screening of an aciduric hydrogen producing mutant Pantoea agglomerans and characterization of hydrogenproduction.
LIU Hong-yan*, ZHU Da-ling, WANG Wen-lei (Tianjin Key Laboratory of Marine Resources and Chemistry, College of Marine Science and Engineering,Tianjin University of Science and Technology, Tianjin 300457, China) . China Environmental Science, 2012,32(1):125~129
A Tn7-based transposon was randomly inserted into genomic DNA of Pantoea agglomerans BH18, isolated from mangrove sludge. Mutants were screened by Kanrand amplification of the inserted sequences. At the initial pH 4.0, an aciduric and highly effective hydrogen producing mutant TB220 was screened using hydrogen production as screening index. The aciduric mutant TB220 was tested to have steady heredity and hydrogen-producing capability in several passages. The mutant TB220 was able to produce hydrogen over a wide rang of initial pH from 3.5 to 7.0, with an optimum initial pH of 6.0, and hydrogen production was (2.39 ± 0.08)mol H2/mol glucose. Under the marine conditions with the initial pH of 4.0 and glucose concentration of 10 g/L, hydrogen production of the mutant TB220 was (0.47 ± 0.02) mol H2/mol glucose, increasing by 70% compared with wild type. This indicated that the mutant showed high acid resistance capability.
Pantoea agglomerans;hydrogen production;transposon aciduric
2011-04-04
国家自然科学基金资助项目(40906074);天津市海洋资源与化学重点实验室开放基金(200912)
* 责任作者, 讲师, hongyanliu1214@163.com
X172
A
1000-6923(2012)01-0125-05
刘洪艳(1977-),女,吉林通化人,讲师,博士,主要从事海洋微生物研究.发表论文10余篇.
