IFN-γ、IL-1α、NGF-β和TNF-α在皖西白鹅小脑皮质发育中的表达
2012-12-25宋海燕刘再群
宋海燕, 刘再群, 郑 磊
(安徽师范大学 生命科学学院, 安徽省重要生物资源保护与利用重点实验室, 芜湖 241000)
IFN-γ、IL-1α、NGF-β和TNF-α在皖西白鹅小脑皮质发育中的表达
宋海燕, 刘再群*, 郑 磊
(安徽师范大学 生命科学学院,安徽省重要生物资源保护与利用重点实验室,芜湖241000)
用免疫组织化学strept actividin-biotin complex(SABC)法, 以干扰素-γ(IFN-γ)、白介素-1α(IL-1α)、神经生长因子-β(NGF-β)和肿瘤坏死因子-α(TNF-α)对胚龄13 d、19 d、24 d、28 d(E13、E19、E24、E28)和日龄7 d、15 d(P7、15)的皖西白鹅(Western Anhui white goose)小脑皮质中的阳性细胞进行定位和半定量检测, 探讨IFN-γ、IL-1α、NGF-β和TNF-α在小脑皮质发育中的作用。研究表明, 外颗粒层细胞在E13、E19、E24、E28、P7有IFN-γ和TNF-α阳性表达; 在E13、E19、E24、E28有IL-1α阳性表达; 在E13、E19、E24有NGF-β阳性表达; 且在所检测的6个时期中, 4种细胞因子均在E19表达最强。Purkinje细胞层在E13、E19、E24、E28、P7、P15均有IFN-γ、IL-1α、TNF-α阳性表达; 在E13、E19、E24、E28、P7有NGF-β阳性表达; 内颗粒层细胞在E13、E19、E24、E28、P7、P15有IFN-γ阳性表达; 在E13、E19、E24、E28、P7有IL-1α、TNF-α阳性表达; 在E13、E19、E24、E28有NGF-β阳性表达。结果表明,E19可能为小脑皮质发育的“关键期”; IFN-γ、IL-1α和TNF-α可能由小脑皮质自身合成; NGF-β可能由投射到Purkinje细胞的区域转运而来, 且可能在Purkinje细胞生长发育过程中起营养作用; IFN-γ可能在颗粒细胞迁移过程中起干扰作用。
皖西白鹅; 小脑皮质; 发育; 细胞因子; 免疫组织化学
干扰素-γ(interferon-γ, IFN-γ)、白介素-1α (interleukin-1α, IL-1α) 、神经生长因子-β (nerve growth factor-β, NGF-β)和肿瘤坏死因子-α (tumor necrosis factor-α, TNF-α)是细胞因子中的四个成员。它们分布在多种组织中, 可作为介质对神经系统起重要的调节作用。研究报道, 干扰素在大鼠中枢神经系统损伤、生长发育和生理功能中起重要作用(Popko et al, 1997); 白介素-1可促进星形胶质细胞的增殖与分化, 在大鼠胚胎发育中对中枢神经系统起重要的调节作用, 并通过作用于白介素-1受体(Interleukin1 receptor, IL-1R), 促进神经元合成和释放化学递质(Eriksson et al, 2000; Gustafson-Vickers et al, 2008); 神经生长因子在来亨鸡脊髓胚胎发育中对其生长发育起促进作用(Dai & Xiyang, 2009),并与大鼠小脑皮质Purkinje细胞的生理功能(Ba et al, 2006)和诱导猕猴神经样细胞的生成(Pei & Ji, 2003)等有关; 肿瘤坏死因子可促进大鼠星形胶质细胞分泌NGF(Cheng & Guo, 1999), 与大鼠的神经元的分化和神经退行性疾病(Oldreive & Doherty, 2010)等都有重要的关系。
皖西白鹅(Western Anhui white goose)是我国优良的中型鹅品种之一, 属于鸟纲雁形目鸭科动物, 是国家二级禽类保护动物, 并被确定为“国家级畜禽品种资源保护”品种。研究表明,成年皖西白鹅大脑和小脑表达促生长激素释放肽(ghrelin), 该物质可能以自分泌/旁分泌的形式调节中枢神经系统(Fang et al, 2008); 间脑、中脑和脑桥表达血管活性肠肽(vasoactise intestinal peptide, VIP), 可能与调节视觉、听觉和肌紧张的功能有关(Jiang et al, 2004, 2005)。而上述4种细胞因子在皖西白鹅中枢神经系统发育中的相关研究未见报道。鉴于此, 本实验通过免疫组织化学方法, 研究IFN-γ、IL-1α、NGF-β和TNF-α在皖西白鹅小脑皮质发育过程中的表达规律, 为进一步研究细胞因子在家禽中枢神经系统发育中的作用机制提供形态学依据。
1 材料与方法
1.1 材料及组织准备
由安徽省六安市裕安区国家级皖西白鹅种鹅场提供E13、E19、E24、E28皖西白鹅胚各3枚, P7、P15雏鹅各3只。胚蛋先剥开蛋壳, 取出新鲜鹅胚,入37 ℃生理盐水, 剥除胎膜, 以后试验步骤鹅胚和雏鹅相同。打开胸腔, 暴露心脏, 经主动脉依次灌注37 ℃生理盐水20~25 mL, 4 ℃的4%多聚甲醛40~50 mL; 打开颅腔, 迅速取出小脑(E13取整体脑); Bouin’s液固定48 h后, 梯度酒精脱水、透明和石蜡包埋; 连续切片, 厚度7 μm, 隔5张取5张, 形成5套切片(50片/套); 裱片于辛基酚聚氧乙烯醚硫酸盐(APES)处理的载玻片上, 置于37 ℃温箱烘干,分别用于IFN-γ、IL-1α、NGF-β、TNF-α免疫组化染色和阴性对照。
1.2 免疫组织化学染色
各发育时期的第1-4套切片采用免疫组化SABC法染色。一抗及SABC试剂盒(编号为SA1022)等均购自武汉博士德公司, 步骤如下; ①切片常规脱蜡至水; ②30%H2O21份+蒸馏水10份混合, 室温5~10 min以灭活内源性过氧化物酶, 蒸馏水洗3次;③热修复抗原, 冷却后PBS(pH7.2~7.6)洗涤1~2次; ④滴加5%BSA封闭液(来自SABC试剂盒), 室温20 min, 甩去多余液体, 不洗; ⑤滴加适当稀释的一抗(IFN-γ、IL-1α、NGF-β和TNF-α, 一抗均为即用型兔血清多克隆抗体, 浓度为5~10 µg/mL,编号依次为BA0952、BA1643、BA0611和BA0131), 4 ℃过夜, PBS洗2 min×3次; ⑥滴加生物素化二抗(即用型山羊抗兔IgG, 浓度为5~10 µg/mL, 编号为BA1003), 20~37 ℃ 20 min; PBS洗2 min×3次;⑦滴加试剂SABC, 20~37 ℃ 20 min, PBS洗5 min×4次;⑧DAB显色剂(为×20倍浓缩型显色试剂,编号为AR1022, 蒸馏水17份+试剂A、B、C各1份混匀)显色, 镜下控制时间, 一般为5~30 min; ⑨苏木素轻度复染, 常规脱水, 透明, 中性树胶封片。第5套切片做阴性对照实验, 以PBS代替一抗孵育切片, 其它步骤同SABC法。
1.3 数据处理
分别从各发育时期的IFN-γ、IL-1α、NGF-β和TNF-α免疫组化染色的切片中随机取10张。在Olympus BX-61型显微镜下观察, 并用Image-Pro Express 6.0图像分析软件进行图像采集和光密度(optical density, OD)值分析,并用mean±SD表示, 光密度值与免疫阳性程度呈正比, 即光密度值越大,阳性程度越强。采用SPSS17.0数据统计分析软件中的one way ANOVA进行显著性检验,P<0.05时为显著性差异,P>0.05为无显著性差异。
2 结 果
皖西白鹅小脑皮质是由位于菱形窝(rhomboid fossa)头端两侧的板状突起, 即小脑板(cerebellar plate)发生形成的。小脑皮质在E13由外向内形成外颗粒层(external granular layer, EGL)、Purkinje细胞层(Purkinje cell layer, PCL)和内颗粒层(internal granular layer, IGL); 在E19、E24、E28、P7和P15由外向内形成外颗粒层、分子层(molecular layer, ML)、Purkinje细胞层和内颗粒层四层。以下为四种细胞因子分别在皖西白鹅不同发育阶段小脑皮质中的免疫组织化学检测结果。
2.1 IFN-γ
EGL:E13、E19、E24、E28和P7有阳性细胞表达(图1a−e); P15细胞表达呈阴性。
ML:E24、E28、P7和P15有阳性细胞表达(图 1c−f)。
PCL:Purkinje细胞为IFN-γ阳性细胞。E13和E19胞质呈阳性表达(图1a,b); E24表达位于胞质和树突基部(图1c); E28表达位于胞体和主树突(图1d); P7表达主要位于胞质、主树突及其部分分支(图1e); P15表达主要位于胞质(图1f)。
IGL:E13、E19、E24、E28、P7和P15均有阳性细胞表达(图1a-f)。
2.2 IL-1α
EGL:E13、E19、E24和E28有阳性细胞表达(图2a−c); P7和P15细胞表达呈阴性。
ML:E24、E28、P7和P15有阳性细胞表达(图2c-f)。
PCL:Purkinje细胞为IL-1α阳性细胞。E13阳性表达位于胞质和胞核(图2a); E19表达位于胞质(图2b); E24和E28表达位于胞体及主树突(图2c, d); P7表达位于胞质和主树突(图2e); P15表达主要位于在胞质(图2f)。
IGL:E13、E19、E24、E28和P7有阳性细胞表达(图2a−e); P15细胞表达呈阴性(图2f)。
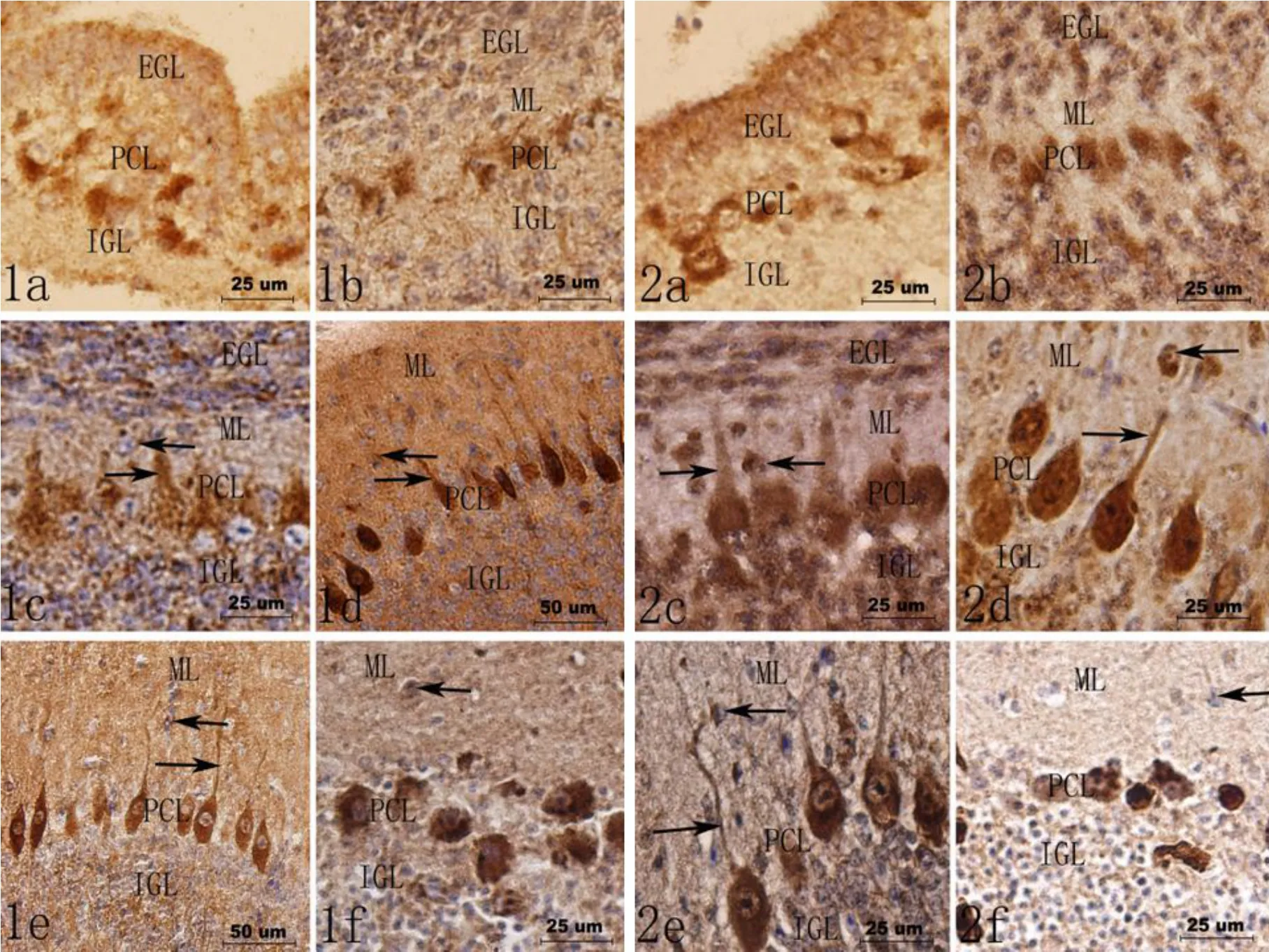

图1 小脑皮质发育中IFN-γ、IL-1α、NGF-β和TNF-α的表达Fig. 1 The expression of IFN-γ, IL-1α, NGF-β and TNF-α in the cerebellar cortex during development
2.3 NGF-β
EGL:E13、E19和E24有阳性细胞表达(图3a−c); E28、P7和P15细胞表达呈阴性。
ML:E24和E28有阳性细胞表达(图3c, d); P7和P15细胞表达呈阴性(图3e,f)。
PCL:Purkinje细胞为NGF-β阳性细胞。E13和E19阳性表达位于胞质(图3a, b); E24、E28和P7表达主要位于胞质和树突基部(图3c−e); P15表达呈阴性(图3f)。
IGL:E13、E19、E24和E28有阳性细胞表达(图3a−d); P7和P15细胞表达呈阴性(图3e, f)。
2.4 TNF-α
EGL:E13、E19、E24、E28和P7有阳性细胞表达(图4a−e); P15时细胞表达呈阴性。
ML:E24、E28、P7和P15均有阳性细胞表达(图4c−f)。
PCL:Purkinje细胞为TNF-α阳性主要反应细胞。E13和E19表达主要位于胞质(图4a, b); E24和E28阳性表达主要位于胞质和树突基部(图4c, d); P7阳性表达主要位于胞质和主树突(图4e); P15阳性表达位于胞质(图4f)。
IGL:E13、E19、E24、E28和P7有阳性细胞表达(图4a−e); P15细胞表达呈阴性(图4f)。
对照组切片为阴性(图5)。
2.5 IFN-γ、IL-1α、NGF-β和TNF-α的半定量检测
不同胚龄/日龄皖西白鹅小脑皮质EGL、PCL、IGL细胞中IFN-γ、IL-1α、NGF-β和TNF-α表达阳性反应产物的光密度值见表1。
由表1可见, 在皖西白鹅小脑皮质发育中, IFN-γ、IL-1α、NGF-β和TNF-α分别在外颗粒层、Purkinje细胞层和内颗粒层细胞中表达量不同。从同种细胞因子分析, IFN-γ的免疫反应强度, 在外颗粒层中, E13-E19表达上升, 并在E19表达最强, E19-P7表达呈下降趋势; 在Purkinje细胞层中, E13-E24表达趋于稳定(P>0.05), E24-E28表达上升,并在E28表达最强, 出壳后表达下降但趋于稳定(P7和P15,P>0.05); 在内颗粒层中, E13-E28表达呈上升趋势, 出壳后表达下降但趋于稳定(P7和P15,P>0.05)。IL-1α的免疫反应强度, 在外颗粒层中, E13-E19表达上升, E19表达最强, E19-E24表达下降, E24-E28表达趋于稳定(P>0.05); 在Purkinje细胞层中, E13-E24表达趋于稳定(P>0.05), E24-E28表达上升, E28-P15呈下降趋势; 在内颗粒层中, E13-P7表达呈上升趋势。NGF-β的免疫反应强度,在外颗粒层中, E13-E19表达上升, E19表达最强, E19-E24表达下降; 在Purkinje细胞层中, E13-E19表达上升, E19表达最强, E19-P7的表达呈下降趋势;在内颗粒层中, E13-E19表达上升, E19-E28表达呈下降趋势。TNF-α的免疫反应强度, 在外颗粒层中, E13-E24表达量趋于稳定(P>0.05), E24-E28表达下降, E28-P7表达上升; 在Purkinje细胞层中, E13-E19表达上升, E19-P7表达趋于稳定(P>0.05), P7-P15表达下降; 在内颗粒层中, E13-E19表达上升, E19-E28表达呈下降趋势, E28-P7表达上升。说明在皖西白鹅小脑皮质发育的不同时期IFN-γ、IL-1α、NGF-β和TNF-α的分泌量有所差异。

表1 IFN-γ、IL-1α、NGF-β和TNF-α免疫反应产物的光密度(mean±SD, n=10)Tab. 1 Optical densities of IFN-γ, IL-1α, NGF-β and TNF-α-immunoreactive cells in developmental cerebellar cortex (mean±SD, n=10)
3 讨 论
在小脑皮质的组织发生中, 神经上皮的迁移有其独特之处。小脑板上具有增殖能力的神经上皮细胞通过套层外迁到边缘层表面首先形成次生的外颗粒层, 外颗粒层细胞通过一段时间的有丝分裂后又进行内迁, 外颗粒层细胞内迁并最终定居于内颗粒层, 保留下来的部分细胞分化为篮细胞和星形细胞参与形成分子层。Purkinje细胞层是从室管膜层迁移的神经上皮细胞到外颗粒层下方形成的较大细胞带。研究表明, 从鸡小脑皮质发育早期(E3-E8)的E5开始, Purkinje细胞逐渐向外迁移到套层, 到E8时, Purkinje细胞成簇排列成一条带。在发育中期(E9-E15), 外颗粒层细胞开始向内迁移形成内颗粒层, 至发育后期的E16, 外颗粒层细胞大量内迁(Karam et al, 2000)。本实验结果显示, E13-E19外颗粒层细胞开始内迁并形成内颗粒层, 在E19期外颗粒层细胞开始大量内迁, 到P15趋于消失。这表明皖西白鹅和鸡小脑皮质发育的基本过程相似。在本实验所检测的六个时期中, 四种细胞因子在E19期的外颗粒层细胞表达程度均最强, 结合本实验组已发表的数据(Song et al, 已录用待发表资料), 推测E19期可能是皖西白鹅小脑皮质发育的“关键期”,是外颗粒层细胞开始大量内迁的标志, 有待于通过分子生物学技术进一步验证。
IFN-γ在促进大鼠神经元的发生和神经系统修复方面起重要作用(Kim et al, 2007), 并通过Janus激酶/信号转导和转录激活因子 [(Janus tyrosine kinase, Jak)/(signal transducers and activators of transcription, STAT), Jak-STAT]信号通路调节神经细胞的增殖与分化(Monroe et al, 2006)。提高IFN-γ在大鼠中枢神经系统表达可以诱导T细胞的浸润、激活巨噬细胞和上调诱导型一氧化氮合成酶(inducible nitric oxide synthase, iNOS)的活性, 参与中枢神经系统的免疫调节(Lin et al, 2008)。成年SD大鼠的小脑皮质中存在IFN-γ阳性细胞和纤维(Sun et al, 2002), 本实验未观察到IFN-γ阳性神经纤维,可能与小脑皮质处于发育期有关。在大鼠小脑皮质发育中, IFN-γ对外颗粒层细胞的迁移起干扰作用(Lin et al, 2004), 本实验表明, IFN-γ在E13-E19在外颗粒层细胞中表达上升, E19表达最强, E19后表达逐渐减弱, P15表达呈阴性。推测外颗粒层细胞在E13-E19内迁逐渐加强, IFN-γ的干扰作用上升; E19外颗粒层细胞内迁到达最大, IFN-γ的干扰作用也达到最强; E19后随小脑皮质逐渐发育, 外颗粒层细胞内迁逐渐减弱, IFN-γ的干扰作用也随之逐渐减弱; P15小脑皮质发育接近成熟, 内迁已完成, IFN-γ的干扰作用也随之消失。
IL-1在胚胎发育过程中对中枢神经系统起重要的调节作用, 可促进星形胶质细胞增殖与分化及神经递质的合成和释放 (Gustafson-Vickers et al, 2008); IL-1α在大鼠中脑能诱导神经干细胞分化为为神经元和神经胶质细胞(Liu et al, 2005); 胚胎期大鼠小脑胶质细胞中的IL-1α可产生活性氧(reactive oxygen species, ROS), 在炎症反应中起重要作用(Hong et al, 2006)。在大鼠小脑、大脑皮质和脑干等部位存在IL-1α mRNA的表达(Hong et al, 2006; Ohmi et al, 2009)。本实验结果显示, 在皖西白鹅小脑皮质发育中存在IL-1α, 其中Purkinje细胞为IL-1α的主要阳性反应细胞, 在E13、E19和E24的Purkinje细胞中表达趋于稳定, E24-E28时表达上升,出壳前后(E28和P7)表达强度均强于其他时期, P7-P15表达下降。推测IL-1α可促进Purkinje细胞合成和释放化学递质, E13、E19和E24小脑皮质处于生长发育的初期, Purkinje细胞合成和释放递质较为恒定; E24-E28小脑皮质开始进入快速发育成熟阶段, Purkinje细胞合成和释放递质随之增加; 在出壳前后(E28和P7)可能为小脑皮质发育成熟的快速阶段, Purkinje细胞加速合成和释放递质; P7-P15小脑皮质接近发育成熟, Purkinje细胞合成和释放递质随之减弱。
中枢神经系统内小胶质细胞可产生NGF-β, 具有重要的神经保护作用(Sawada et al, 2007), 在大鼠神经系统中NGF通过TrkA(tyrosine kinase-receptor)和NTR(p75 neurotrophin receptor)两种受体调节神经细胞的生存和凋亡(Yoon et al, 1998)。另有研究表明, 胚胎期食蟹猴小脑内的NGF表达水平较高, P60时则降到原水平的1/3(Hayashi et al, 1990)。在胚胎期14到21周山羊小脑皮质发育过程中, NGF-β在Purkinje细胞的表达随胚龄增加逐渐增强, 并对Purkinje细胞的生长发育起重要的营养作用(Qing et al, 2004)。本实验表明, NGF-β在E13-E19在Purkinje细胞层中表达上升, E19后表达程度随发育天数的增加而减弱, P15表达呈阴性。推测E13-E19的Purkinje细胞处于生长发育阶段, NGF-β的营养作用加强; E19后随着Purkinje细胞逐渐发育成熟, NGF-β的营养作用也逐渐减弱; P15时Purkinje细胞已经发育成熟, NGF-β的营养作用也随之消失。
中枢神经系统内神经细胞和小胶质细胞产生的TNF-α可促进T细胞的产生, 参与神经免疫调控(Virna et al, 2006), 并可作为一种神经调质或共存递质来调节中枢神经系统的功能(Breder et al, 1993),在促进星形胶质细胞分泌神经生长因子(Cheng & Guo, 1999)和神经元分化(Oldreive & Doherty, 2010)等方面也起重要作用。本实验结果显示, Purkinje细胞为TNF-α的主要阳性反应细胞, TNF-α在E13-E19在Purkinje细胞中表达上升, 在E19、E24、E28和P7表达趋于稳定, P7-P15表达下降。推测TNF-α可作为一种神经调质或共存递质参与调节小脑皮质的生长发育, E13-E19小脑皮质处于生长发育阶段, 调节作用上升; E19、E24、E28和P7小脑皮质处于发育成熟阶段, 调节作用稳定; P7-15小脑皮质接近发育成熟, 调节作用也随之减弱。
在皖西白鹅小脑皮质发育中, IFN-γ、IL-1α、NGF-β和TNF-α在外颗粒层、Purkinje细胞层和内颗粒层表达规律不同, 可能与它们在小脑皮质发育期间通过不同的作用机制参与发育和免疫调控有关。推测IFN-γ、IL-1α和TNF-α可能由小脑皮质自身合成, NGF-β可能由投射到Purkinje细胞的区域转运而来或自分泌产生, 它们作为神经递质或调质参与小脑皮质的发育和免疫调控。
Ba YC, Wang TH, Pan XH. 2006. Immunohistochemical study on the expression of NGF, BDNF and NT-3 in primary regions of brain of normal adult rats[J]. Anat Res,28(3): 165-168. [巴迎春,王廷华,潘兴华. 2006. NGF、BDNF和NT-3在正常成年大鼠主要脑区表达的免疫组织化学研究[J].解剖学研究,28(3): 165-168.]
Breder CD, Tsujimoto M, Terano Y, Scott DW, Saper CB. 1993. Distribution and characterization of tumor necrosis factor-α-like immunoreactivity in the murine central nervous system[J]. J Comp Neurol,337(4): 543-567.
Cheng XX, Guo J. 1999. Influence of tumor necrosis factor-α(TNF-α) on NGF secretion in newborn rat astrocytes in vitro-an experimental study[J]. Chin J Neur,5(3): 290-292. [程欣欣,郭静. 1999.肿瘤坏死因子影响星形胶质细胞分泌神经生长因子的实验研究[J].神经解剖学杂志,5(3): 290-292.]
Dai P, Xiyang YB. 2009. The expression level of NGF, BDNF and NT-3 in spinal cord of growthing embryonic chicken[J]. J Sichuan Univ (Med Sci Ed),40(4): 676-678. [戴萍,习杨彦彬. 2009. NGF、BDNF和NT-3在鸡胚脊髓发育中的表达变化[J].四川大学学报(医学版),40(4): 676-678.]
Eriksson C, Nobel S, Winblad B, Schultzberg M. 2000. Expression of interleukin-1αandβ, and interleukin1 receptor antagonist mRNA in the rat central nervous system after peripheral administration of lipopolysaccharides[J]. Cytokine,12(5): 423-431.
Fang FG, Jiang SD, Li MQ, Zhang LX, Li FB, Ding SQ. 2008. Immunohistochemical localization of ghrelin in the cerebrum and cerebellum of adult Wanxi white goose[J]. Chin J Vet Sci,28(7): 809-811. [方富贵,蒋书东,李梅清,张丽霞,李福宝,丁淑荃. 2008. Ghrelin在成年皖西白鹅大、小脑内的免疫组化定位[J].中国兽医学报,28(7): 809-811.]
Gustafson-Vickers SL, Lu VB, Lai AY, Todd KG, Ballanyi K, Smith PA. 2008. Long-term actions of interleukin-1βon delay and tonic firing neurons in rat superficial dorsal horn and their relevance to central sensitization[J]. Mol Pain,4(1): 63-73.
Hayashi M, Yamashita A, Shimizu K. 1990. Nerve growth factor in the primate central nervous system: regional distribution and ontogeny[J]. Neuroscience,36(3): 683-689.
Hong YB, Kim EY, Jung SC. 2006. Upregulation of proinflammatory cytokines in the fetal brain of the gaucher mouse[J]. J Korean Med Sci,21(4): 733-738.
Jiang SD, Zhang XR, Li FB, Zhang LX, Fang FG. 2005. Immunohistochemical localization of vasoactive intestinal peptide (VIP) in diencephalons of Wanxi goose[J]. Chin J Vet Sci,25(5): 502-504. [蒋书东,章孝荣,李福宝,张丽霞,方富贵. 2005.血管活性肠肽在皖西白鹅间脑内的定位分布[J].中国兽医学报,25(5): 502-504.]
Jiang SD, Zhou TH, Zhang LX, Zhang XR, Li FB. 2004. Immunohistochemical localization of vasoactive intestinal peptide in midbrain and pons of Wanxi white goose[J]. Chin J Vet Sci Technol,34(11): 59-62. [蒋书东,周天红,张丽霞,章孝荣,李福宝. 2004.血管活性肠肽在皖西白鹅中脑和脑桥内的分布[J].中国兽医科技,34(11): 59-62.]
Karam SD, Burrows RC, Logan C, Koblar S, Pasquale EB, Bothwell M. 2000. Eph receptors and ephrins in the developing chick cerebellum: relationship to sagittal patterning and granule cell migration[J]. J Neurosci,20(17): 6488-6500.
Kim SJ, Son TG, Kim K, Park HR, Mattson MP, Lee J. 2007. Interferon-γpromotes differentiation of neural progenitor cells via the JNK pathway[J]. Neurochem Res,32(8): 1399-1406.
Lin WS, Kemper A, Mccarthy KD, Pytel P, Wang JP, Campbell IL, Utset MF, Popko B. 2004. Interferon-γinduced medulloblastoma in the developing cerebellum[J]. J Neurosci Res,24(45): 10074-10083.
Lin WS, Kunkler PE, Harding HP, Ron D, Kraig RP, Popko B. 2008. Enhanced integrated stress response promotes myelinating oligodendrocyte survival in response to interferon-γ[J]. Am J Pathol,173(5): 1508-1517.
Liu B, Liu HT, Peng CH, Tian YH. 2005. Interleukin-1αinduce differentiation of mesencephalic neural stem cells of embryo mice-derived[J]. J Yangtze Univ (Nat Sci Ed),2(12): 343-346. [刘兵,刘洪涛,彭超华,田毅浩. 2005. IL-1α诱导胚鼠中脑神经干细胞分化的实验研究[J].长江大学学报(自然科学版),2(12): 343-346.]
Monroe RK, Halvorsen SW. 2006. Mercury abolishes neurotrophic factor-stimulated Jak-STAT signaling in nerve cells by oxidative stress[J]. Toxicol Sci,94(1): 129-138.
Ohmi Y, Tajima O, Ohkawa Y, Mori A, Sugiurac Y, Furukawa K, Furukawa K. 2009. Gangliosides play pivotal roles in the regulation of complement systems and in the maintenance of integrity in nerve tissues[J]. Proc Natl Acad Sci USA,106(52): 22405-22410.
Oldreive CE, Doherty GH. 2010. Effects of tumour necrosis factor-alpha on developing cerebellar granule and Purkinje neurons in vitro[J]. J Mol Neurosci,41(1): 44-52.
Pei YJ, Ji WZ. 2003. Induced differentiation and apoptosis of rhesus monkey embryonic stem cells[J]. Zool Res,24(3): 161-167. [裴轶劲,季维智. 2003.猕猴胚胎干细胞的诱导分化和凋亡[J].动物学研究,24(3): 161-167.]
Popko B, Corbin JG, Baerwald KD, Dupree J, Garcia AM. 1997. The effects of interferon-γon the central nervous system[J]. Mol Neurobiol,14(1-2): 19-35.
Qing SZ, Xu YP, Zhao HY, Zhang Y. 2004. Expression of NGF and TrKA in developing cerebellum of goat fetus[J]. Animal Biotechnology Bulletin,9(1): 218-223. [卿素珠,徐永平,赵慧英,张涌. 2004.山羊小脑发育过程中NGF及其受体TrKA的表达[J].动物生物技术通讯,9(1): 218-223.]
Sawada H, Hishida R, Hirata Y, Ono K, Suzuki H, Muramatsu SI, Nakano I, Nagatsu T, Sawada M. 2007. Activated microglia affect the nigro-striatal dopamine neurons differently in neonatal and aged mice treated with 1-methyl-4-phenyl-1, 2, 3, 6-tetrahydropyridine[J]. J Neurosci Res,85(8): 1752-1761.
Song HY, Liu ZQ, Zheng L. The expression of DRD1 in the development cerebellar cortex of wan-xi white goose[J]. Sichuan Journal of Zoology (accepted, in publish) [宋海燕,刘再群,郑磊.多巴胺受体1在皖西白鹅小脑皮质发育中的表达[J].四川动物. (已录用,待发表)]
Sun ZH, Zhao HY, Huge JLT, Ouyang WQ, Yang ZQ, Chen SL, Li YL. 2002. Immunohistochemical localization of IFN-γin cerebellum of rats[J]. Chinese Journal of Veterinary Science,22(1): 59-60. [孙志宏,赵慧英,胡格吉乐图,欧阳五庆,杨增岐,陈树林,李育良. 2002. IFN-γ在大鼠小脑内定位分布的免疫组织化学研究[J].中国兽医学报,22(1): 59-60.]
Virna S, Decker M, Lütjen S, Soltek S, Foulds KE, Shen H, Körner H, Sedgwick JD, Schlüter D. 2006. TNF is important for pathogen control and limits brain damage in murine cerebral listeriosis[J]. J Immunol,177(6): 3972-3982.
Yoon SO, Casaccia-Bonnefil P, Carter B, Chao MV. 1998. Competitive signaling between TrkA and p75 nerve growth factor receptors determines cell survival[J]. J Neurosci,18(9): 3273-3281.
Expression of IFN-γ, IL-1α, NGF-β and TNF-α during the development of cerebellar cortex of Western Anhui white goose
SONG Hai-Yan, LIU Zai-Qun*, ZHENG Lei
(Provincial Key Laboratory for the Conservation and Utilization of Important Biological Resources, College of Life Sciences, Anhui Normal University, Wuhu 241000, China)
The strep avidin-biotin-peroxidase complex (SABC) immunohistochemical methods were applied to investigate the localization and semi-quantitative distribution of IFN-γ, IL-1α, NGF-β and TNF-α-immunoreactive cells in the cerebellar cortex of Western Anhui white goose at embryonic day 13, 19, 24, 28 (E13, E19, E24, E28) and postnatal day 7, 15 (P7, P15). The possible roles of IFN-γ、IL-1α、NGF-β and TNF-α in the development of cerebellar cortex were discussed. The results indicated that in the external granular layer, there were IFN-γ and TNF-α positive cells at E13, E19, E24, E28, P7, IL-1α positive cells at E13, E19, E24, E28 and NGF-β positive cells at E13, E19 , E24. The expression levels of these four cytokines all reached peaks at E19 of the six tested periods in this study. In the Purkinje cell layer, there were IFN-γ, IL-1α and TNF-α positive cells at E13, E19, E24, E28, P7, P15 and NGF-β positive cells at E13, E19, E24, E28, P7. In the internal granular layer, there were IFN-γ positive cells at E13, E19, E24, E28, P7, P15, IL-1α and TNF-α positive cells at E13, E19, E24, E28, P7 and NGF-β positive cells at E13, E19, E24, E28. These results showed that E19 might be the “critical stage” in the cerebellar cortex development of Western Anhui white goose. IFN-γ, IL-1α and TNF-α might be synthesized by cerebellar cortex itself, and NGF-β could be transported from regions which project to Purkinje cells. IFN-γ may interfer the transfer of granular cells, and NGF-β may have neurotrophic functions that are beneficial to the growth and development of Purkinje cells.
book=33,ebook=421
Western Anhui white goose; Cerebellar cortex; Development; Cytokines; Immunohistochemistry
Q426; Q593+.2; Q915.865
A
0254-5853-(2012)02-0211-07
10.3724/SP.J.1141.2012.02211
2011-12-01;接受日期:2012-01-09
安徽师范大学博士科研启动基金(160-750932),生科院联合开放课题经费; “安徽重要生物资源保护与利用研究”安徽省重点实验室科研基金
∗通信作者(Corresponding author),E-mail: liuzaiqun@126.com
宋海燕(1986−),男,安徽肥东人,硕士研究生,研究方向:神经生物学, E-mail: songhaiyan009@126.com
book=2,ebook=426
猜你喜欢
杂志排行
Zoological Research的其它文章
- Bacterial expression and purification of biologically active human TFF2
- 酸性环境下铝对斑马鱼运动行为和学习记忆能力的影响暨与阿尔海默茨症的相互关系
- Smallest bitter taste receptor (T2Rs) gene repertoire in carnivores
- A new spider species of the genus Sudharmia from Sumatra, Indonesia (Araneae, Liocranidae)
- Complete mitogenome of the Lesser Purple Emperor Apatura ilia (Lepidoptera: Nymphalidae: Apaturinae) and comparison with other nymphalid butterflies
- Acute lesions of primary visual cortical areas in adult cats inactivate responses of neurons in higher visual cortices
