松江鲈鱼野生群体遗传多样性的RAPD分析和SCAR标记的转化
2012-12-25刘至治潘连德唐文乔耿云皓
曾 珍, 刘至治, 潘连德, 唐文乔, 王 茜, 耿云皓
(上海海洋大学 省部共建水产种质资源发掘与利用教育部重点实验室, 上海 201306)
松江鲈鱼野生群体遗传多样性的RAPD分析和SCAR标记的转化
曾 珍, 刘至治*, 潘连德*, 唐文乔, 王 茜#, 耿云皓#
(上海海洋大学 省部共建水产种质资源发掘与利用教育部重点实验室,上海201306)
首先, 从294条10个碱基随机引物中, 筛选出32条多态性引物, 对富春江、黄河、滦河和鸭绿江等4个松江鲈鱼 (Trachidermus fasciatus)野生群体共120尾个体进行RAPD分析。结果表明, 松江鲈鱼野生群体的遗传多样性较丰富,其主要表现在:① 在扩增得到的591个位点中, 有515个(87.14%)位点呈现多态性,群体间多态位点比率(P)的大小顺序为:富春江群体89.17%>黄河群体87.99%>鸭绿江群体86.63%>滦河群体83.25%。② 松江鲈鱼群体间的Shannon信息指数(IT)和Nei’s遗传多样性指数(HT)分别在0.3393~0.3566和0.2157~0.2279间, 滦河群体的值较其他3群体稍低;若作为一个整体, 则总的 Shannon信息指数(IT)和Nei’s遗传多样性指数(HT)分别为0.3710±0.2153和0.2336±0.1643。③ 虽然群体间基因流值(Nm)在5.76103~19.84497间, 显示各地理群体间存在程度不同的基因交流, 但分子方差分析(AMOVA)结果却表明, 各群体间存在显著(P<0.05)或极显著(P<0.01)的遗传分化。④ 聚类分析表明, 鸭绿江群体首先与黄河群体聚为一支, 再与富春江群体相聚, 最后与单独一支的滦河群体聚类, 表明鸭绿江、黄河、富春江等3群体间的遗传距离与彼此间的地理距离远近密切相关, 而滦河群体与它们的遗传距离较远。其次, 从获得的S1225525bp、S1225605bp、S1225841bp、S1345695bp、S1345825bp等5个特异RAPD条带中, 成功地由S1225605bp、S1225841bp条带分别转化出SCAR01560bp、SCAR02443bp的SCAR标记。这两个标记的出现频率, 在鸭绿江群体最高(96.67%和93.33%)、富春江群体其次(83.33%和90%)、黄河群体再其次(56.67%和66.67%)、滦河群体最低(13.33%和20%)。因此, SCAR01560bp、SCAR02443bp可作为鉴别松江鲈鱼滦河群体与其他3群体的分子标记。
松江鲈鱼; 遗传多样性; RAPD; SCAR标记
松江鲈鱼 (Trachidermus fasciatus, Heckel)隶属于鲉形目(Scorpaeniformes)杜父鱼科(Cottidae)松江鲈鱼属(Trachidermus), 俗称“四鳃鲈”等, 是一种降海溯河洄游性鱼类(Hubei Institute of Hydrobiology Laboratory of Ichthyology, 1976)。它个体不大, 但自古被誉为佳品, 其分布曾被认为仅局限于长江口咸淡水域及附近小河中(Hubei Institute of Hydrobiology Laboratory of Ichthyology, 1976);不过, 最近Wang (2006)报道, 该鱼从日本南部、朝鲜西南部到中国东部沿海及相邻淡水水域都有分布。在中国, 随着经济的发展, 因气候变化、环境污染及水利设施的修建等诸多因素的影响, 松江鲈鱼资源日益枯竭、种群濒危, 已于1988年被列为国家二级保护动物 (Wang & Liang,2008)。进入21世纪以来, 先后有研究者从形态、生化遗传到分子水平上对松江鲈鱼的种质资源进行了分析(Liu et al, 2010; Wang et al, 2001, 2002; Wang & Liang, 2008; Xu et al, 2008, 2009), 但这些报道受限于野生个体难觅等原因, 研究结果尚难以全面、客观地反映中国现有松江鲈鱼野生种群的遗传多样性现状; 另一方面, 关于松江鲈鱼种群分化问题, 研究者的观点也不尽一致(Liu et al, 2010; Wang et al, 2001, 2002; Wang & Liang,2008; Xu et al, 2008, 2009)。因此, 采用其他分子标记方法, 从不同侧面进一步探讨这些问题十分必要。
随机扩增多态性DNA(random amplified polymorphic DNA, RAPD)技术是由Wiliams et al(1990)和Welsh et al(1990)提出的一种具有简单、快速、高效等特点的分子标记, 已被广泛地应用于生物的亲缘关系、遗传多样性、群体遗传、种质鉴定等多方面的研究(Barman et al, 2003; Gao et al, 2007; Yan et al, 2005)。序列特定扩增区域标记(sequence characterized applied region, SCAR)是在RAPD技术基础上发展起来的一种可靠、稳定、可长期利用的标记技术, 因其具有稳定性好、重现性高等特点, 已被国内外研究者广泛应用于大西洋鲑(Salmo salar)、虹鳟(Oncorhynchus mykiss)(Zhang et al, 2007)、团头鲂(Megalobrama amblycephala) (Zou et al, 2005)、“新吉富”尼罗罗非鱼(Oreochromis niloticus)(Li et al, 2010)、瓯江彩鲤(Cyprinus carpiovar. color)(Lu et al, 2011)、奥利亚罗非鱼(Oreochromis aureus)(Gao et al, 2008)等许多水产动物的群体间特异性分子标记或品系鉴别。本研究采用RAPD-SCAR分析方法, 既从核基因组角度分析松江鲈鱼的群体遗传多样性, 又力求寻找地理群体间的分子标记, 为松江鲈鱼种质资源的保护与利用、种群鉴别提供基础资料。
1 材料与方法
1.1 材料
试验所用的野生松江鲈鱼样本, 分别采自浙江富春江(简称富春江群体, 用FR表示)、山东黄河入海口(简称黄河群体, 用YR表示)、河北滦河(简称滦河群体, 用LR表示)、辽宁鸭绿江(简称鸭绿江群体, 用YL表示)。每个群体均采集活鱼30~40尾,剪取约0.2 g右胸鳍, 放入1.5 mL离心管中, 先用95%酒精保存48 h后, 换用75%酒精保存于4 ℃冰箱中备用。
1.2 方法
1.2.1 基因组DNA的提取 采用常规的“酚-氯仿”法, 参照文献(Liu et al, 2009)的方法进行。提取的DNA于−20 ℃冰箱保存备用。
1.2.2 RAPD-PCR扩增 10 碱基随机引物294条(引物编号为S11-S40、S122-S185、S1210-S1409), 购自上海生工生物工程技术服务有限公司。参照说明书配置浓度 5 μmol/L, −20 ℃冰箱保存备用。PCR反应体系25 μL:包括含2.5 μL buffer、1 μL dNTPs (2.5 μmol/L), 引物2 μL、2μL基因组DNA、0.6 μLTaqDNA聚合酶(北京艾德莱生物科技有限公司, 5 U/μL)、16.9 μL去离子水(天根生化有限公司)。反应条件为:94 ℃预变性3 min, 94 ℃变性45 s、36℃退火45 s、72 ℃延伸90 s, 45个循环后, 72 ℃延伸10 min。所有PCR 反应均在Mastercycler ep gradient S (Eppendorf)型PCR仪上进行。取10 μL PCR扩增产物, 经凝胶(含EB 0.5 μg/mL)电泳(5 V/cm)1.5 h后, 用BIO-RAD Gel Doc XR凝胶成像系统拍照和分析。
1.2.3 数据分析 经电泳获得的RAPD 图谱, 在同一电泳迁移位置上, 有 RAPD 扩增条带的计为1, 没有的计为 0, 将每群体所有个体在全部位点上的谱带式样组成一个“0或 1”矩阵。在假定Hardy-Weinberg平衡下, 用POPGENE 32软件进行分析, 计算多态位点数、多态位点比例(P)、Nei’s 遗传多样性指数(HT)、Shannon 信息指数(IT)、群体间遗传相似度及群体间遗传距离等。根据群体间的遗传距离, 用MEGA4.0 (Tamura et al, 2007)软件包中的“UPGMA”程序对4个群体进行聚类分析, 用Arlequin 3.0(Excoffier et al, 2005) 软件进行分子方差分析(analysis of molecular variance, AMOVA), 计算遗传分化指数(Fst)。
1.2.4 RAPD产物的克隆 利用 DNA 快速回收试剂盒(北京艾德莱生物科技有限公司), 从1.8%琼脂糖凝胶中回收纯化RAPD特异片段。将纯化片段连接到pMD19-T Vector载体(TaKaRa公司), 然后转化入TOP10感受态细胞(天根生化有限公司)。根据蓝白斑原理, 挑选白色菌落进行摇菌, 用M13+/-引物做菌落PCR、筛选鉴定阳性克隆, 每个个体挑选3个阳性克隆进行测序(上海美吉生物医药有限公司)。
1.2.5 SCAR标记的筛选 将RAPD扩增产生的特异性条带回收并克隆、测序。根据测序结果, 用Primer Premier3.0(Rozen & Skaletsky, 2000)软件设计19~25 bp的正反引物, 先经小样本(每群体8个体)PCR筛选, 对仍能扩增出目的条带的引物再进行大样本(每群体30个体)验证。PCR 扩增参数基本与RAPD分析保持一致, 但退火温度稍做变动(表1)、循环次数减为35个。
2 结 果
2.1 RAPD扩增结果
本研究从294条10碱基随机引物中, 筛选出32条扩增结果稳定、重复性好的引物(图1), 对4个松江鲈鱼群体进行RAPD分析。获得的总位点数为591个, 其中多态位点数515个(87.14%), 平均每条引物产生18.46个位点, 扩增片段大小集中在200~2 500 bp间。松江鲈鱼群体间的多态性位点比例(P)的大小顺序为:富春江群体(FR)89.17%>黄河群体(YR)87.99%>鸭绿江群体(YL)86.63%>滦河群体(LR)83.25%。

表1 SCAR标记的引物序列、退火温度及扩增片段大小Tab. 1 Primer sequence, annealing temperature and size of PCR band of SCAR markers

图1 引物S1255(A)和S1345(B)的扩增结果Fig. 1 The amplification results of primer S1255 (A) and S1345(B)
在4群体间, 共获得5条特异性RAPD扩增带(图1A,B, 箭头所指)。其中, 引物S1255有3条特异性带:条带S1255525bp在FR、YL两群体的出现率很低, 仅6.67%, 即只有2个体检测到此位点, 而在YR、LR群体却较高, 分别为23.33%、76.67%; 与此相反, 条带S1255605bp在FR、YL两群体的出现率(90%、93.33%)最高, 而在YR群体为73.33%、在LR群体仅13.33%; 条带S1255841bp在4群体间的出现频率与S1255605bp类似, 大小顺序为:YL (96.67%)>FR (90%)>YR (83.33%)>LR(13.33%)。引物S1345有2条特异性带:S1345695 bp和S1345825 bp, 其出现率在YL群体均为100%, 在FR和YR两群体均为93.33%, 而在LR群体中却只有16.67%。
2.2 群体遗传多样性与遗传分化
4个松江鲈鱼群体间的Shannon信息指数(IT)、Nei’s遗传多样性指数(HT)分别在0.3393~0.3566和0.2157~0.2279间(表2)。比较而言, LR群体的值较其它3群体稍低。若将4群体看成一个整体, 则总群体的Shannon信息指数(IT)、Nei’s遗传多样性指数(HT)分别为0.3710±0.2153、0.2336±0.1643。可见,松江鲈鱼群体的基因多样性较高。

表2 松江鲈鱼群体的Shannon信息指数(IT)和Nei’ s遗传多样性指数(HT)Tab. 2 Shannon’s information index (IT)and the Nei’ s genetic diversity (HT) in the populations of Trachidermus fasciatus
分子方差分析(AMOVA)结果表明(表3), 在遗传变异的总方差中, 仅4.63%的差异来自群体间,而95.37%的差异存在于群体内个体间。4群体总遗传分化指数(Fst)为0.0463。由表4可知, 群体间的Fst值在0.02458~0.07986间, 其中LR群体与FR、YL、YR群体的Fst值都较大, YR、YL群体间的Fst值最小(0.02458), 群体间存在显著(P<0.05)或极显著(P<0.01)的遗传分化。不过, 由基因流值(Nm)的大小可知, 各地理群体间均存在一定程度的基因交流,其中YR、YL群体间的Nm最强(19.84497), 而FR、LR群体Nm最弱(5.76103)(表4)。
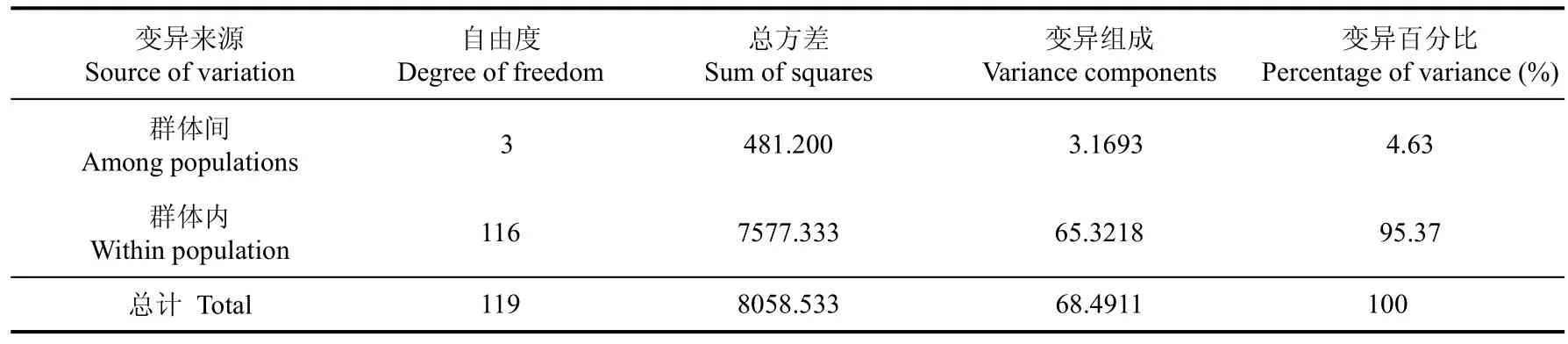
表3 松江鲈鱼群体间遗传差异的 AMOVA分析Tab. 3 AMOVA analyses in the populations of Trachidermus fasciatus

表4 松江鲈鱼群体间基因交流值(Nm, 对角线上方)与遗传分化指数 (Fst, 对角线下方)Tab. 4 The value of gene flow (Nm,above diagonal) and Genetic differentiation index (Fst,below diagonal) among the four populations of Trachidermus fasciatus
2.3 聚类分析
YR和YL群体间的遗传相似度最大而遗传距离最小, 分别为0.9919和0.0082; 相反, FR和LR群体间的遗传相似度最小而遗传距离最大, 分别为0.9757和0.0246(表5)。根据遗传距离进行聚类分析表明, YL群体与YR群体首先聚为一支, 然后与FR群体聚类, 最后与单独为一支的LR群体相聚(图2)。显然, LR群体与其他3个群体间的遗传距离较远, 而YL、YR、FR群体间的亲缘关系与彼此间地理距离的远近密切相关。
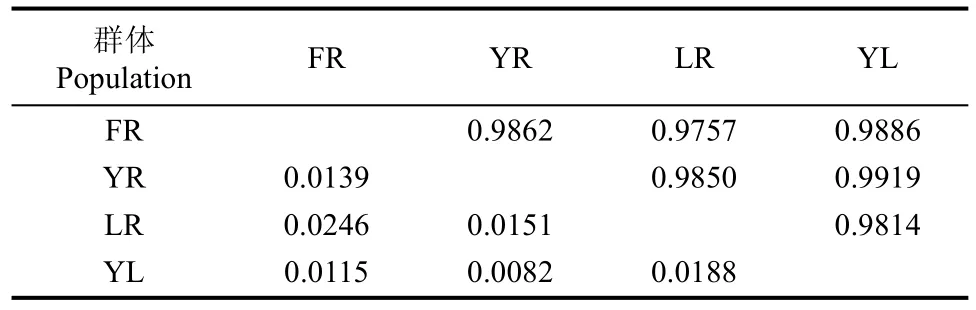
表5 群体间的遗传相似度(对角线上方)和遗传距离(对角线下方)Tab. 5 Genetic identity (above diagonal) and genetic distance (below diagonal) within or among populations of Trachidermus fasciatus

图2 基于遗传距离的4个松江鲈鱼群体间的UPGMA聚类分析Fig. 2 Dendrogram o f the four populations of Trachidermus fasciatus by UPGMA based on genetic distance
2.4 特异性RAPD条带的克隆、测序及SCAR标记的建立与验证
对5个特异性RAPD条带进行测序后发现, 它们的大小分别为520、600、840、690和820 bp左右, 与RAPD扩增的条带大小基本一致(图1), 表明得到的序列是真实的目的片段。在这5个特异性条带上成功设计了5对SCAR标记引物, 但经小样本PCR验证后发现, 只有S1255605bp和S1255841bp(GenBank序列号:JN714551、JN714552)仍能扩增出特异性目的片段(表1, 图3), 其余3个标记(序列未上传)的特异性消失。又因考虑引物中G、C碱基的含量, 特异性引物的上、下游位置未从序列的两端开始, 而是移向了序列的中间部分, 故所得的SCAR标记SCAR01560bp、SCAR02443bp的长度分别要比对应的RAPD标记短(表1, 图3)。接着, 为进一步检测SCAR标记的有效性, 在松江鲈鱼4群体共120尾个体中进行大样本验证。结果表明, SCAR01560bp标记在FR、YR和YL群体的出现频率分别高达83.33%(25/30)、56.67%(17/30)及96.67% (29/30); 而在LR群体的30个体中, 仅4尾具有此标记, 出现频率很低(13.33%)。同样, SCAR02443bp标记在FR、YL两群体的出现频率也很高, 分别为90%(27/30)和93.33%(28/30); 在YR群体的出现频率也较高, 为66.67%(20/30); 但在LR群体出现的频率比较低, 仅20%(6/30)。可见, SCAR01560bp和SCAR02443bp可作为鉴别松江鲈鱼LR群体与其他3群体的特异性分子标记。
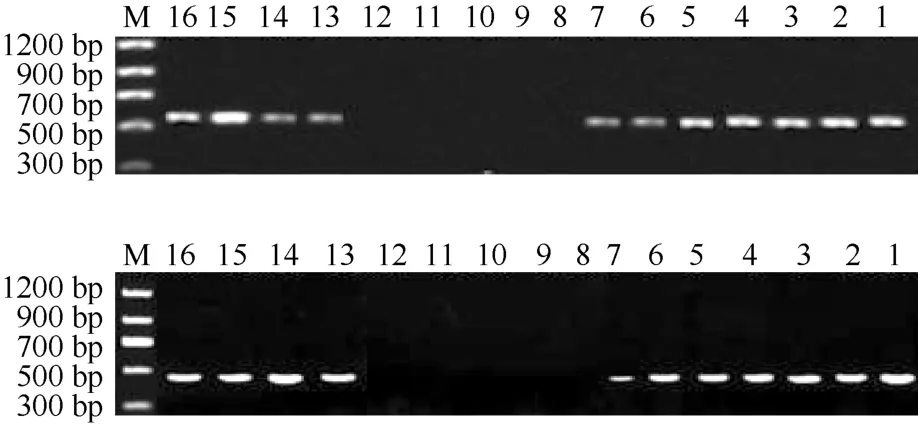
图3 S1255605bp和S1255841bp片段的 SCAR转化Fig. 3 SCAR bands from S1255605bp and S1255841bp markersA: SCAR01560bp; B: SCAR02443bp。 M:Marker;1~4:FR群体(FR population); 5~8:YR群体(YR population); 9~12:LR群体(LR population); 13~16:YL群体(YL population)。
3 讨 论
3.1 松江鲈鱼群体遗传多样性与种群遗传结构
现代遗传学的观点认为, 遗传多样性的高低与一个物种的适应能力、生存能力及进化潜能密切相关。遗传多样性的下降, 可能导致物种对环境适应能力的降低(Liu et al, 2009; Vrijenhoek,1994)。因此,了解濒危物种的群体遗传多样性, 对其保护与管理策略的制定具有重要意义。关于松江鲈鱼群体遗传多样性, 先后有过一些生化遗传、分子遗传等方面的报道。同工酶的分析结果表明, 鸭绿江流域天然种群的多态位点比例(10%)和平均杂合度(0.03), 在鱼类中均低于平均值(Wang et al, 2002); Xu et al (2009)通过ISSR技术, 发现松江鲈鱼丹东、秦皇岛群体的多态位点比例(44%)等遗传指标均较低。而Liu et al (2010)通过线粒体控制区序列的多态性分析发现, 松江鲈鱼丹东、盘锦、秦皇岛群体的单倍型多样指数(Hd)维持在一个较高水平(0.989~1.00)。这些结论的不一致, 可能与作者所用同工酶多态位点 (2个)、ISSR多态性引物数量(4个)及群体样本数量(6~15尾个体)偏少有关。本研究借助RAPD技术, 使用32个多态性10碱基随机引物, 从整个基因组水平上, 对分布于较大地理范围里的4个松江鲈鱼地理种群共120个体(每群体30尾样本)进行分析, 结果表明,鸭绿江群体(YL)与黄河群体(YR)、富春江群体(FR)的多态位点比例(P)在86.63%~89.17%间, 只滦河群体(LR)略低 (83.25%)。这些值虽低于野生大弹涂鱼(Boleophthalmus pectinirostris, 93.02%~96.35%, Liu et al, 2009)、野生小黄鱼(Larimichthys polyactis, 91.03%, Han et al, 2007), 但高于半滑舌鳎(Cynoglossus semilaevisGüntuer, 76%~80%, Han et al, 2007)。故此, 我们认为野生松江鲈鱼的遗传多样性尚较丰富。
种群遗传结构是指遗传多样性在群内、群间的分布, 即遗传分化。种群遗传结构可反映种群大小、繁育系统、隔离程度和迁徙格局的时空动态。分化是种群偏离共同祖先所经历的进化过程, 反映了种群间遗传差异的大小和距离的远近。环境为种群分化提供了特定场所, 自然选择使分化得以实现(Tang et al, 2011)。关于松江鲈鱼种群分化问题, 先后有些零星的报道。从表型性状上看, Wang et al (2008)发现, 松江鲈鱼鸭绿江、青龙河和富春江等3个群体的分化虽未达到亚种水平, 但鸭绿江群体与其它两个群体的差异较大。在分子水平上, AFLP和ISSR(Xu et al, 2008; 2009)的分析结果表明, 松江鲈鱼丹东群体、秦皇岛群体间的分化不明显。相反, 线粒体D-Loop区的序列分析结果则显示, 这两个群体间存在显著的遗传分化(Fst=0.1422,P<0.05), 而盘锦群体与它们间的分化却不明显(P>0.01) (Liu et al, 2010)。上述观点的不尽一致, 应与研究者所采用分析方法灵敏度的不一、样本数量多少不等及采样群体地理位置的远近等等有关。
本研究发现, 虽然松江鲈鱼4个地理群体间的Fst值(0.02~0.08间)不是很大, 但这些群体间却都存在显著(P<0.05)或极显著(P<0.01)的遗传分化, 特别是LR与YL、LR与FR群体间的Fst值(0.05903和0.07986)较大, 揭示滦河群体与鸭绿江、富春江群体间的分化已达到Wright (1978)标准的中等程度。这一结果与Wang et al (2008)的形态研究结果相符, 也与Liu et al (2010)报道的线粒体分析结果部分的一致。不过需要指出的是, 本研究的4个群体间的基因交流值(Nm=5~20>4)都比较大, 特别是YL、YR、FR群体间的基因交流值更大(12~20), 表明它们间的基因交流较为频繁, 这可能掩盖了各群体间固有的部分遗传差异, 从而影响了彼此间遗传分化指数的大小。松江鲈鱼繁殖期间及其幼鱼在近海岸生长阶段, 季节性海洋沿岸流增加了不同地理种群间的混杂与基因交流的机会, 特别是地理位置相对较近、同属于黄海海区的YR和YL群体, 这种交流更易发生。
在UPGMA聚类图中(图2), YL、YR、FR群体间的关系与彼此地理位置的远近相一致, 呈现出从北到南的分布格局, 而LR群体与它们的亲缘关系都较远, 显示出明显的遗传差异。
3.2 SCAR标记的应用
由特异性的RAPD条带转化而来的SCAR标记,克服了RAPD重复性欠佳的弱点, 已被广泛应用于分子标记辅助育种、种质鉴定等方面(Li et al, 2010; Lu et al, 2011; Zou et al, 2005)。本研究由S1255605bp和S1255841bp两条RAPD特异性条带成功转化出SCAR01560bp和SCAR02443bp的SCAR标记。大样本检测表明, 它们的出现频率在YL、FR群体都很高(83%~97%), 在YR群体比较高(56%~67%), 而在LR群体却很低(13%~20%)。因此, SCAR01560bp和SCAR02443bp可作为鉴别滦河群体与其他3群体的分子标记。至于这两个标记与什么性状相关联,有待以后的研究来证实。有趣的是, 在每群体的30尾样本中, YL、FR群体未出现这两个标记的样本数(1~2和3~5个), 恰与LR群体出现这两个标记的样本数(4~6个)接近。若假设这些个体恰好在3群体间发生了互换, 则YL、FR群体出现与LR群体不出现标记的频率几乎达到100%。LR群体的养殖性能较其他海区的差(Pan et al, 2010), 在4群体中的遗传多样性最低、UPGMA聚类树中与其他群体的关系最远等, 都揭示该群体具有自身的遗传结构特点, 推测渤海湾海区内可能存在松江鲈鱼的独立产卵场, 值得深入调查。
本研究的另外3个RAPD标记, 经克隆、测序后, 虽曾设计多对引物进行验证, 但都未能成功转化为SCAR标记。类似的现象在鲤(Gao et al, 2007)、团头鲂(Zou et al, 2005)、奥利亚罗非鱼(Gao et al, 2008)的SCAR标记转化中都存在。究其原因可能是:(1)S1255525 bp、S1345695 bp和S1345825 bp片段在基因组中可能是高度重复序列, 在转化为SCAR标记时特异性消失; (2)若产生 RAPD 特异性位点发生在随机引物的退火区, 用随机引物进行 RAPD扩增时发生错配, 退火不良而不能扩增, 而随机引物 3'端增加了 9~15个碱基后, 在非特异性区提供了足够的同源性, 克服了最初的错配允许引物退火扩增,使原有的特异性消失(Gao et al, 2007; Xu et al, 1995); (3)也可能是特异RAPD带位于引物的 3'端或者与基因的遗传距离较远, 连锁不紧密造成的(Gao et al, 2007)。
接下来, 我们将着力寻找YL、YR、FR群体间的特异性分子标记, 为松江鲈鱼天然种质资源库的保护提供分子水平上的鉴定手段。
致谢:辽宁省水产苗种管理局检疫检测中心唐作鹏研究员、丹东市水产技术推广站梁天红高级工程师、山东省垦利县周辉先生和浙江省杭州市金良庭先生协助采集松江鲈鱼样品, 上海海洋大学王成辉教授和本校水产与生命学院的2009级李雪松、马召腾帮助处理数据, 在此一并致谢。
Barman HK, Barat A, Yadav BM, Banerjee S, Meher PK, Reddy PVGK, Jana RK. 2003. Genetic variation between four species of Indian major carps as revealed by random amplified polymorphic DNA assay[J]. Aquaculture,213(1-4): 115-123.
Excoffier L, Laval G, Schneider S.2005. Arlequin (version 3.0): An integrated software package for population genetics data analysis[J]. Evol Bioinform,1: 47-50.
Gao FY, Ye X, Lu WX, Huang ZH, Zhang T. 2008. RAPD analysis and SCAR transformation of three populations of Oreochromis aureus[J]. J Shanghai Fish Univ,17(1): 22-27. [高风英,叶星,卢迈新,黄樟翰,张庭. 2008. 3个奥利亚罗非鱼群体遗传多样性的RAPD分析和SCAR标记的转化[J].上海水产大学学报,17(1): 22-27.]
Gao JS, Sun XW, Liang LQ. 2007. Conversion of RAPD markers linked to cold tolerance to SCAR markers in common carp[J]. J Dalian Fish Univ,22(3): 194-197. [高俊生,孙效文,梁利群. 2007.鲤抗寒性状的RAPD标记转化为SCAR标记的研究[J].大连水产学院学报,22(3): 194-197.]
Han ZQ, Zhuang ZM, Gao TX, Liu JX, Li YH, Wang ZY, Tang QS. 2007. Genetic diversity in Cynoglossus semilaevis by AFLP, RAPD and mtDNA markers[J]. J Fish Sci Chn,14(2): 192-200. [韩志强,庄志猛,高天翔,刘进贤,李玉晖,王志勇,唐启升. 2007.半滑舌鳎DNA的群体遗传变异[J].中国水产科学,14(2): 192-200.]
Hubei Institute of Hydrobiology Laboratory of Ichthyology. 1976. Fishes in Yangtze River[M]. Beijing:Science Press, 214-215. [湖北省水生生物研究所鱼类研究室. 1976.长江鱼类[M].北京:科学出版社, 214-215.]
Li SF, Tang SJ, Cai WQ. 2010. RAPD-SCAR markers for genetically improved NEW GIFT Nile Tilapia (Oreochromis niloticus niloticus L.) and their application in strain identification[J]. Zool Res,31(2): 147-153. [李思发,唐首杰,蔡完其. 2010.遗传改良“新吉富” (NEW GIFT)尼罗罗非鱼RAPD-SCAR标记开发及其在品系鉴别中的应用[J].动物学研究,31(2): 147-153.]
Liu HL, Zhang Q, Tang YL, Yu FY, Zhou JY. 2010. Structure and genetic diversity of mtDNA D-Loop sequences among Trachidermus fasciatus stocks in Yellow Sea and Bohai Sea of China[J]. Mar Sci Bull,29(3): 283-288. [刘海林,章群,唐优良,余帆洋,周佳怡. 2010.黄渤海松江鲈鱼线粒体控制区结构与序列多态性分析[J].海洋通报,29(3): 283-288.]
Liu ZZ, Yang JQ, Wang ZQ, Tang WQ. 2009. Genetic structure and population history of Beleophthalmus petinirostris in Yangtze River Estuary and its Southern Adjacent Regions[J]. Zool Res,30(1): 1-10. [刘至治,杨金权,王正琦,唐文乔. 2009.长江口及其南部邻近地区大弹涂鱼种群遗传结构及种群历史分析[J].动物学研究,30(1): 1-10.]
Lu YP, Hu ZH, Wang CH, Xiang SP, Su XP, Yao ZL, Wang KW. 2011.SRAP and SCAR molecular marker related to body color of “whole red” patterns of Cyprinus carpio var. color[J]. Acta Hydrobiol Sin,35(1): 45-50. [吕耀平,胡则辉,王成辉,项松平,苏小平,姚子亮,王凯伟. 2011.与“全红”瓯江彩鲤体色相关的SRAP及SCAR分子标记[J].水生生物学报,35(1): 45-50.]
Pan LD, Cai F, Ma ZT, Jiang X. 2010. The resources conservation and population features of Trachidermus fasciatus of China[J]. Fish Sci Technol Inform,37(5): 211-215. [潘连德,蔡飞,马召腾,蒋鑫. 2010.中国境内松江鲈鱼的种群特征以及资源保护[J].水产科技情报,37(5): 211-215.]
Rozen S, Skaletsky HJ. 2000. Primer3 on the WWW for generalusers and for biologist programmers[M] // Krawetz S, Misener S. Bioinformatics Methods and Protocols: Methods in Molecular Biology. New Jersey: Humana Press, 365-386.
Tamura K, Dudley J, Nei M, Kumar S. 2007. MEGA4: Molecular Evolutionary Genetics Analysis (MEGA) software version 4.0[J]. Mol Biol Evol,24(8): 1596-1599.
Tang SJ, Li SF, Cai WQ. 2011. Mitochondrial DNA analysis on genetic variation of wild, domesticated, and genetically selected populations of blunt snout bream (Megalobrama amblycephala)[J]. J Fish Sci Chn,18(3): 1-10. [唐首杰,李思发,蔡完其. 2011.团头鲂野生、驯养、选育3类遗传生态群体遗传变异的线粒体DNA分析[J].中国水产科学,18(3): 1-10.]
Vrijenhoek RC.1994. Genetic diversity and fitness in small populations[M] // Loeschcke V, Tomiuk J, Jian S K, eds. Conservation Genetics. Basel: Birkhäuser, 37-53.
Wang JQ, Cheng G, Tang ZP. 2001. The distribution of Roughskin Sculpin (Trachidermus fasciatus Heckel) in Yalu River Basin, China[J]. J Fudan Univ: Nat Sci,40(5): 471-475. [王金秋,成功,唐作鹏. 2001.鸭绿江流域中国境内松江鲈的分布[J].复旦学报:自然科学版,40(5): 471-475.]
Wang JQ, Liang HZ. 2008. Populations identification in morphology of roughskin sculpin Trachidermus fasciatus in China[J]. Ocean Limnol Sin,39(4): 348-353. [王金秋,梁鸿子. 2008.基于形态性状的松江鲈鱼(Trachidermus fasciatus)种群鉴别[J].海洋与湖沼,39(4): 348-353.]
Wang JQ, Shi C, Cheng G. 2002. Isozyme analysis for a wild population of Roughskin Sculpin, Trachidermus fasciatus, from the Yalu River Basin in China[J]. J Fudan Univ: Nat Sci,41(6): 688-693. [王金秋,石椿,成功. 2002.鸭绿江流域中国境内松江鲈鱼(Trachidermus fasciatus)天然种群的同工酶分析[J].复旦学报:自然科学版,41(6): 688-693.]
Wang YH. 2006. Notes on the scientific name, type-locality and geographical distribution of roughskin sculpin (Trachidermis fasciatus Heckel,1840)[J]. Mar Fish,28(4): 299-303. [王幼槐. 2006.关于淞江鲈学名和模式产地以及地理分布之探讨[J].海洋渔业,28(4):299-303.]
Welsh J, McClelland M. 1990. Fingerprinting genomes using PCR with arbitrary primers[J]. Nucleic Acids Res,18(24): 7213-7218.
Williams JGK, Kubelik AR, Livak KJ, Rafalski JA Tingey SV. 1990. DNA polymorphisms amplified by arbitrary primers are useful as genetic markers[J]. Nucleic Acids Res,18(22): 6531-6535.
Wright S. 1978. Evolution and the Genetics of Populations. Vol. 4: Variabilty Within and Among Natural Populations[M]. Chicago: University of Chicago Press.
Xu H, Wilson DJ, Arulsekar S, Bakalinsky AT. 1995. Sequence-specific polymerase chain-reaction markers derived from randomly amplified polymorphic DNA markers for fingerprinting grape (Vitis) rootstocks[J]. J Amer Soc Hort Sci,120(5): 714-720.
Xu JR, Han XL, Li N, Xu P, Bao ZM. 2008. Analysis of genetic diversity in roughskin sculpin Trachidermus fasciatus by AFLP markers[J]. J Dalian Fish Univ,23(6): 437-441.[徐建荣,韩晓磊,李宁,许璞,包振民. 2008.松江鲈群体遗传多样性的AFLP分析[J].大连水产学院学报,23(6): 437-441.]
Xu JR, Han XL, Yu JF, Bao F, Xu P. 2009. Analysis of genetic diversity of Trachidermus fasciatus by ISSR[J]. Freshwat Fish,39(1): 21-24. [徐建荣,韩晓磊,郁建锋,鲍峰,许璞. 2009.松江鲈群体遗传多样性的ISSR分析[J].淡水渔业,39(1): 21-24.]
Yan JP, Liu SJ, Sun YD, Zhang C, Luo KK, Liu Y. 2005. RAPD and microsatellite analysis of diploid gynogens from allotetraploid hybrids of red crucian carp (Carassius auratus)× common carp ( Cyprinus carpio)[J]. Aquaculture,234(1-4): 49-60.
Zhang JB, Wang HJ, Cai ZP. 2007. The application of DGGE and AFLP-derived SCAR for discrimination between Atlantic salmon (Salmo salar) and rainbow trout (Oncorhynchus mykiss)[J]. Food Control,18(6): 672-676.
Zou SM, Li SF, Cai WQ. 2005. SCAR transformation of a RAPD marker in blunt snout bream “Pujiang No. 1”[J]. J Fish Chn,29(3): 296-299. [邹曙明,李思发,蔡完其. 2005.团头鲂“浦江1号”一个RAPD标记的SCAR转化[J].水产学报,29(3): 296-299.]
Analysis of genetic diversity in wild populations ofTrachidermus fasciatusby RAPD and the transformation of two SCAR markers
ZENG Zhen, LIU Zhi-Zhi*, PAN Lian-De*, TANG Wen-Qiao, WANG Qian#, GENG Yun-Hao#
(Key Laboratory of Exploration and Utilization of Aquatic Genetic Resources Certificated by Ministry of Education, Shanghai Ocean University, Shanghai 201306, China)
Firstly, RAPD was conducted to analyze genetic diversity ofTrachidermus fasciatusin the Fuchun River population (FR), Yellow River population (YR), Luan River population (LR), and Yalu River population (YL), with 32 polymorphic 10-bp random primers selected from 294 ones. Thirty wild individuals were detected in each population. The results indicated that the genetic diversity ofT.fasciatuswas relatively rich. The major results were as the following: 1) Altogether, 591 bands were detected and 515 of them were polymorphic, accounted for 87.14%. The range of proportion of polymorphic loci (P) was: FR(89.17%)>YR(87.99%)>YL(86.63%)>LR(83.25%). 2) The Shannon’s information index(IT) and Nei’s genetic diversity(HT) among populations were 0.3393−0.3566 and 0.2157−0.2279, respectively. Compare to other three populations, LR population had relative lower values. If took the populations as a whole, the total Nei’s genetic diversity(HT) and Shannon’s information index(IT) was 0.2336±0.1643 and 0.3710±0.2153, respectively. 3) The value of gene flow (Nm) (5.76103−19.84497) were high, indicating certain gene exchange existedamong the four populations. But the AMOVA results exhibited significantly differentiation (P<0.05 orP<0.01) among the populations. 4) In the UPGMA tree constructed according to genetic distance, YL and YR populations clustered firstly, then with FR population, and finally they joined to LR population. Obviously, the YL, YR and FR populations had relatively close relationship according to their geographic distance, whereas LR population showed clear divergence to the other three populations. Secondly, out of the five special RAPD bands (S1225525bp, S1225605bp, S1225841bp, S1345695bpand S1345825bp), SCAR maker SCAR01560bpand SCAR02443bpwere successfully transformed from S1255605bpand S1255841bp, respectively. After large samples examination of the two markers, we found the highest frequency (96.67% and 93.33%) in the YL population, higher frequency (83.33% and 90%) in the FR population, high frequency (56.67% and 66.67%) in the YR population, and the lowest frequency (13.33% and 20 %) in the LR population. Therefore, SCAR01560bpand SCAR02443bpcan be used as special molecular markers for the population identification between LR and other three populations.
Trachidermus fasciatus; Genetic diversity; RAPD; SCAR marker
Q959.483; Q343
A
0254-5853-(2012)02-0203-08
10.3724/SP.J.1141.2012.02203
2011-11-03;接受日期:2012-02-14
上海市教育委员会重点学科(海洋生物学)建设项目(J50701);上海市科技兴农项目(沪农科推字2006-3-5);上海市水生生物学重点学科建设项目(S30701);上海市重点学科建设项目(Y1101)
∗通信作者(Corresponding authors),E-mail: zzliu@shou.edu.cn; ldpan@shou.edu.cn
#2007生物科学(海洋生物方向本科生)
曾珍(1987-),女,江西抚州人,硕士研究生。专业方向为鱼类分子进化与免疫遗传学。E-mail:zengzhen2010@126.com
猜你喜欢
杂志排行
Zoological Research的其它文章
- Bacterial expression and purification of biologically active human TFF2
- 酸性环境下铝对斑马鱼运动行为和学习记忆能力的影响暨与阿尔海默茨症的相互关系
- Smallest bitter taste receptor (T2Rs) gene repertoire in carnivores
- A new spider species of the genus Sudharmia from Sumatra, Indonesia (Araneae, Liocranidae)
- Complete mitogenome of the Lesser Purple Emperor Apatura ilia (Lepidoptera: Nymphalidae: Apaturinae) and comparison with other nymphalid butterflies
- Acute lesions of primary visual cortical areas in adult cats inactivate responses of neurons in higher visual cortices
