高山离子芥愈伤组织总RNA的提取方法研究
2012-12-24岳修乐李争艳徐世健安黎哲
岳修乐,李争艳,徐世健,张 华,安黎哲
(1.兰州大学生命科学学院,甘肃 兰州730000;2.安徽省农业科学院畜牧兽医研究所,安徽 合肥230031)
随着分子生物学的发展,越来越多的研究需要从转录水平上着手,深入分析研究基因的功能,如基因全长cDNA序列的克隆、基因表达模式的研究(Real-Time PCR、Northern Blotting等)、cDNA 文库构建、基因芯片分析、小RNA的筛选等,而获取高质量的RNA是这些实验成功的第一步[1-4]。
高山离子芥(Chorisporabungeana)属十字花科草本植物,主要分布在我国新疆天山山脉一号冰川雪线附近,常年忍受着冷冻胁迫和剧烈的温度变化,是一种典型的冰缘植物,是研究抗冻机制的理想材料[5-9],对于利用其抗冻基因对农作物进行抗冻性改良,提高寒流等恶劣条件下的生存率和产量等具有广泛前景和深远意义[10-11]。但是,作为低温生物学领域一种比较新的研究对象,由于没有太多借鉴,在研究时,经常会出现RNA提取不稳定、提取条件不好把握、操作繁琐、容易降解的难题。鉴于此,本研究采用不同的提取方法、保存温度和时间,以及提取前后的RNA酶处理等,探讨高山离子芥高质量RNA的提取方法,深入分析影响RNA质量的关键因素,并对条件进行优化,以期为冰缘植物高山离子芥的深入研究夯实基础,为其他物种的RNA提取提供借鉴。
1 材料与方法
1.1 高山离子芥愈伤组织 高山离子芥愈伤组织的获取方法参照文献[12-13],并进行了一些修改。成熟的高山离子芥种子去皮,用70%的乙醇浸泡30s,离心后加入2%的次氯酸钠和0.01%的TritonX-100,轻柔振荡10min,之后离心用无菌水清洗5~7次,子叶用无菌手术刀切断后种植于MS诱导培养基(MS+1mg·L-12,4-D+0.2 mg·L-16-BA+30mg·L-1蔗糖+0.6%琼脂,pH值为5.7),获得的愈伤组织在继代培养基(MS+0.5mg·L-12,4-D+0.1mg·L-16-BA+0.5mg·L-1NAA+30mg·L-1蔗糖+0.6%琼脂,pH值为5.7)上进行培养。培养条件为18℃,16h光照8h黑暗,湿度为60%。新鲜材料直接使用或液氮速冻后-80℃保存备用。
1.2 RNA提取前的准备工作 实验中用到的枪头、离心管等浸泡在0.1%的DEPC水中,1)完全浸泡:枪头朝下浸没在DEPC水中,离心管浸没后,用镊子或玻璃棒驱离残留在管底的气泡。2)不完全浸泡:枪头和离心管随意放置在玻璃容器后加入DEPC水中。室温摇动过夜,第2天在超净台转移出液体到一试剂瓶,和处理过的枪头、离心管、干净的研钵、镊子等一起高温(121℃)灭菌30min。超净台、移液器等工具用75%乙醇擦拭备用。
1.3 RNA的提取
1.3.1 改良的Trizol法 根据Invitrogen公司Trizol试剂说明书[14],称取100mg新鲜的高山离子芥愈伤组织(或保存在-80℃的样品),放入液氮预冷过的研钵中,添加液氮,研磨至粉末状,研磨过程中不要使液氮干掉;加入1mL Trizol试剂到研钵中,Trizol试剂遇冷会凝固,继续研磨至Trizol完全融化成液体,这时样品应均匀混合在试剂中。自研钵吸取混合液到一支新1.5mL离心管中,加入200 μL氯仿,剧烈震荡混匀20~30s,室温静置5min,4℃14 000r·min-1离心10min,吸上清约500μL到一支新离心管中,加入等体积的酚/氯仿/异戊醇(25∶24∶1,pH 值5.1),再次剧烈震荡20~30s,室温静置5min,然后4℃14 000r·min-1离心15 min。离心后,吸上清约400μL到一支新离心管中,加入等体积的异丙醇,颠倒混匀,室温静置3~5 min后4℃10 000r·min-1离心10min;弃上清,加入1mL 75%的乙醇,颠倒使白色沉淀悬浮,4℃10 000r·min-1离心5min;重复用75%的乙醇洗盐一次,操作同上一步;然后弃上清,用移液枪吸干残留的液体,超净台内风干10min,加DEPC水50 μL溶解,直接使用或-80℃保存备用。
1.3.2 CTAB 法 参照李高等[15]及 Chang等[16]的方法。称取100mg新鲜组织在液氮中充分研磨成粉末状,加入650μL CTAB提取液[2%CTAB,2 mol·L-1NaCl,2%PVP,0.1mol·L-1EDTA(pH 值8.0),25mmol·L-1EDTA(pH 值8.0),2%巯基乙醇],立即振荡混匀,65℃水浴10min,期间每2min上下颠倒1次;加入等体积的酚/氯仿/异戊醇(25∶24∶1,体积比),剧烈震荡30s,4℃14 000r·min-1离心15min;吸上清到一支新的无RNase的1.5mL离心管中,加入等体积的氯仿/异戊醇(24∶1,体积比),再次剧烈震荡30s,4 ℃14 000r·min-1离心15min;吸上清到一支新的无RNase的1.5mL离心管中,加入DNase I进行消化(参照NEB公司DNase I试剂说明,Catalog No.M0303L),37℃水浴1h。充分消化后,加入等体积的氯仿/异戊醇(24∶1,体积比),剧烈震荡30s,4℃14 000r·min-1离心15min;上清液转移到另一支新的无RNase的1.5mL离心管中,加入1/3体积的8mol·L-1LiCl,颠倒混匀,-20℃ 静置2h;之后,4℃14 000r·min-1离心20min,弃上清,加入1mL 70%乙醇,上下颠倒混匀,4℃10 000 r·min-1离心5min。室温晾干,加入50μL DEPC水溶解沉淀。
1.3.3 柱式离心法 操作完全按照Tiangen公司总RNA提取试剂盒说明书(Tiangen总RNA提取试剂盒,Catalog No.DP419)。
1.4 RNA的检测
1.4.1 琼脂糖凝胶电泳检测 用去离子水配置0.4 mol·L-1的NaOH,浸泡电泳槽、制胶板及制胶梳,30min以上,之后用DEPC水清洗,用DEPC水配置电泳缓冲液,在DEPC水处理过的三角瓶中配置1%的琼脂糖凝胶,电泳检测RNA的质量。出现清晰的3条带,第1条带(28SrRNA)是第2条带(18S rRNA)的2倍亮度为最佳[17]。
1.4.2 吸光度分析 取2μL提取的RNA稀释50倍,用微量比色皿对RNA在260、280和230nm的吸光度进行检测。OD260/OD280在1.8~2.0为佳,OD260/OD230大于1.8为佳[17-18]。
1.4.3 RT-PCR检测 取2μg经DNA酶(Formentas,Catalog No.EN0521)消化过的总RNA,反转录成cDNA,方法参照 M-MuLV Reverse Transcriptase 产 品 手 册 (Formentas,Catalog No.EP0351)。以1μL反转录的cDNA为模板,扩增高山离子芥看家基因CbACTIN(GeneBank Accession No.AY82536)来检测RNA质量对后续研究的影响,CbACTIN的引物为,

扩增条件为94℃ 预变性2min;94℃变性30s,55℃退火40s,72℃延伸1min,共30个循环。1%的琼脂糖凝胶电泳检测PCR产物。
1.5 RNA的保存 分别采用室温(25℃)、-80℃保存RNA,在特定的时间进行电泳检测,来观察保存温度对RNA造成的影响。
2 结果与分析
2.1 不同方法提取RNA结果分析
2.1.1 RNA纯度和得率 Trizol法、柱式离心法和CTAB法提取高山离子芥RNA,得到的RNAOD260/OD280分别在1.88~1.95、1.92~1.98和1.38~1.42,OD260/OD230分别在 2.03~2.21、1.95~2.31和0.83~1.23(表1)。说明柱式离心法得到的RNA纯度最高;改良Trizol法的纯度和柱式离心法的非常接近,也比较纯,可以满足各种后续研究对RNA的要求;CTAB法纯度较低,对于很多后续的实验要求都很难满足。改良Trizol法、柱式离心法和CTAB法得率分别在29.6~35.2、14.8~17.9和17.5~23.3μg·g-1(表1)。改良Trizol法的得率最高,柱式离心法的得率最低,对于需要大量RNA的后续研究,改良Trizol法是最佳选择。
表1 不同方法提取RNA的吸光度检测Table 1 OD value of extracted RNA by different methods
2.1.2 RNA完整性分析 改良Trizol法和柱式离心法都能获得较高质量的RNA,尤其是改良Trizol法提取的RNA完整性最好,条带清晰,28SrRNA条带亮度接近18SrRNA的2倍(图1)。CTAB法得到的RNA条带出现一定程度的降解。

图1 3种不同的方法提取高山离子芥RNA得到的电泳图Fig.1 Electropherogram of RNA from three different extraction methods
2.1.3 RT-PCR检测结果 将3种不同的方法提取的RNA反转录成cDNA,以此为模板扩增高山离子芥看家基因CbACTIN。结果发现,改良的Trizol法和柱式离心法均能得到较好的扩增效果,而CTAB法得到的条带非常弱,扩增效果比较差,难以达到后续实验的要求(图2)。

图2 高山离子芥看家基因CbACTIN扩增后的电泳图Fig.2 Electropherogram of Chorispora bungeana housekeeping gene CbACTIN
2.2 枪头、离心管去RNA酶处理不完全的结果 比较枪头、离心管不完全浸泡和完全浸泡DEPC水对RNA质量造成的影响,完全浸泡可以得到比较清晰的条带,而不完全浸泡则发生大量降解(图3)。
2.3 保存条件对RNA的影响 溶解在水中的RNA保存在室温时,在8h后出现少量降解,20h后已经大部分开始降解(图4),所以最好8h以内使用,否则将会影响下游的实验;而在-80℃的RNA则可以保存较长的时间,至少30d之内使用没有问题(图5)。

图3 枪头、离心管等去RNA酶处理对RNA质量的影响Fig.3 The influence of residual RNase on RNA integrity
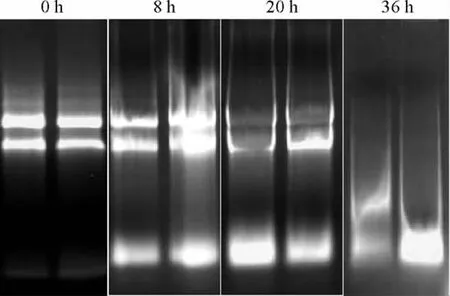
图4 室温保存不同时间对RNA的影响Fig.4 The influence of different storage time at room temperature on RNA integrity
2.4 电泳槽及电泳液去RNA酶处理前后RNA电泳的结果 在去RNA酶处理后进行的电泳,条带清晰,没有发生降解;而在没有处理的条件下进行的电泳,RNA基本完全降解(图6)。
3 讨论与小结
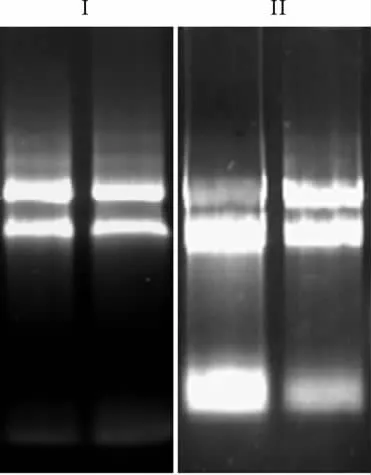
图5 -80℃保存30d对RNA的影响Fig.5 The influence of 30days storage at-80℃on RNA integrity
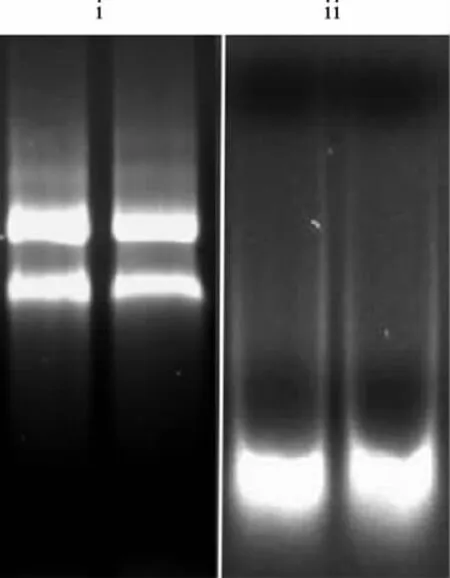
图6 电泳槽和电泳液RNA酶灭活处理前后对RNA电泳结果的影响Fig.6 The influence on RNA electrophoresis results before and after RNase inactivation treatment in electrophoresis tank and solution
3.1 提取方法的选择 物种不同,往往其体内的各物质含量也不尽相同[19-21],蛋白质、酚类、多糖等物质的含量高低,是影响RNA提取质量的重要因素[17],这就要求研究人员根据物种的具体情况调整RNA提取的方法和步骤,采取最合适的方法提取高质量的RNA,从而保证后续研究的可靠性。高山离子芥作为一种冰缘植物,具有极强的抗寒能力,分析检测证明其体内含有较高的脯氨酸及可溶性多糖的含量[22-23]。本研究分别采用改良的Trizol法、柱式离心法和CTAB法对高山离子芥进行RNA的提取,结果证明,改良的Trizol法、柱式离心法都可以得到较高质量的RNA,但是前者有更高的RNA得率,考虑到分离柱对RNA的大小具有选择性,对特定范围内的RNA有较好的吸附能力,特别大或特别小的RNA则很难吸附甚至无法吸附。所以,建议采用改良的Trizol法来提取高质量的RNA,进行后续的研究。在对RNA的要求较低时可以考虑采用柱式离心法。而CTAB法表现出操作繁琐、耗时长、提取质量不高的弱点,不建议采用。
3.2 枪头、离心管的处理对RNA质量的影响在提取RNA之前要用DEPC水浸泡枪头、离心管等直接和RNA接触的工具,灭活RNA酶,如果处理不充分将会造成RNA的降解。然而,简单的把枪头和离心管放入DEPC水中并不能做到完全的浸泡,致使实验失败仍难于找出原因,这主要是由于枪头、离心管等塑料器具,在DEPC水中浸泡时,会飘浮起来,或者在离心管底残留气泡,即使长时间摇动也很难去除,所以,这和没有经过DEPC水处理的枪头、离心管并无区别,导致实验失败。本研究改良的方法是:对于枪头,选用较细的试剂瓶,使枪尖朝下保持竖直浸没在DEPC水中;对于离心管,在浸没DEPC水中之后,用长镊子或细玻璃棒在有气泡的离心管底部轻轻搅拌,逐一驱离气泡,保证完全浸没,达到灭活RNA酶的效果。
3.3 样品品质对RNA品质的影响 样品的品质相当于先天性因素,没有好的样品品质就难以提取高品质的RNA,所以RNA的提取一定要尽量选用新鲜材料,或者采集后液氮速冻-80℃短期保存的材料。另外,样品要选取新鲜部位的组织,不要采集衰老部位的组织。对于提取RNA时样品的起始量上,一定要保证100mg样品加入1mL Trizol,超出这个量很可能会造成RNA降解、抽提不干净、蛋白质或无机物污染等。
3.4 电泳试剂去RNA酶的处理对RNA检测的影响 电泳液及电泳槽等工具对RNA完整性的检测结果也有着重要影响,处理不好会使检测结果不能真实反映提取的RNA质量,本研究比较了电泳槽经0.4mol·L-1的氢氧化钠浸泡30min以及用DEPC水配置的缓冲液进行电泳和不作这些处理进行的电泳,结果显示,在没有处理的电泳槽里跑的RNA基本上完全降解,说明电泳试剂及工具的RNA酶灭活是影响检测结果非常大的因素,这一步RNA酶的灭活不容忽视。
3.5 保存条件对RNA的影响 在提取RNA后,需要进行质量的检测以及定量分析,有时还需进行酶切消化再提纯等的操作,这会消耗一定的时间,针对长时间操作后RNA质量是否完好的问题,本研究进行了室温和-80℃的保存检测,实验证明,提取之后溶解在水中的RNA可以在-80℃保存较长的时间,30d之内使用质量仍较好,而保存在室温的RNA则最好在8h以内使用,超过8h之后,RNA的完整性则难以保证。
[1]Fursova O V,Pogorelko G V,Tarasov V A.Identification ofICE2,agene involved in cold acclimation which determines freezing tolerance inArabidopsisthaliana[J].Gene,2009,429(12):98-103.
[2]Gelsthorpe A R,Gelsthorpe K,Sokol R J.Rapid isolation of total RNA from small samples of hypocellular,dense connective tissues[J].Biotechniques,1997,22(6):1082-1086.
[3]von Stein O D,Thies W G,Hofmann M.A high throughput screening for rarely transcribed differentially expressed genes[J].Nucleic Acids Research,1997,25(13):2598-2602.
[4]Yoo S D,Cho Y H,Sheen J.Arabidopsismesophyll protoplasts:A versatile cell system for transient gene expression analysis[J].Nature Protocols,2007,2(7):1565-1572.
[5]安黎哲,刘艳红,冯虎元,等.乌鲁木齐河源区高寒冰缘植物化学元素的含量特征[J].西北植物学报,2000,20(6):1063-1069.
[6]阿依吐尔汗,谭敦炎,李志军,等.高山离子芥营养器官的结构与环境的关系[J].新疆农业大学学报,1998,21(4):273-277.
[7]Liu Y J,Jiang H F,Zhao Z G,etal.Nitric oxide synthase like activity-dependent nitric oxide production protects against chilling-induced oxidative damage inChorisporabungeanasuspension cultured cells[J].Plant Physiology and Biochemistry,2010,48(12):936-944.
[8]Si J,Wang J H,Zhang L J,etal.CbCOR15,a cold-regulated gene from alpineChorisporabungeana,conferscold tolerance in transgenic tobacco[J].Journal of Plant Biology,2009,52(6):593-601.
[9]Yang N,Yue X L,Chen X L,etal.Molecular cloning and partial characterization of a novel phospholipase D gene fromChorisporabungeana[J].Plant Cell,Tissue and Organ Culture,2011,108(2):201-212.
[10]Yadav S K.Cold stress tolerance mechanisms in plants[J].Agronomy for Substainable Development,2010,30(3):515-527.
[11]Zhang J Z,Creelman R A,Zhu J K.From laboratory to field,using information fromArabidopsisto engineer salt,cold,and drought tolerance in crops[J].Plant Physiology,2004,135(2):615-621.
[12]Fu X Y,Chang J F,An L Z,etal.Association of the cold-hardiness ofChorisporabungeanawith the distribution and accumulation of calcium in the cells and tissues[J].Environmental and Experimental Botany,2006,55(3):282-293.
[13]Wang J H,An L Z,Wang R Y,etal.Plant regeneration ofChorisporabungeanavia somatic embryogenesis[J].In Vitro Cellular & Developmental Biology,2006,42(2):148-151.
[14]Simms D,Cizdziel P E,Chomczynski P.TRIzol:A new reagent for optimal single-step isolation of RNA[J].Focus,1993,15(4):532-535.
[15]李高,单雷,周丽侠,等.花生总RNA提取方法比较研究[J].中国农学通报,2011,27(1):214-218.
[16]Chang S,Puryear J,Cairney J.A simple and efficient method for isolating RNA from pine trees[J].Plant Molecular Biology Reporter,1993,11(2):113-116.
[17]Fleige S,Pfaffl M W.RNA integrity and the effect on the real-time qRT-PCR performance[J].Molecular Aspects of Medicine,2006,27(23):126-139.
[18]Gehrig H,Winter K,Cushman J,etal.An improved RNA isolation method for succulent plant species rich in polyphenols and polysaccharides[J].Plant Molecular Biology Reporter,2000,18(4):369-376.
[19]巩艳明,曹后男,宗成文,等.三种方法提取不同品种梨叶片总 RNA[J].湖北农业科学,2011,50(15):3204-3206.
[20]肖旭峰,姜文轩,吴才君,等.野葛块根总RNA的不同提取方法比较研究[J].江西农业大学学报,2011,33(1):147-150.
[21]赵钟鑫,王健,李琴,等.阔叶薰衣草叶片总RNA两种提取法的比较[J].热带农业科学,2011,31(8):55-58.
[22]Guo F,Zhang M,Chen Y,etal.Relation of several antioxidant enzymes to rapid freezing resistance in suspension cultured cells from alpineChorisporabungeana[J].Cryobiology,2006,52(2):241-250.
[23]Wu J M,Qu T,Chen S,etal.Molecular cloning and characterization of aγ-glutamylcysteine synthetase gene fromChorisporabungeana[J].Protoplasma,2008,235(14):27-36.
